Содержание
- 2. Почему протекают химические реакции На бумаге можно написать уравнение любой химической реакции («бумага все стерпит»), а
- 3. Термодинамика - наука о взаимных превращениях различных видов энергии. Первый закон термодинамики — закон сохранения энергии:
- 5. Известно, что при химических реакциях происходят глубокие качественные изменения в системе, рвутся связи в исходных веществах
- 6. Тепловой эффект химических реакций
- 7. Рассмотрим два возможных случая: 1. E реагентов > E продуктов. Исходя из закона сохранения энергии, в
- 8. 2. Е реагентов Реакции, при протекании которых энергия поглощается из окружающей среды, называют эндотермическими.
- 9. Энергия, которая выделяется или поглощается в химической реакции, называется, тепловым эффектом этой реакции. Этот термин используют
- 10. Уравнение химической реакции, в котором указан тепловой эффект, называется термохимическим уравнением. Например, термохимическое уравнение: 2Н2 +
- 11. Знание тепловых эффектов химических реакций имеет большое практическое значение. Например, при проектировании химического реактора важно предусмотреть
- 12. Расчёт теплового эффекта реакции Если реакция проходит между несложными молекулами, то подсчитать тепловой эффект реакции достаточно
- 13. А как, например, рассчитать тепловой эффект реакции разложения карбоната кальция? Ведь это соединение немолекулярного строения. Как
- 14. Например, сжигая уголь в кислороде, нельзя определить Qобр угарного газа СО, так как всегда идет и
- 15. Тепловой эффект химической реакции равен сумме теплот образования всех продуктов реакции минус сумма теплот образования всех
- 16. Если данное химическое соединение можно непосредственно получить из простых веществ, причем реакция идет количественно (100% -ный
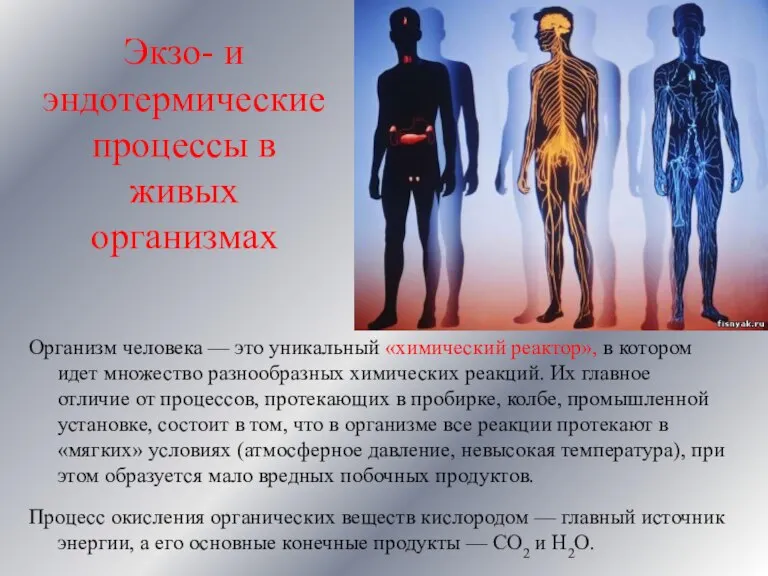
- 17. Экзо- и эндотермические процессы в живых организмах Организм человека — это уникальный «химический реактор», в котором
- 18. Эта выделившаяся энергия представляет собой большую величину, и если бы пища окислялась в организме быстро и
- 19. Каждый человек должен хотя бы приблизительно представлять, сколько энергии поступает в его организм с пищей и
- 20. Наиболее полезно питание с невысокой калорийностью, но с наличием всех компонентов в пище (белков, жиров, углеводов,
- 21. Энтропия Энергетическая ценность продуктов питания и теплотворная способность топлива связаны с экзотермическими реакциями их окисления. Движущей
- 22. Представьте, что вы в стакан насыпали разные орехи. Практически невозможно добиться при встряхивании их расслоения, упорядоченности,
- 23. Энтропия газов значительно превышает энтропию жидких и тем более твердых тел. Если вы прольете немного бензина
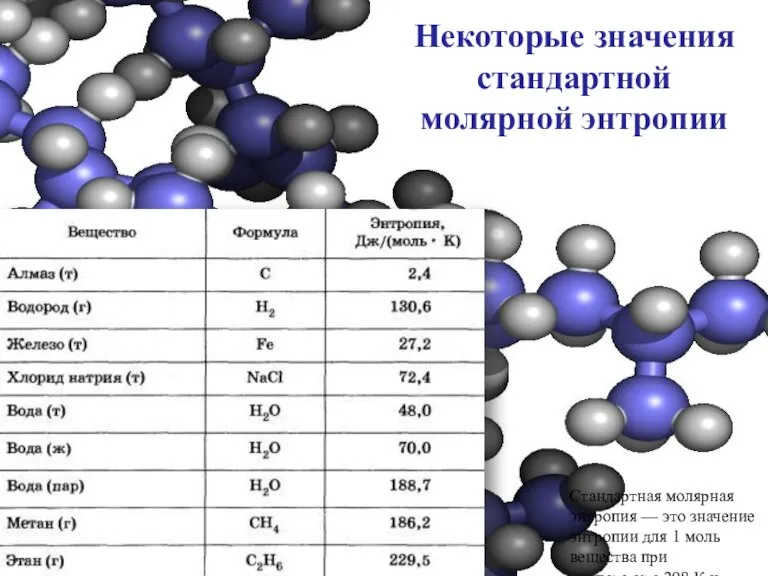
- 24. Некоторые значения стандартной молярной энтропии Стандартная молярная энтропия — это значение энтропии для 1 моль вещества
- 25. Анализируя данные, приведенные в таблице, обратите внимание, насколько мало значение энтропии для алмаза, имеющего очень правильную
- 26. Выводы: 1. Направление химической реакции определяется двумя факторами: стремлением к уменьшению внутренней энергии с выделением энергии
- 27. Существуют экспериментальные и теоретические методы определения знтропий различных химических соединений. Используя эти методы, можно количественно рассчитать
- 29. Скачать презентацию
























 Породы кроликов
Породы кроликов Орехоплодовые сосны. Достижения и перспективы в центрально-черноземном регионе
Орехоплодовые сосны. Достижения и перспективы в центрально-черноземном регионе Моделирование как метод познания
Моделирование как метод познания НПО «Криста»
НПО «Криста» Ахроматическая гармония. Общие принципы построения композиции. Занятие №4
Ахроматическая гармония. Общие принципы построения композиции. Занятие №4 Визитная карточка начальной школы ГУО «Гимназия №20 г.Минска»
Визитная карточка начальной школы ГУО «Гимназия №20 г.Минска» ПЕРМСКИЙ КАДЕТСКИЙ КОРПУС
ПЕРМСКИЙ КАДЕТСКИЙ КОРПУС Голливудский макияж. Классика, которая всегда уместна
Голливудский макияж. Классика, которая всегда уместна Скульптура Санкт-Петербурга
Скульптура Санкт-Петербурга На родине Астафьева
На родине Астафьева  Автор: Жаринов Николай Викторович, учитель истории МОУ «Васильчуковская СОШ» МОУ «Васильчуковская СОШ» Ключевского района, Алтай
Автор: Жаринов Николай Викторович, учитель истории МОУ «Васильчуковская СОШ» МОУ «Васильчуковская СОШ» Ключевского района, Алтай Архитектура западноевропейского средневековья
Архитектура западноевропейского средневековья Стекловолокно. Получение стекловолокна
Стекловолокно. Получение стекловолокна به نام خدا
به نام خدا The simple or indefinite past tense in Lithuanian. Simplified view of the past tense conjugation in Lithuanian
The simple or indefinite past tense in Lithuanian. Simplified view of the past tense conjugation in Lithuanian Техника борьбы лёжа. Удержания
Техника борьбы лёжа. Удержания Россия! Роса и сила и синее что-то
Россия! Роса и сила и синее что-то «Поспорили однажды корень, стебель, лист – кто из них важнее?»
«Поспорили однажды корень, стебель, лист – кто из них важнее?» Наследственные болезни 9 класс
Наследственные болезни 9 класс Концепция проведения ежегодного всероссийского слёта юных туристов в 2020 году
Концепция проведения ежегодного всероссийского слёта юных туристов в 2020 году Реклама instagram. Макет рекламы
Реклама instagram. Макет рекламы Психология профессиональной карьеры
Психология профессиональной карьеры Сжатие текста Урок русского языка, 9 класс, подготовка к ГИА 9
Сжатие текста Урок русского языка, 9 класс, подготовка к ГИА 9 Практикум по решению задач. Природа и основные свойства цвета
Практикум по решению задач. Природа и основные свойства цвета Презентация на тему Святые войны
Презентация на тему Святые войны  Развивающая программа
Развивающая программа Детские зарисовки
Детские зарисовки Изделие Волшебные фигурки
Изделие Волшебные фигурки