Содержание
- 2. вещества или их комбинации, вступающие в контакт с организмом человека или животного, проникающие в органы, ткани
- 3. - разработка, доклинические исследования, клинические исследования, экспертиза, государственная регистрация, стандартизация и контроль качества, производство, изготовление, хранение,
- 5. - лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения,
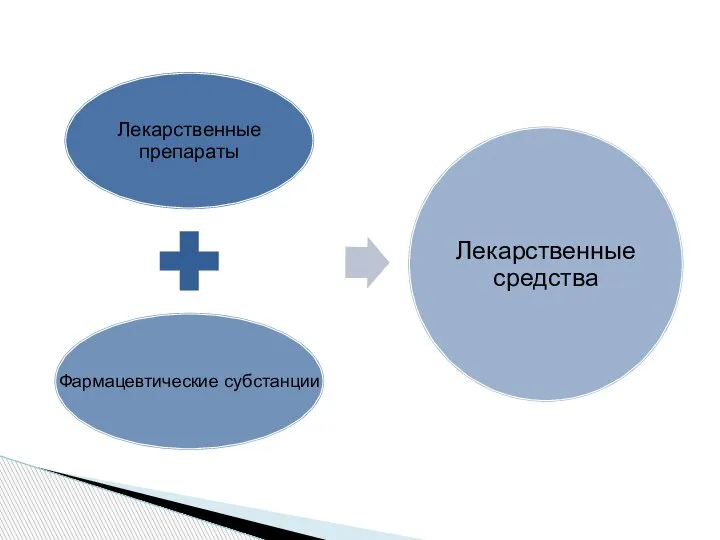
- 6. Фармацевтическая субстанция лекарственное средство в виде одного или нескольких обладающих фармакологической активностью действующих веществ вне зависимости
- 7. фальсифицированное лекарственное средство - лекарственное средство, сопровождаемое ложной информацией о его составе и (или) производителе; недоброкачественное
- 8. В Российской Федерации допускаются производство, изготовление, хранение, перевозка, ввоз в Российскую Федерацию, вывоз из Российской Федерации,
- 9. осуществляется по результатам экспертизы лекарственных средств. Экспертиза лекарственных средств основывается на принципах законности, соблюдения прав и
- 10. 1) все ЛП, впервые подлежащие вводу в обращение в Российской Федерации; 2) ЛП, зарегистрированные ранее, но
- 11. 1) ЛП, изготовленные аптечными организациями, ветеринарными аптечными организациями, ИП, которые имеют лицензию на фармацевтическую деятельность, по
- 12. 1) лекарственных препаратов, отличающихся друг от друга качественным составом действующих веществ, под одинаковым торговым наименованием; 2)
- 13. - документ, подтверждающий факт государственной регистрации ЛП. Регистрационное удостоверение ЛП с указанием лекарственных форм и дозировок
- 14. - кодовое обозначение, присвоенное лекарственному препарату при его государственной регистрации Регистрационный номер
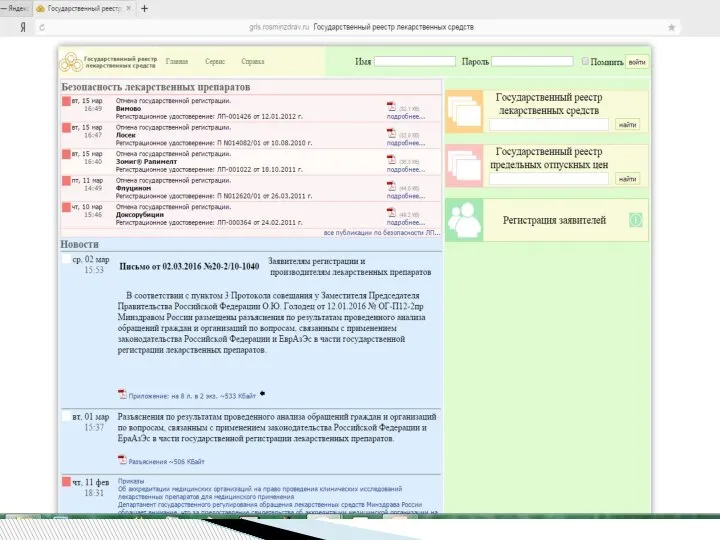
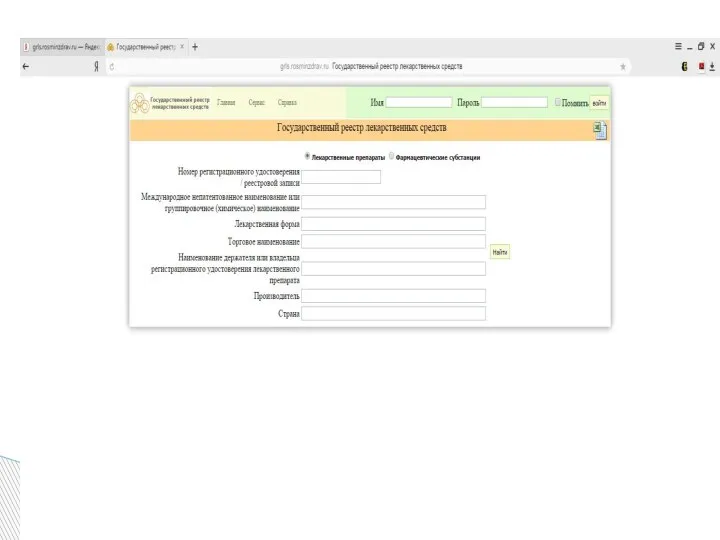
- 16. содержит перечень лекарственных препаратов, прошедших государственную регистрацию, перечень фармацевтических субстанций, входящих в состав лекарственных препаратов. Регистрацию
- 19. Информация о ЛП, отпускаемых по рецепту должна содержаться только в специализированных изданиях, предназначенных для медицинских, фармацевтических,
- 20. Информация о ЛП, отпускаемых без рецепта может содержаться в публикациях и объявлениях средств массовой информации, специализированных
- 21. любые инструменты, аппараты, приборы, оборудование, материалы и прочие изделия, применяемые в медицинских целях отдельно или в
- 22. включает в себя технические испытания, токсикологические исследования, клинические испытания, экспертизу качества, эффективности и безопасности МИ, их
- 23. На территории Российской Федерации разрешается обращение медицинских изделий, зарегистрированных в порядке, установленном Правительством Российской Федерации, уполномоченным
- 24. Фальсифицированное МИ - МИ, сопровождаемое ложной информацией о его характеристиках и (или) производителе (изготовителе). Недоброкачественное МИ-
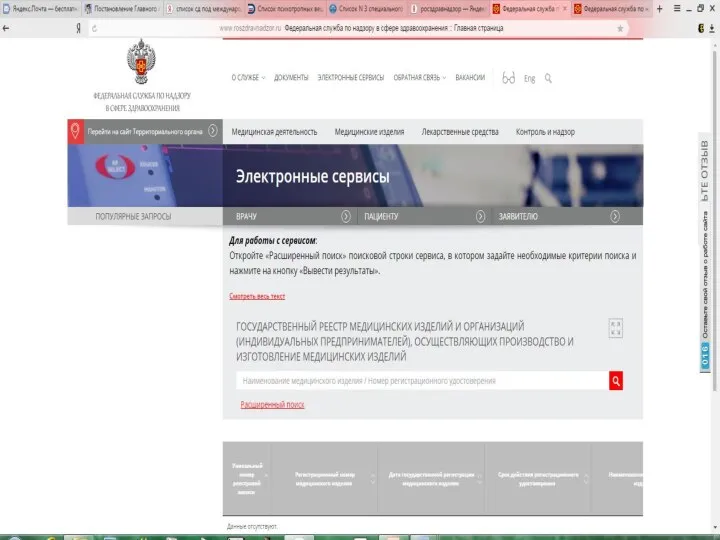
- 25. Регистрацию МИ и ведение государственного реестра медицинских изделий и организаций (индивидуальных предпринимателей), осуществляющих производство и изготовление
- 28. Регистрация БАД Федеральный закон от 02.01.2000 № 29-ФЗ «О качестве и безопасности пищевых продуктов» Приказ Роспотребнадзора
- 29. Не допускается реализация БАД - не прошедших государственной регистрации; - без удостоверения о качестве и безопасности;
- 30. Регистрация БАД Регистрацию БАД и ведение реестра осуществляет Роспотребнадзор РФ и размещает его на своем официальном
- 34. Скачать презентацию


























 Prezentatsia_10
Prezentatsia_10 Жиры
Жиры Производственная логистика
Производственная логистика Презентация на тему Этические нормы речевой культуры
Презентация на тему Этические нормы речевой культуры
 БЕЛЫЙ МЕДВЕДЬ - КОРОЛЬ СНЕЖНОЙ ПУСТЫНИ
БЕЛЫЙ МЕДВЕДЬ - КОРОЛЬ СНЕЖНОЙ ПУСТЫНИ Формирование затрат на основе динамики трудоемкости производства
Формирование затрат на основе динамики трудоемкости производства Информатизация культурного наследия в Латвии: основные идеи и их реализациУна Балоде,Государственное управление музеев Латвии,
Информатизация культурного наследия в Латвии: основные идеи и их реализациУна Балоде,Государственное управление музеев Латвии, Проект и основные этапы его разработки
Проект и основные этапы его разработки Сельское поселение Куруш муниципального образования Докузпаринский район
Сельское поселение Куруш муниципального образования Докузпаринский район Правила игры баскетбол
Правила игры баскетбол Презентация на тему Сказки А.С.Пушкина
Презентация на тему Сказки А.С.Пушкина Музей школы 1283
Музей школы 1283 Бионика в архитектере
Бионика в архитектере Оптимизация затрат на упаковку за счет рационального использования технологии, возможностей и услуг предоставляемых типографией
Оптимизация затрат на упаковку за счет рационального использования технологии, возможностей и услуг предоставляемых типографией РЕЗУЛЬТАТЫ СРАВНЕНИЯ ТЕХНИКО-ЭКОНОМИЧЕСКИХ ПОКАЗАТЕЛЕЙ ТЕПЛОЭНЕРГЕТИЧЕСКИХ ОБЪЕКТОВ Филатов В.И., к.т.н., Филатова С.Д., Никифор
РЕЗУЛЬТАТЫ СРАВНЕНИЯ ТЕХНИКО-ЭКОНОМИЧЕСКИХ ПОКАЗАТЕЛЕЙ ТЕПЛОЭНЕРГЕТИЧЕСКИХ ОБЪЕКТОВ Филатов В.И., к.т.н., Филатова С.Д., Никифор Военачальники СССР в ВОВ (1941 – 1945ГГ.)«Вечная память всем, кто боролся за независимость страны, во благо всего человечества, за мир
Военачальники СССР в ВОВ (1941 – 1945ГГ.)«Вечная память всем, кто боролся за независимость страны, во благо всего человечества, за мир  Колесо фортуны
Колесо фортуны Водные виды спорта
Водные виды спорта Путешествие в волшебную страну
Путешествие в волшебную страну Вместе с сыном, вместе с дочкой
Вместе с сыном, вместе с дочкой Презентация на тему The Old New Year (Старый Новый год)
Презентация на тему The Old New Year (Старый Новый год) Snowmaiden
Snowmaiden Презентация на тему Михаил Юрьевич Лермонтов Жизнь и творчество
Презентация на тему Михаил Юрьевич Лермонтов Жизнь и творчество  Мы живем в Российском государстве
Мы живем в Российском государстве Презентация на тему Элементы статистики
Презентация на тему Элементы статистики  Кафедра физико – математических дисциплин
Кафедра физико – математических дисциплин Студия современного танца Фишка
Студия современного танца Фишка ОБЖ
ОБЖ