Содержание
- 2. Пострепликативная репарация (PRR) включает: 1. Рекомбинационная репарация брешей, расположенных против повреждений в комплементарной цепи ДНК. 2.
- 3. Синтез ДНК через повреждение
- 4. Ключевую роль в процессах синтеза ДНК через повреждение играют специализированные TLS-ДНК-полимеразы. Большинство из них относится к
- 5. На следующем слайде в качестве напоминания пройденного представлена упрощенная схема SOS-репарации у E.coli.
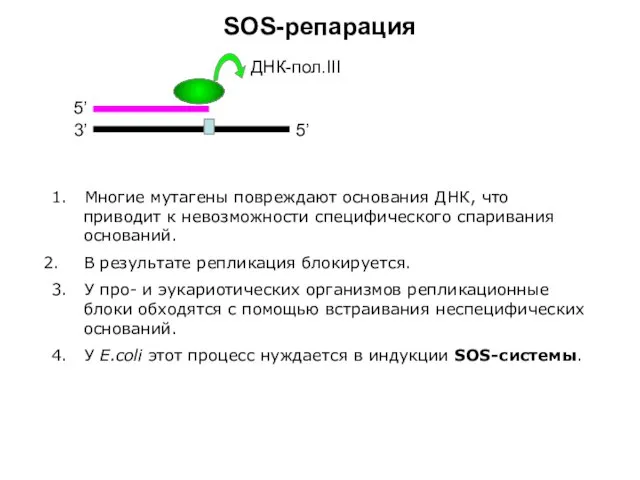
- 6. SOS-репарация 3’ 5’ 5’ ДНК-пол.III 1. Многие мутагены повреждают основания ДНК, что приводит к невозможности специфического
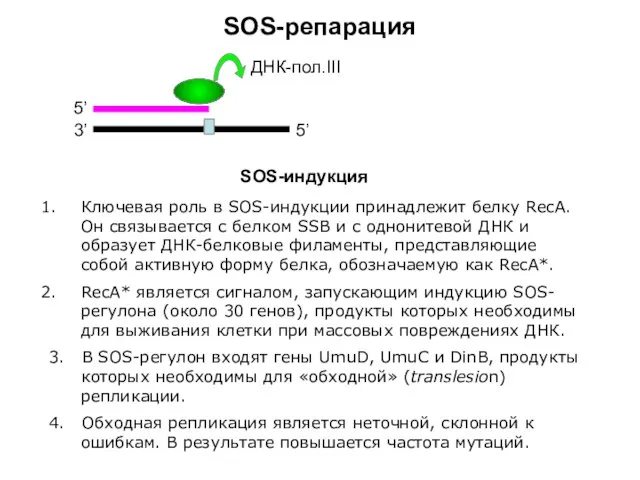
- 7. SOS-репарация 3’ 5’ 5’ ДНК-пол.III SOS-индукция Ключевая роль в SOS-индукции принадлежит белку RecA. Он связывается с
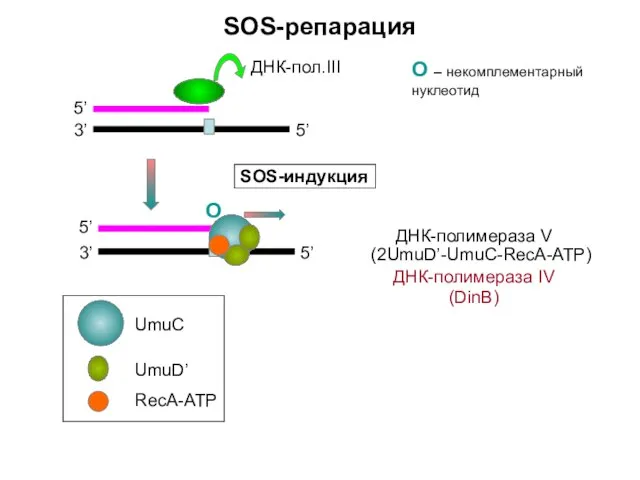
- 8. SOS-репарация 3’ 5’ 5’ О SOS-индукция О – некомплементарный нуклеотид ДНК-полимераза V (2UmuD’-UmuC-RecA-ATP) ДНК-полимераза IV (DinB)
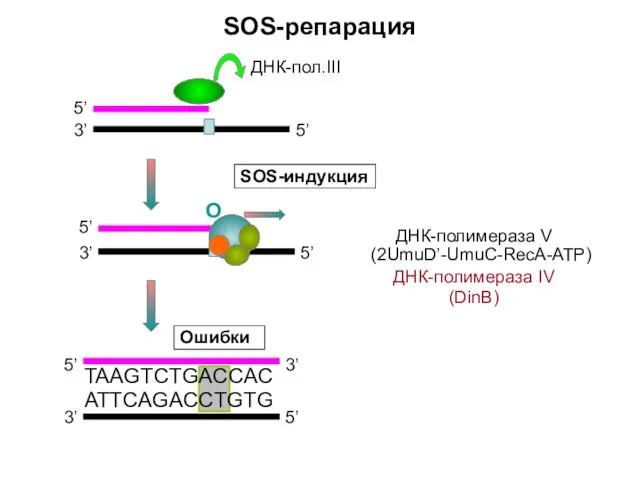
- 9. SOS-репарация 3’ 5’ 5’ 5’ 3’ 3’ 5’ TAAGTCTGACCAC ATTCAGACCTGTG Ошибки О SOS-индукция ДНК-полимераза V (2UmuD’-UmuC-RecA-ATP)
- 10. У эукариот с блоком репликации также помогает справиться рекомбинационная репарация (отличающаяся от таковой у прокариот), но
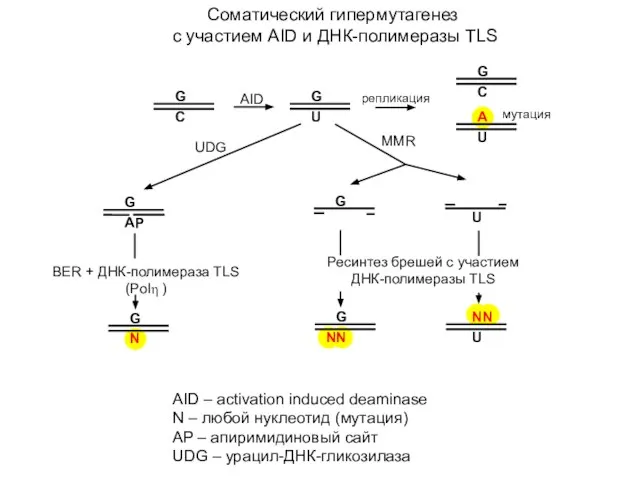
- 11. Соматический гипермутагенез с участием AID и ДНК-полимеразы TLS AID – activation induced deaminase N – любой
- 12. PRR поврежденных вилок репликации ДНК
- 13. У эукариот к PRR относят, главным образом, процессы репарации DD в вилках репликации ДНК. DD, оказавшиеся
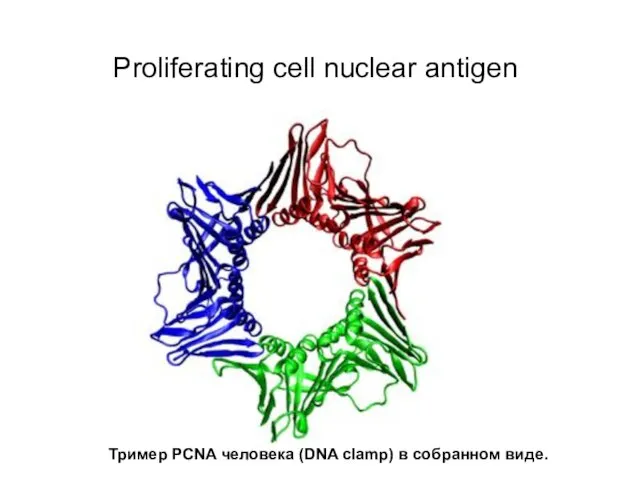
- 14. Важную роль в обоих путях играют белки PCNA и RFC. Ядерный белок PCNA (proliferating cell nuclear
- 15. Proliferating cell nuclear antigen Тример PCNA человека (DNA clamp) в собранном виде.
- 16. PCNA, но уже в модифицированной (убиквитинированной) форме, вовлечен в PRR, которая включает две ветви: Ветвь 1.
- 17. Ветвь 2. Переключение матричных цепей, которое осуществляется через DD с помощью механизма гомологичной рекомбинации. Белок PCNA
- 18. Ключевым моментом в этих процессах является посттрансляционная модификация PCNA посредством убиквитинирования. Убиквитины и убиквитин-подобные белки являются
- 19. Из убиквитин-подобных белков наиболее известен SUMO – small ubiquitin-like modifier. Cyмоилирование регулирует многочисленные клеточные процессы: активность
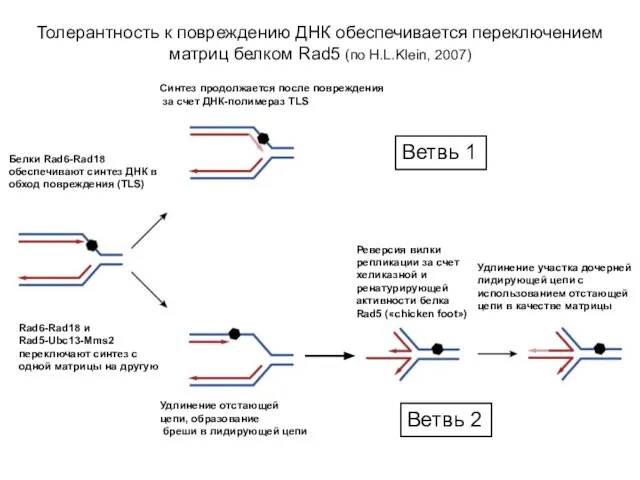
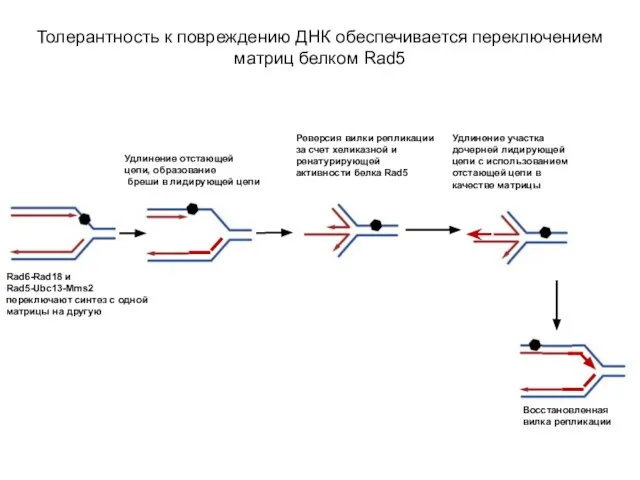
- 20. Белки Rad6-Rad18 обеспечивают синтез ДНК в обход повреждения (TLS) Rad6-Rad18 и Rad5-Ubc13-Mms2 переключают синтез с одной
- 21. Рисунок: Толерантность к повреждению ДНК обеспечивается переключением матриц белком Rad5 Ветвь 1 (левая верхняя часть рисунка)
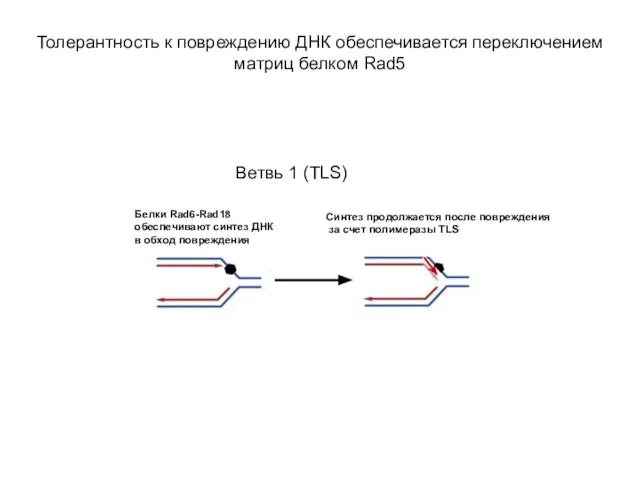
- 22. Толерантность к повреждению ДНК обеспечивается переключением матриц белком Rad5 Ветвь 1 (TLS)
- 23. Ветвь 1. У многих бактерий, а также архей и эукариот выявлены несколько TLS ДНК-полимераз – ортологов
- 24. Во многих случаях в TLS участвуют две или более ДНК-полимеразы. Одна из них (инсертер) встраивает нуклеотид
- 25. Вследствие высокого мутагенного потенциала TLS-полимераз для клетки жизненно важно регулировать их взаимодействия с ДНК. Система регуляции
- 26. Как было отмечено выше, TLS-полимеразы взаимодействуют с белками-зажимами ДНК типа PCNA, которые удерживают в контакте репликативные
- 27. В клетках мыши мутаген бенз[α]пирендигидродиолэпоксид (BPDE) индуцирует арест репликации ДНК (чекпойнт S-фазы) и вызывает моноубиквитинирование белка
- 28. Взаимодействия TLS-полимераз с зажимом может не только удерживать TLS-полимеразу в позиции, позволяющей быстрое прохождение через DD,
- 29. Известен альтернативный гетеротримерный ДНК-зажим, проявляющий структурное сходство с PCNA и называемый 9-1-1. У млекопитающих и дрожжей
- 30. Основная функция 9-1-1 заключается в активации DD-чекпойнта, поэтому его обычно называют чекпойнтовым комплексом. Кроме того, он
- 31. Кроме того, комплекс 9-1-1 может быть вовлечен в регуляцию индуцированного Polζ-зависимого мутагенеза, так как у мутантов
- 32. В совокупности представленные данные свидетельствуют о роли комплекса белков Rad6-Rad18 в глобальном контроле генов в пути,
- 33. PRR: ВЕТВЬ 2 ПЕРЕКЛЮЧЕНИЕ ЦЕПЕЙ ДНК В ВИЛКЕ РЕПЛИКАЦИИ Продолжение рисунка: Толерантность к повреждению ДНК обеспечивается
- 34. Ветвь 2 (по существу, это тот же механизм copy choice). Полиубиквитинирование PCNA в положении K63 запускает
- 35. Продолжение рисунка: Толерантность к повреждению ДНК обеспечивается переключением матриц белком Rad5 Белок Rad5 – член семейства
- 36. Толерантность к повреждению ДНК обеспечивается переключением матриц белком Rad5 Rad6-Rad18 и Rad5-Ubc13-Mms2 переключают синтез с одной
- 38. Скачать презентацию

















![В клетках мыши мутаген бенз[α]пирендигидродиолэпоксид (BPDE) индуцирует арест репликации ДНК (чекпойнт S-фазы)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/373909/slide-26.jpg)








 Casting Actors
Casting Actors National Sports Renju
National Sports Renju Стратегію підготовлено Мінекономрозвитку разом із експертами
Стратегію підготовлено Мінекономрозвитку разом із експертами  Не умри, и мы отстанем
Не умри, и мы отстанем Литература периода Великой Отечественной войны и первого послевоенного десятилетия.
Литература периода Великой Отечественной войны и первого послевоенного десятилетия. Объекты изучения физики
Объекты изучения физики В.Ф. Одоевский "Мороз Иванович"
В.Ф. Одоевский "Мороз Иванович" Епархиальные катехизаторско-педагогические курсы Нижнетагильской епархии
Епархиальные катехизаторско-педагогические курсы Нижнетагильской епархии «Строительство завода глубокой переработки масличных семян (ПЗПМС) производительностью 330 тыс. тонн/год (1000 тонн/сутки) по семенам
«Строительство завода глубокой переработки масличных семян (ПЗПМС) производительностью 330 тыс. тонн/год (1000 тонн/сутки) по семенам Природные зоны Земли
Природные зоны Земли Осень в природе 2 часть
Осень в природе 2 часть Презентация Тришиной Марины Богородские игрушки и Сергиево Посадские матрёшки
Презентация Тришиной Марины Богородские игрушки и Сергиево Посадские матрёшки Презентация на тему Маша и медведь
Презентация на тему Маша и медведь  Применение искусственного интеллекта в сельском хозяйстве
Применение искусственного интеллекта в сельском хозяйстве Прямоугольный параллелепипед
Прямоугольный параллелепипед Урок КВН "ПРИРОДА ВОКРУГ НАС!"
Урок КВН "ПРИРОДА ВОКРУГ НАС!" ОРКСЭ. Итоговый урок за 2 четверть
ОРКСЭ. Итоговый урок за 2 четверть Проекционные визуальные средства обучения
Проекционные визуальные средства обучения ПРЕЗЕНТАЦИЯ. ЧАСТЬ 2
ПРЕЗЕНТАЦИЯ. ЧАСТЬ 2 Как выбрать идеальный авточехол
Как выбрать идеальный авточехол Такие разные числа
Такие разные числа 1 сентября 1993 года открылась новая школа
1 сентября 1993 года открылась новая школа Параметры экспертизы конкурсных заявок в рамках проекта «Школа Росатома»
Параметры экспертизы конкурсных заявок в рамках проекта «Школа Росатома» Однородные и неоднородные определения
Однородные и неоднородные определения Программы учебных дисциплин в компетентностном формате
Программы учебных дисциплин в компетентностном формате Использование технологии проектной деятельности при подготовке конкурсных работ учащимися объединения хранители природы
Использование технологии проектной деятельности при подготовке конкурсных работ учащимися объединения хранители природы Назначение и принцип работы приборов радиационной и химической разведки. Лекция 11
Назначение и принцип работы приборов радиационной и химической разведки. Лекция 11 Получение оплаты за проживание и предоставление платных услуг в гостинице
Получение оплаты за проживание и предоставление платных услуг в гостинице