Содержание
- 2. Гомологи - это соединения, имеющие одинаковый функциональный характер, но отличающиеся числом углеродных атомов, входящих в состав
- 3. 1. ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ
- 4. 2. ИЗОМЕРИЯ АЛКАНОВ Изомерия – это явление, при котором вещества имеют одинаковый качественный и количественный состав,
- 5. Число структурных изомеров резко возрастает по мере увеличения числа углеродных атомов в молекуле алкана: ИЗОМЕРИЯ УГЛЕРОДНОГО
- 6. СТЕРЕОХИМИЯ И НАГЛЯДНОЕ ИЗОБРАЖЕНИЕ МОЛЕКУЛ Молекулы являются трехмерными объектами, и многое зависит от того, знаем ли
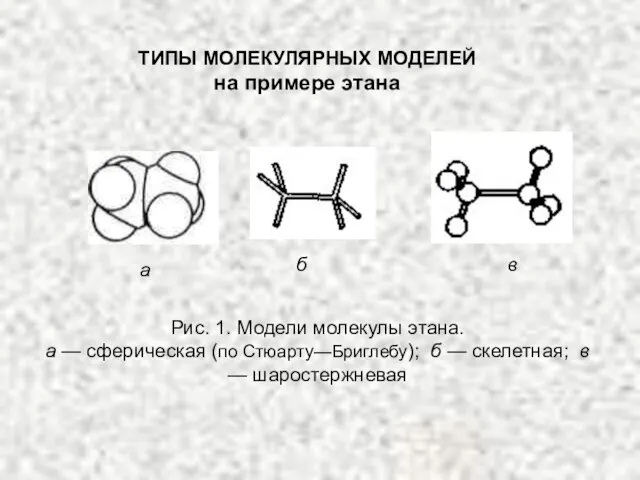
- 7. Рис. 1. Модели молекулы этана. а — сферическая (по Стюарту—Бриглебу); б — скелетная; в — шаростержневая
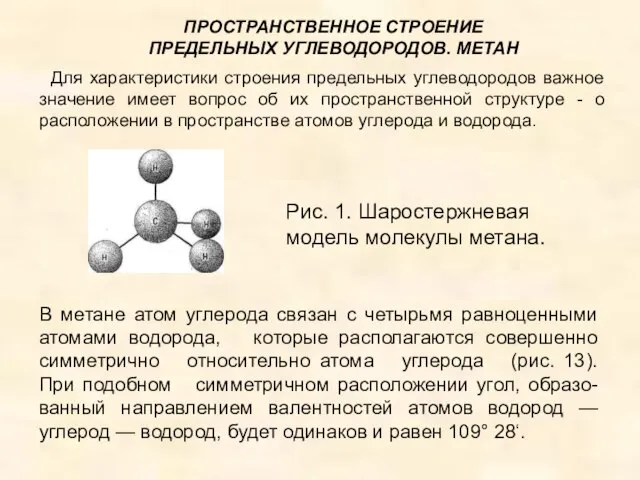
- 8. Рис. 1. Шаростержневая модель молекулы метана. В метане атом углерода связан с четырьмя равноценными атомами водорода,
- 9. Мысленное соединение линией всех атомов водорода в молекуле метана приводит к геометрической фигуре, называемой тетраэдром; в
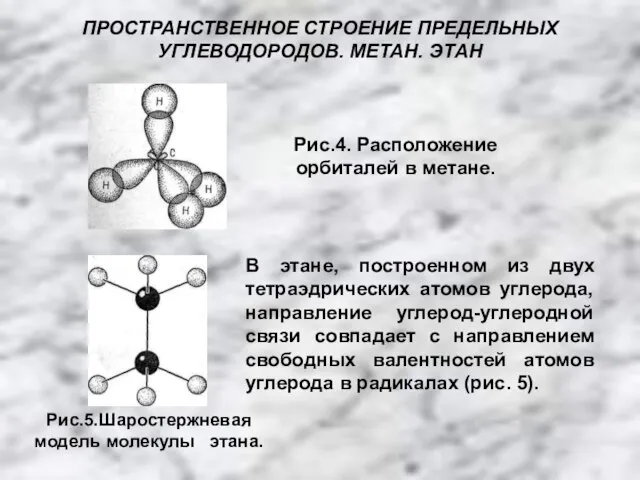
- 10. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВ. МЕТАН. ЭТАН Рис.4. Расположение орбиталей в метане. В этане, построенном из двух
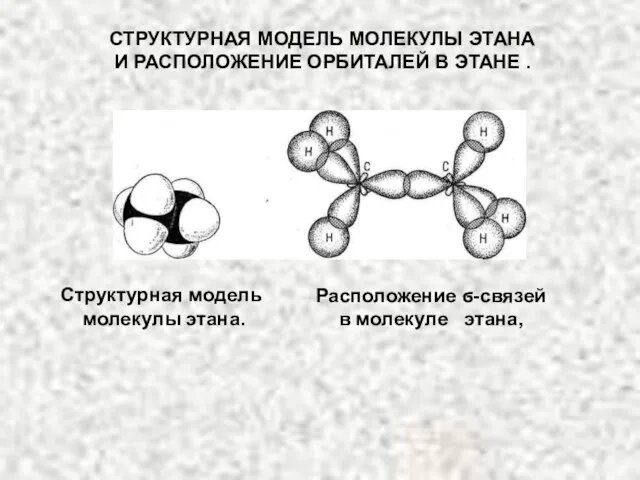
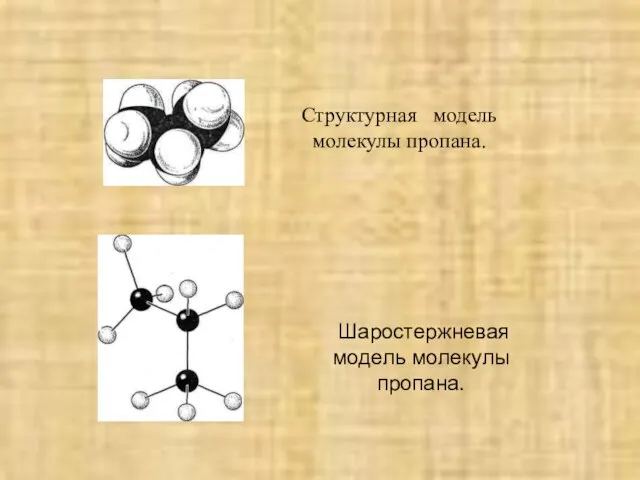
- 11. Расположение ϭ-связей в молекуле этана, СТРУКТУРНАЯ МОДЕЛЬ МОЛЕКУЛЫ ЭТАНА И РАСПОЛОЖЕНИЕ ОРБИТАЛЕЙ В ЭТАНЕ . Структурная
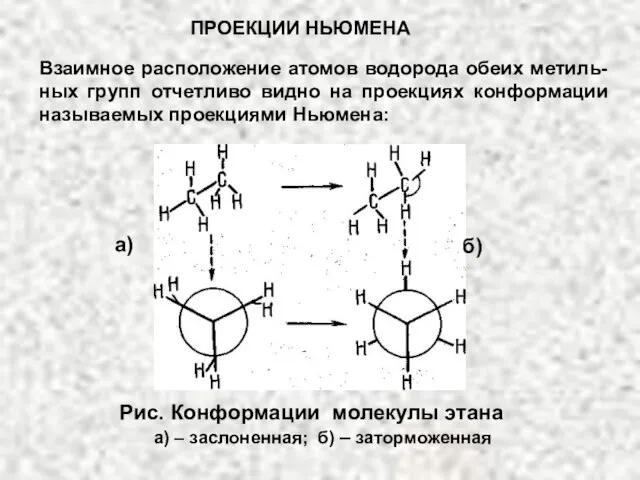
- 12. Для молекулы этана возможны две крайние конформации. В одной из них атомы водорода метильных групп расположены
- 13. Рис. Конформации молекулы этана а) – заслоненная; б) – заторможенная Взаимное расположение атомов водорода обеих метиль-ных
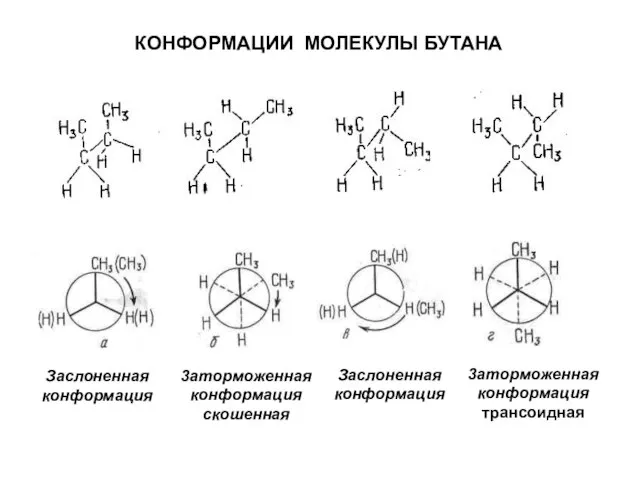
- 15. 3аторможенная конформация скошенная Заслоненная конформация Заслоненная конформация 3аторможенная конформация трансоидная КОНФОРМАЦИИ МОЛЕКУЛЫ БУТАНА
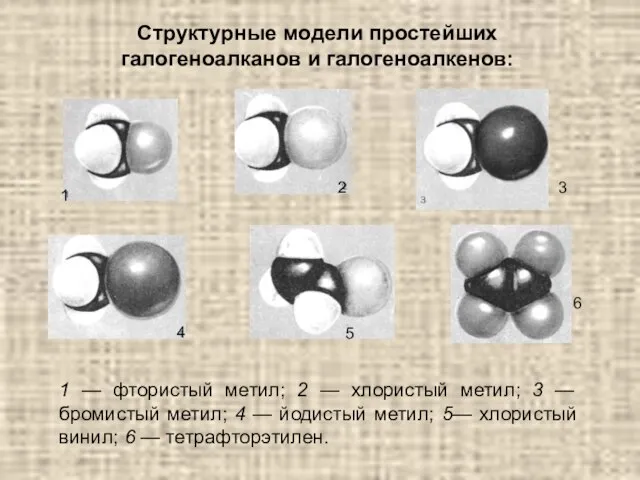
- 16. 1 — фтористый метил; 2 — хлористый метил; 3 — бромистый метил; 4 — йодистый метил;
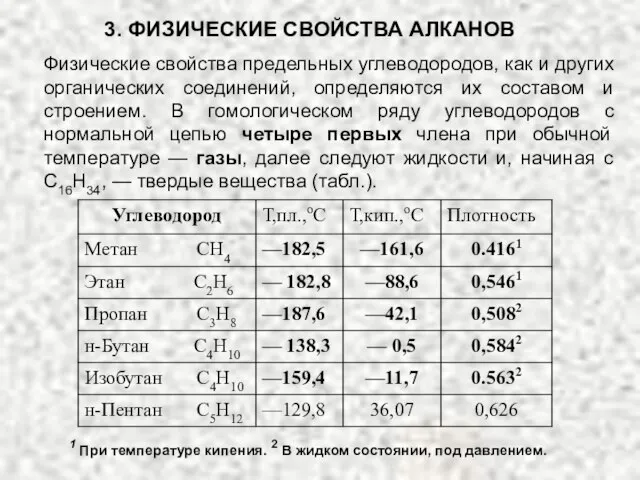
- 17. 3. ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ Физические свойства предельных углеводородов, как и других органических соединений, определяются их составом
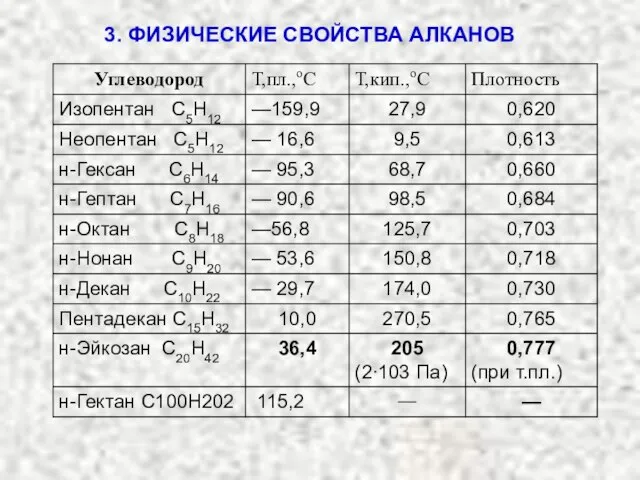
- 18. 3. ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
- 19. Температуры кипения в гомологическом ряду возрастают, причем разность температур кипения ближайших гомологов все время уменьшается. 3.
- 20. В промышленности в последнее время все большее значение приобретают методы разделения смесей с помощью катратов —
- 21. Температуры кипения в гомологическом ряду возрастают, причем разность температур кипения ближайших гомологов все время уменьшается. 3.
- 22. Это явление объясняют различным пространственным расположением концевых метильных групп относи-тельно друг друга. В углеводородах четного ряда
- 23. энантовая Т,пл. — 10,5оС каприловая Т,пл. 16,2оС пеларгоновая Т,пл. 12,5оС 3. ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ Т.пл. четных
- 24. 4. ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ. НЕФТЬ И ПУТИ ЕЕ ПЕРЕРАБОТКИ Алканы можно получить из соединений с
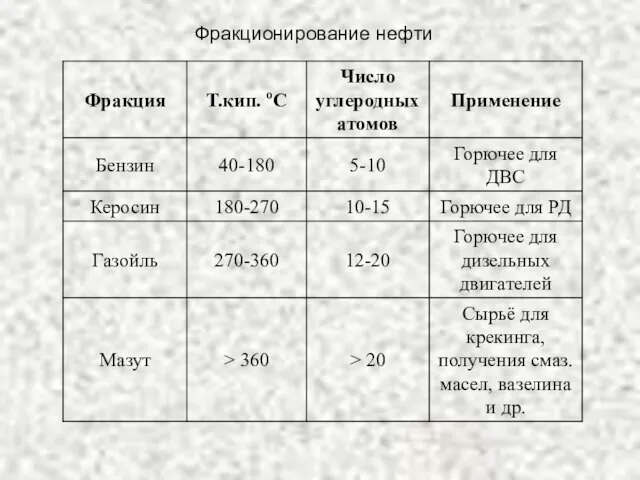
- 25. Фракционирование нефти
- 26. 4. ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ. НЕФТЬ И ПУТИ ЕЕ ПЕРЕРАБОТКИ Для увеличения выхода бензина и др.
- 27. 4. ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ. 1.3 Восстановление галогенопроизводных R-X а) R-X R-H + HX H2/Pt б)
- 28. 4. ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ. 1.4 Гидролиз магнийорганических соединений R-MgX R−MgX R-H + MgOHX H2O, Н+
- 29. 1.5 Реакция Вюрца: 4. ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ. 2C2H5I + 2Na С2Н5– С2Н5 + 2NaI возможный
- 30. Особенностью синтеза Вюрца является то, что он дает хорошие выходы в случае использования в качестве исходных
- 32. Скачать презентацию


















 Личность как предмет изучения
Личность как предмет изучения «1С-Рейтинг:Микрокредитная организация»
«1С-Рейтинг:Микрокредитная организация» Создание сводного электронного каталога "Книжные памятники Архангельской области": итоги и перспективы
Создание сводного электронного каталога "Книжные памятники Архангельской области": итоги и перспективы Линейная функция
Линейная функция Финансирование инновационной деятельности. Финансовые инновации в современной России
Финансирование инновационной деятельности. Финансовые инновации в современной России Анализируем художественный текст
Анализируем художественный текст Правоохранительные органы РФ
Правоохранительные органы РФ Желтый блокнот. Что такое проект? Пять П проекта
Желтый блокнот. Что такое проект? Пять П проекта Одежда и украшения. Вторая половина XIX века
Одежда и украшения. Вторая половина XIX века Организаторское поведение
Организаторское поведение Боеприпасы. Взрыватели и трубки
Боеприпасы. Взрыватели и трубки Математика для малышей
Математика для малышей Условия жизни разных народов
Условия жизни разных народов КИСЕЛЕ КИШЕ
КИСЕЛЕ КИШЕ Calculate your visit
Calculate your visit Анатомия класса. Схожесть с др. языками
Анатомия класса. Схожесть с др. языками Электронное телевидение
Электронное телевидение Круговорот воды в природе
Круговорот воды в природе Страхи в младшем школьном возрасте
Страхи в младшем школьном возрасте Русская армия в 18 веке и её знаменитые полководцы
Русская армия в 18 веке и её знаменитые полководцы Управление информационными ресурсами
Управление информационными ресурсами Свойства площадей. Площадь прямоугольника. Площадь параллелограмма
Свойства площадей. Площадь прямоугольника. Площадь параллелограмма Контрперенос и принципы работы бессознательного
Контрперенос и принципы работы бессознательного Упрощенный рассказ о моде. Часть 1. Платья и под ними. Ампир
Упрощенный рассказ о моде. Часть 1. Платья и под ними. Ампир Пищеварительная система у позвоночных животных
Пищеварительная система у позвоночных животных Что такое космогрядка
Что такое космогрядка Символика калужской области
Символика калужской области Презентация на тему Строение и функции пищеварительной системы
Презентация на тему Строение и функции пищеварительной системы