Содержание
- 2. Электролитическая диссоциация – это процесс распада электролитов на ионы при их растворении в воде или расплавлении.
- 3. Слабый электролит – это вещество, частично диссоциирующее на ионы и плохо проводящее электрический ток. Сильный электролит
- 4. Реакция ионного обмена – это реакция между элетролитами в растворе. Катион – это положительно заряженный ион.
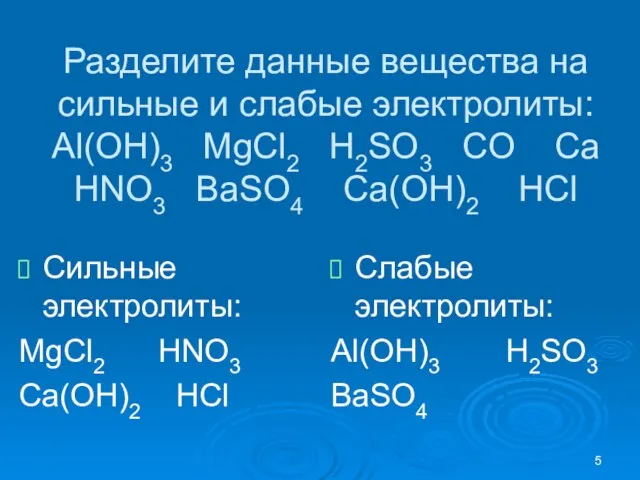
- 5. Разделите данные вещества на сильные и слабые электролиты: Al(OH)3 MgCl2 H2SO3 CO Ca HNO3 BaSO4 Ca(OH)2
- 6. Закончите молекулярные уравнения, составьте ионные: Zn(NO3)2 + HCl = NaOH + CaO = K2CO3 + H2SO4
- 7. Определите тип гидролиза солей, среду раствора: FeCl2 Ba(NO3)2 K2S
- 8. По сокращённым ионным уравнениям составьте полные ионные и молекулярные: Cu2+ + S2- = CuS H+ +
- 10. Скачать презентацию






 Что такое симметрия
Что такое симметрия Обществознание - 2012
Обществознание - 2012 Национальная Ассоциация Предприятий Технического Обслуживания и Ремонта Автомототранспортных Средств
Национальная Ассоциация Предприятий Технического Обслуживания и Ремонта Автомототранспортных Средств ЭФФЕКТ КИРЛИАН
ЭФФЕКТ КИРЛИАН Бизнес-план проекта по запуску и выведению на рынок digital студии “H1. Digital”
Бизнес-план проекта по запуску и выведению на рынок digital студии “H1. Digital” Стандарты. Аксессуары на витринах и автомобилях шоурума. Фотоотчет
Стандарты. Аксессуары на витринах и автомобилях шоурума. Фотоотчет Условия транспортировки инкубационных яиц
Условия транспортировки инкубационных яиц ТЕМА: ОПТИМИЗАЦИЯ ЦЕНЫНА АВИАТОПЛИВОКАК ФАКТОР ВЫЖИВАНИЯАВИАЦИОННОГО БИЗНЕСАВ УСЛОВИЯХ КРИЗИСА
ТЕМА: ОПТИМИЗАЦИЯ ЦЕНЫНА АВИАТОПЛИВОКАК ФАКТОР ВЫЖИВАНИЯАВИАЦИОННОГО БИЗНЕСАВ УСЛОВИЯХ КРИЗИСА Элективный курс. 9 класс. Разговор о правильном питании
Элективный курс. 9 класс. Разговор о правильном питании Обучение детей плаванию от 3 до 5 лет
Обучение детей плаванию от 3 до 5 лет Решение неравенств с одним неизвестным
Решение неравенств с одним неизвестным Новогодние окна (1)
Новогодние окна (1) Детская общественная организация «Республика Пионерия» - Добровольная, самостоятельная, самодеятельная, общественная организаци
Детская общественная организация «Республика Пионерия» - Добровольная, самостоятельная, самодеятельная, общественная организаци урок 2. Особенности астрономии и её методов
урок 2. Особенности астрономии и её методов Оружие нашей армии и противника в начале Великой Отечественной войны.
Оружие нашей армии и противника в начале Великой Отечественной войны. Педсовет
Педсовет Решение логических задач из курса кибернетики
Решение логических задач из курса кибернетики Живопись. Постановка и этюд натюрморта
Живопись. Постановка и этюд натюрморта Наводнения
Наводнения Вечер, посвященный жизни и творчеству В.С. Высоцкого
Вечер, посвященный жизни и творчеству В.С. Высоцкого Структура целей организации
Структура целей организации Проблема поиска корней многочленов
Проблема поиска корней многочленов Наш край (4 класс)
Наш край (4 класс) Политические партии и движения
Политические партии и движения Достижения арабской культуры
Достижения арабской культуры Презентация на тему Одаренные дети
Презентация на тему Одаренные дети  Линии чертежа
Линии чертежа Без прошлого нет будущего
Без прошлого нет будущего