Содержание
- 2. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ, ПРОТЕКАЮЩИЕ НА ЭЛЕКТРОДАХ ПРИ ПРОПУСКАНИИ ПОСТОЯННОГО ЭЛЕКТРИЧЕСКОГО ТОКА ЧЕРЕЗ РАСТВОРЫ ИЛИ РАСПЛАВЫ ЭЛЕКТРОЛИТОВ, НАЗЫВАЮТ
- 3. Катодные процессы в водных растворах электролитов :катионы или молекулы воды принимают электронов и восстанавливаются. Li,K,Ca, |
- 4. Cu2+ + 2e– = Cu0, E0=0,337 В 2H2O + 2e– = H2 + 2OH–, E0=–0,83 В
- 5. 2. Катионы металлов с малой величиной стандартного электродного потенциала (катионы металлов начала ряда напряжений Li+, Na+,
- 6. 3. Катионы металлов со стандартным электродным потенциалом меньшим, чем у ВОДОРОДА, но большим, чем у алюминия
- 7. 4. На катоде легче всего разряжаются катионы того металла, которому отвечает наиболее положительный потенциал. Так, например,
- 8. На аноде происходит окисление анионов или молекул воды ( частицы отдают электронов - окисляются) Анионы по
- 9. НА АНОДЕ ОКИСЛЯЮТСЯ АНИОНЫ БЕСКИСЛОРОДНЫХ КИСЛОТ, OH– ИЛИ МОЛЕКУЛЫ ВОДЫ 2Cl– – 2e– = Cl2 2H2O
- 10. При электролизе водного раствора соли из активного металла и кислородосодержащей кислоты на катоде выделяется Н2, а
- 11. При электролизе раствора соли из активного металла и бескислородной кислоты на катоде образуется - Н2, на
- 12. При электролизе водного раствора соли из малоактивного металла и кислородосодержащей кислоты на катоде выделяется металл, а
- 13. При электролизе катиона аммония NH4+ восстанавливается вода. При электролизе солей органических кислот на катоде восстанавливается вода,
- 14. Электролиз раствора щелочи – это электролиз воды. Электролиз раствора кислородосодержащей кислоты – это тоже электролиз воды.
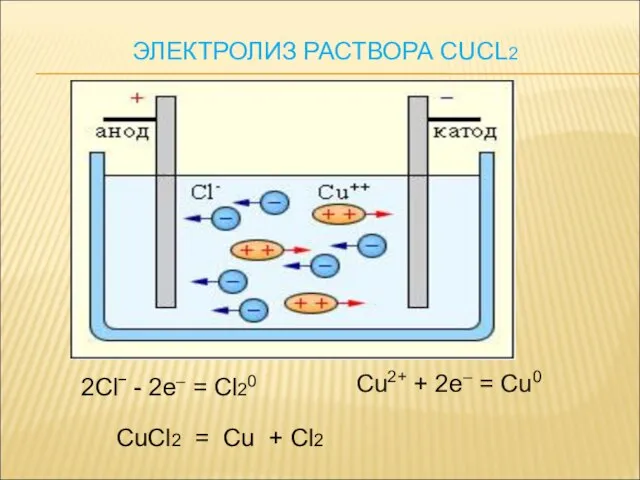
- 15. ЭЛЕКТРОЛИЗ РАСТВОРА NACL
- 16. 2Clˉ - 2e– = Cl20 Cu2+ + 2e– = Cu0 CuCl2 = Cu + Cl2 ЭЛЕКТРОЛИЗ
- 18. Скачать презентацию














 Витамин D.
Витамин D. Мастер-класс
Мастер-класс Дигибридное скрещивание. Третий закон Менделя.
Дигибридное скрещивание. Третий закон Менделя. Программный продукт«Элайн: Управление долевым строительством»
Программный продукт«Элайн: Управление долевым строительством» Леонардо Да Винчи 1452-1519
Леонардо Да Винчи 1452-1519 Учет расчетов организации с бюджетом ООО Фармакон
Учет расчетов организации с бюджетом ООО Фармакон Судебная власть и принципы правосудия
Судебная власть и принципы правосудия Классицизм в литературе
Классицизм в литературе Поверхность нашего
Поверхность нашего Проект СТРИТ- арт. Дыхание улиц
Проект СТРИТ- арт. Дыхание улиц How to communicate well
How to communicate well  Презентация на тему Периметр прямоугольника
Презентация на тему Периметр прямоугольника  http://www.pgmu.ako.kirov.ru/
http://www.pgmu.ako.kirov.ru/ Факультет экономики и права. Магистерские программы Правоведение и правоохранительная деятельность; Юридическая психология
Факультет экономики и права. Магистерские программы Правоведение и правоохранительная деятельность; Юридическая психология ООО «Пресса» В рамках реализации ежегодного форума «Региональные аспекты модернизации: новые люди — новые возможности представл
ООО «Пресса» В рамках реализации ежегодного форума «Региональные аспекты модернизации: новые люди — новые возможности представл Колонны Египта
Колонны Египта Взаимосвязь физического и духовного развития личности
Взаимосвязь физического и духовного развития личности О внешнеэкономической деятельности в сфере модернизации российской экономики
О внешнеэкономической деятельности в сфере модернизации российской экономики Презентация на тему Почвенная среда обитания
Презентация на тему Почвенная среда обитания  Наша каша Автор. Бобель Дарья, ученица 4 «А» класса Войтенко Полина, ученица 4 «А» класса Морина Александра, ученица 4 «А» класса Б
Наша каша Автор. Бобель Дарья, ученица 4 «А» класса Войтенко Полина, ученица 4 «А» класса Морина Александра, ученица 4 «А» класса Б Стратегия яс Алмагул
Стратегия яс Алмагул Психолого-педагогическая характеристика детей с нарушениями опорнодвигательного аппарата (НОДА)
Психолого-педагогическая характеристика детей с нарушениями опорнодвигательного аппарата (НОДА) Компания Prouvé
Компания Prouvé ЗАКОН ФИНЛЯНДИИ «О КООПЕРАТИВАХ» - ОСНОВНЫЕ ПОЛОЖЕНИЯ
ЗАКОН ФИНЛЯНДИИ «О КООПЕРАТИВАХ» - ОСНОВНЫЕ ПОЛОЖЕНИЯ Презентация характеристика объекта и основные решения (2)
Презентация характеристика объекта и основные решения (2) Мировоззрение, его виды и формы
Мировоззрение, его виды и формы Звукозаписывающая студия «Old Top»
Звукозаписывающая студия «Old Top» Школа юного журналиста
Школа юного журналиста