Слайд 2Цели урока
изучить способы получения,
химические свойства
применение алкенов
на примере непредельного

углеводорода - этилена
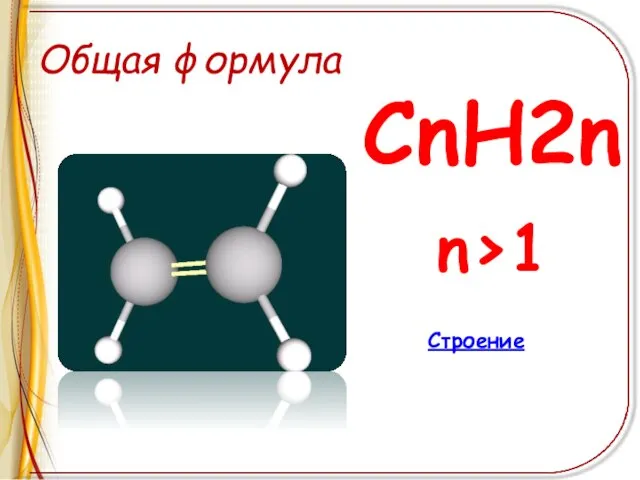
Слайд 3Общая формула
СnH2n
n>1
Строение
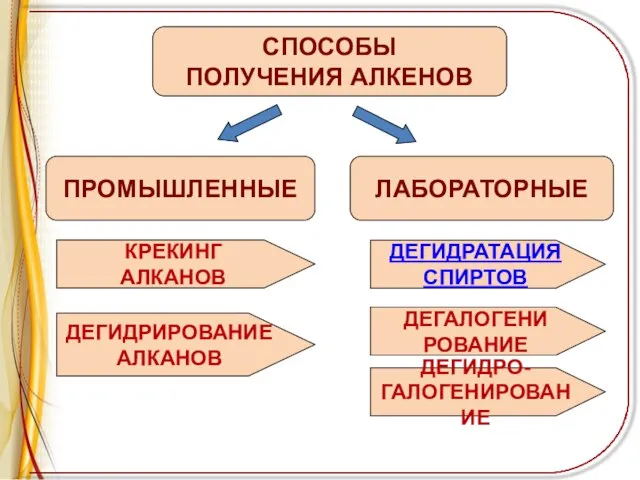
Слайд 5ПРОМЫШЛЕННЫЕ
СПОСОБЫ
ПОЛУЧЕНИЯ АЛКЕНОВ
ЛАБОРАТОРНЫЕ
КРЕКИНГ
АЛКАНОВ
ДЕГИДРИРОВАНИЕ
АЛКАНОВ
ДЕГИДРАТАЦИЯ
СПИРТОВ
ДЕГАЛОГЕНИ
РОВАНИЕ
ДЕГИДРО-
ГАЛОГЕНИРОВАНИЕ
Слайд 6ЛАБОРАТОРНЫЙ
СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРАТАЦИЯ СПИРТОВ
СПИРТ → АЛКЕН + ВОДА
ПРИМЕР: t≥140C,
Н Н Н2SO4(конц.)
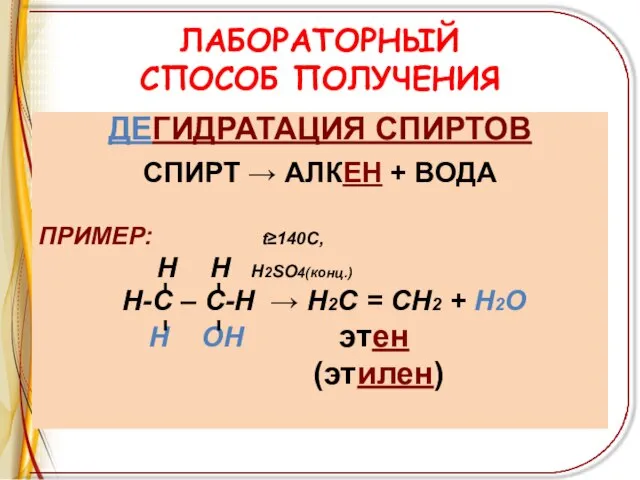
Н-С – С-Н → Н2С = СН2 + Н2О
Н ОН этен
(этилен)
Слайд 7Получение алкенов
КРЕКИНГ АЛКАНОВ
АЛКАН → АЛКАН + АЛКЕН
С БОЛЕЕ ДЛИННОЙ С МЕНЕЕ

ДЛИННОЙ
УГЛЕРОДНОЙ УГЛЕРОДНОЙ
ЦЕПЬЮ ЦЕПЬЮ
ПРИМЕР:
t=400-700C
С 10 Н 22→ С5Н 12+ С5Н10
декан пентан пентен
Слайд 8ПРОМЫШЛЕННЫЙ
СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРИРОВАНИЕ АЛКАНОВ
АЛКАН → АЛКЕН + ВОДОРОД
ПРИМЕР:
Ni, t=500C
Н3С
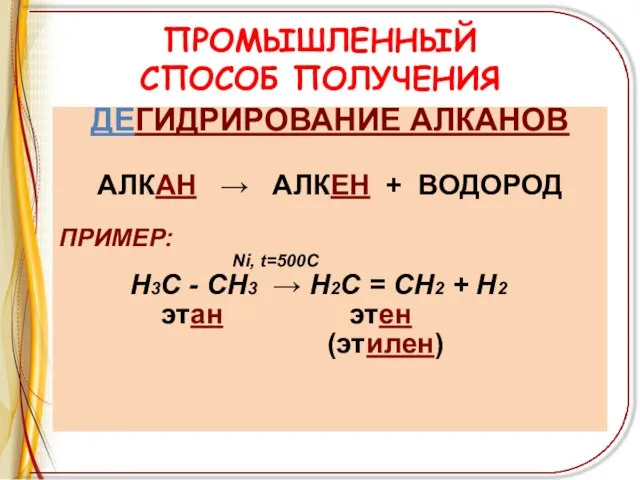
- СН3 → Н2С = СН2 + Н2
этан этен
(этилен)
Слайд 9ЛАБОРАТОРНЫЙ
СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРОГАЛОГЕНИРОВАНИЕ
УДАЛИТЬ ВОДОРОД ГАЛОГЕН ДЕЙСТВИЕ
ПРИМЕР:
спиртовой
H H раствор
Н-С–С-Н+KOH→Н2С=СН2+KCl+H2O
Н Cl
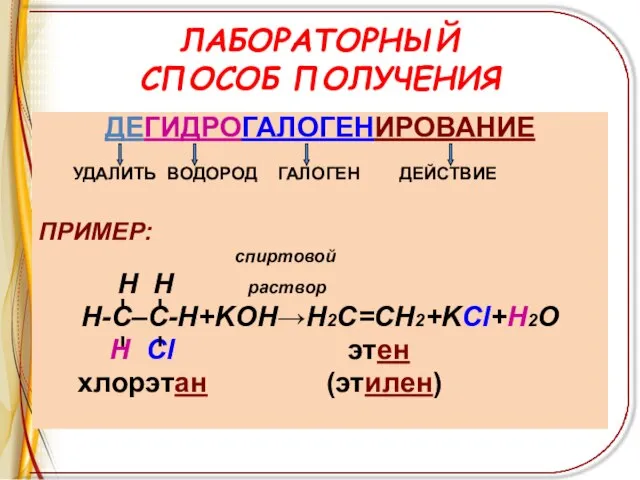
этен
хлорэтан (этилен)
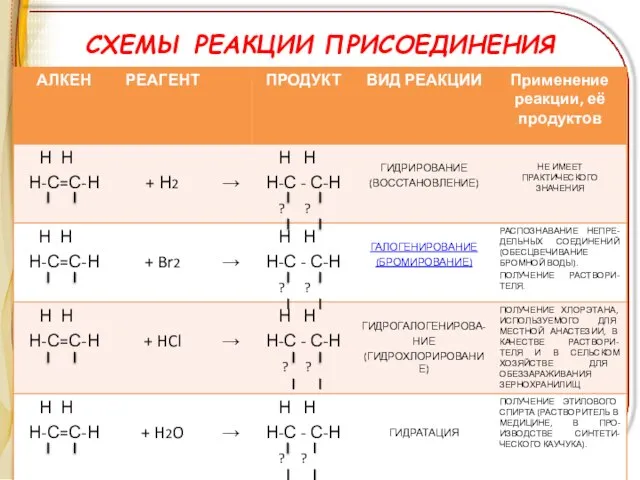
Слайд 10РЕАКЦИИ ОКИСЛЕНИЯ
ГОРЕНИЕ АЛКЕНОВ
ПРИМЕР:
С2Н4 + 3О2 2СО2 + 2Н2О

Слайд 11РЕАКЦИИ ОКИСЛЕНИЯ
МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНГАНАТА КАЛИЯ
(реакция Е.Е.Вагнера)
Н2С=СН2

+ [O] + H2O H2C - CH2
OH OH
этиленгликоль
(этандиол-1,2)
! Качественная реакция на непредельность углеводорода – на кратную связь
Слайд 13РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ
Это процесс соединения одинаковых молекул в более крупные.
ПРИМЕР: n CH2=CH2 (-CH2-CH2-)n

этилен полиэтилен
(мономер) (полимер)
n – степень полимеризации, показывает число молекул, вступивших в реакцию
-CH2-CH2- структурное звено










 Вегетативный код в лирике Б.Л. Пастернака
Вегетативный код в лирике Б.Л. Пастернака Отклоняющееся поведение и его типы
Отклоняющееся поведение и его типы Окружающий мир1 классПрограмма «Школа 2100»
Окружающий мир1 классПрограмма «Школа 2100» СЕССИЯ 11
СЕССИЯ 11 Равновесие химической реакции
Равновесие химической реакции Первое знакомство с иммунитетом
Первое знакомство с иммунитетом Презентация на тему О насвае
Презентация на тему О насвае ПРИВЛЕКАТЕЛЬНАЯ УПАКОВКА ДЛЯ ВАШЕГО ПРОДУКТА
ПРИВЛЕКАТЕЛЬНАЯ УПАКОВКА ДЛЯ ВАШЕГО ПРОДУКТА Дневник нерожденного ребенка
Дневник нерожденного ребенка Анализ состояния и перспективы развития педагогического коллектива МОУ №110 за 2009-2010 учебный год
Анализ состояния и перспективы развития педагогического коллектива МОУ №110 за 2009-2010 учебный год Презентация на тему Былины
Презентация на тему Былины Административное право
Административное право Мастер-класс Изготовление и роспись объемных картин из холодного фарфора
Мастер-класс Изготовление и роспись объемных картин из холодного фарфора Риски новых правил функционирования розничных рынков
Риски новых правил функционирования розничных рынков Презентация на тему Съедобное и несъедобное
Презентация на тему Съедобное и несъедобное Положение государственной (итоговой) аттестации выпускников IX классов
Положение государственной (итоговой) аттестации выпускников IX классов Типология стран мира. Формы правления и государственного устройства
Типология стран мира. Формы правления и государственного устройства «О реализации в Челябинской области антикризисных мер»
«О реализации в Челябинской области антикризисных мер» МОУ СОШ №10
МОУ СОШ №10 Сухое мытье волос
Сухое мытье волос Дорожная азбука
Дорожная азбука Постановка тире между подлежащим и сказуемым
Постановка тире между подлежащим и сказуемым Материнские платы
Материнские платы c ly`v hj;ltybz
c ly`v hj;ltybz Презентацияна тему:«Хронический гепатит»Специльность 060101 «Лечебное дело»Дисциплина «Терапия» 4 курс 7 семестр
Презентацияна тему:«Хронический гепатит»Специльность 060101 «Лечебное дело»Дисциплина «Терапия» 4 курс 7 семестр Химия и окружающая среда
Химия и окружающая среда Первые уроки школьной отметки
Первые уроки школьной отметки Требования к проекту по маркетингу
Требования к проекту по маркетингу