Содержание
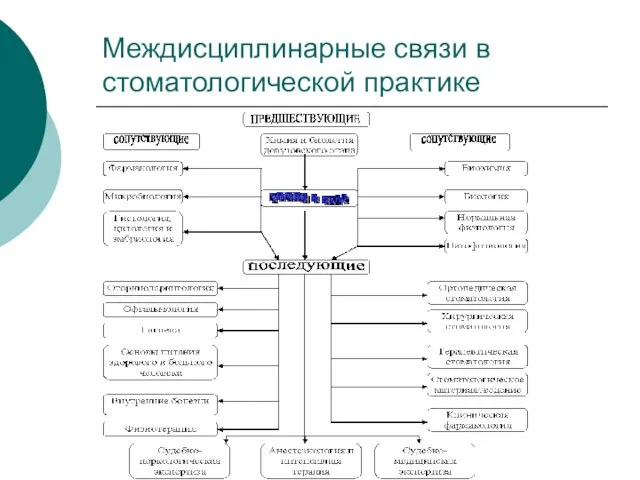
- 2. Междисциплинарные связи в стоматологической практике
- 3. РЕКОМЕНДУЕМАЯ литература: Основная литература Попков, В.А. Общая и биоорганическая химия /В.А.Попков, А.С. Берлянд.– М.: Издательский центр
- 4. Химия и медицина Химия – это фундаментальная наука, занимающая важное место в медицине, т.к. трактовать какие-либо
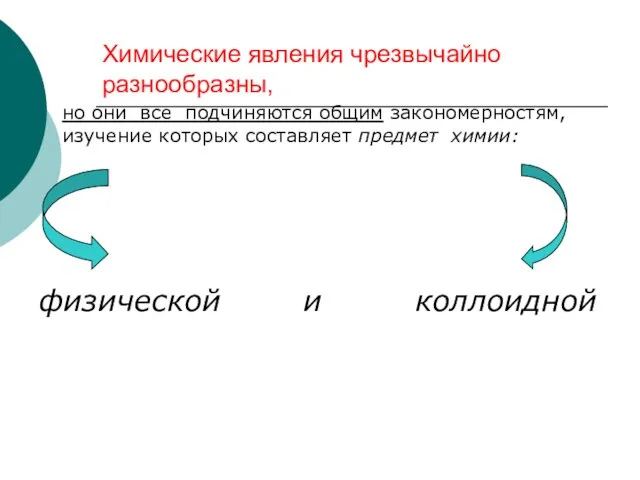
- 5. Химические явления чрезвычайно разнообразны, но они все подчиняются общим закономерностям, изучение которых составляет предмет химии: физической
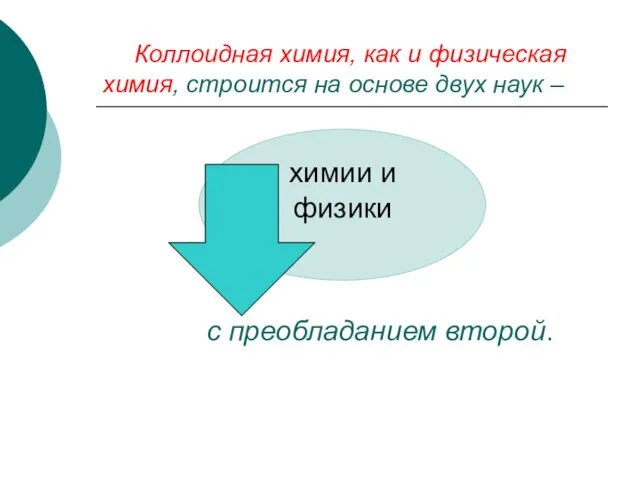
- 6. Коллоидная химия, как и физическая химия, строится на основе двух наук – с преобладанием второй.
- 7. Физическая химия изучает взаимосвязь химических процессов и физических явлений, которые их сопровождают, устанавливает закономерности между химическим
- 8. Коллоидная химия – это наука, изучающая свойства гетерогенных высокодисперсных (сильно раздробленных) систем и протекающих в них
- 9. Основные задачи дисциплины Изучение основных разделов физической химии для более глубокого понимания не только теоретических основ
- 10. 3. Изучение механизмов образования основного неорганического вещества костной ткани и зубной эмали, кислотно-основные свойства биожидкостей организма.
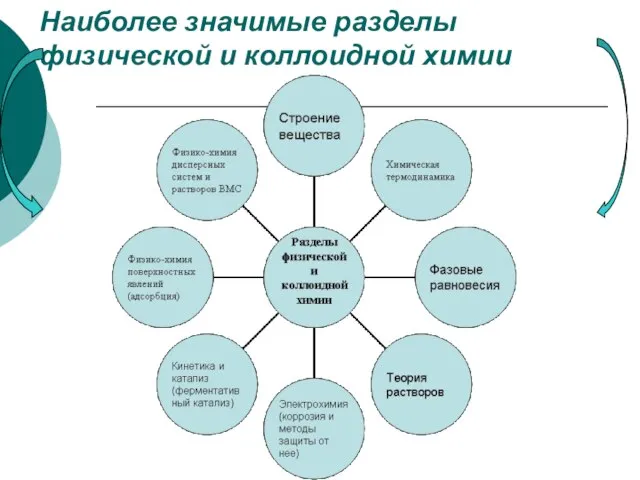
- 11. Наиболее значимые разделы физической и коллоидной химии
- 12. ТЕРМОДИНАМИЧЕСКИЕ ХАРАКТЕРИСТИКИ ХИМИЧЕСКИХ И БИОХИМИЧЕСКИХ ПРОЦЕССОВ Термодинамика – это наука, изучающая законы энергетических превращений, сопровождающих физические,
- 13. Системой называется
- 14. Классификация систем В зависимости от способности системы к обмену энергией и веществом с окружающей средой различают:
- 15. Термодинамические параметры и функции Изменение свойств системы определяется 1) термодинамическими параметрами (давлением, концентрацией, температурой, объемом и
- 16. Например, состояние идеального газа определяется двумя параметрами из трех (р, V, T). Характеристические функции состояния зависят
- 17. Состояние системы Состояние системы– это совокупность параметров, характеризующих систему в данный момент времени. Особого внимания заслуживают
- 18. Последнее характерно для живых систем, а равновесное – для него смерть. При переходе системы из одного
- 19. Внутренняя энергия (U, Дж/моль). Теплота (Q, Дж/моль∙К) и работа (Дж или кДж) Энергетический эффект химической реакции
- 20. Известны 2 формы передачи энергии от одной системы к другой. Упорядоченную (т.е. организованную) форму передачи энергии
- 21. ☞ Обычно в ходе химической реакции теплота
- 22. В любом процессе соблюдается закон сохранения энергии (I закон термодинамики)– запас внутренней энергии изолированной системы остается
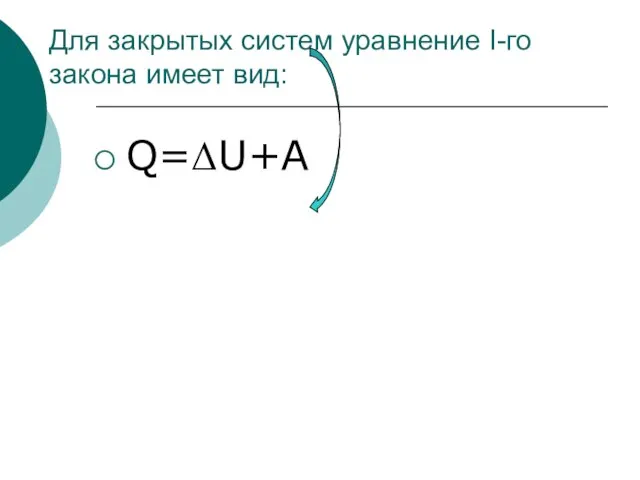
- 23. Для закрытых систем уравнение I-го закона имеет вид: Q=ΔU+A
- 24. Выражения I-го закона термодинамики для изохорного и изобарного процессов Процесс– это переход системы из одного состояния
- 25. В изохорном процессе (V = const) поглощенная системой теплота идет полностью на увеличение запаса внутренней энергии,
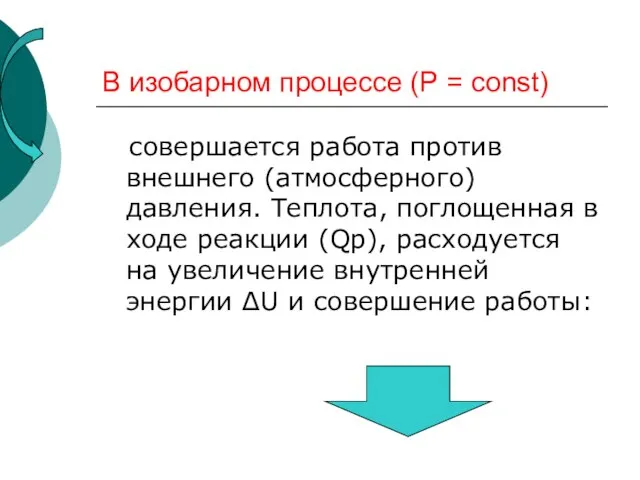
- 26. В изобарном процессе (Р = const) совершается работа против внешнего (атмосферного) давления. Теплота, поглощенная в ходе
- 27. Или Раскроем скобки и сгруппируем члены с одинаковыми индексами:
- 28. Примечание Жизнедеятельность человека протекает при постоянстве температуры и давления, т. е. при изобарно-изотермических условиях (р, Т
- 29. Энтальпия. Тепловые эффекты. Стандартное состояние. Сумму U + PV называют энтальпией системы и обозначают буквой Н.
- 30. Следовательно, Qp = Н2 – Н1 =ΔН, т. е. теплота, поглощенная системой при постоянном давлении, расходуется
- 31. Таким образом, в изохорном процессе тепловой эффект реакции равен изменению внутренней энергии системы, а в изобарном
- 32. Для того чтобы можно было сравнивать тепловые эффекты различных процессов, расчеты обычно относят к 1 молю
- 33. Термохимические уравнения. Закон Гесса В термохимических расчетах используют термохимические уравнения. В них указывают тепловой эффект реакции
- 34. Термохимические расчеты проводят, используя стандартные энтальпии (теплоты) образования веществ. Стандартная энтальпия образования ΔН°обр. - это тепловой
- 35. В основе термохимических расчетов лежит закон Г. И. Гесса (1840): тепловой эффект реакции не зависит от
- 36. 1) тепловой эффект реакции равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования
- 37. Реакцию, идущую без воздействия внешних факторов, называют самопроизвольной. Направление, в котором самопроизвольно протекает химическая реакция, определяется
- 38. Мерой первой из этих тенденций для изобарных процессов служит уменьшение энтальпии системы (ΔН Еще в прошлом
- 39. Следовательно, уменьшение энтальпии — не единственный фактор, определяющий возможность протекания реакции. Все приведенные выше самопроизвольные процессы
- 40. ЭНТРОПИЯ Степень беспорядка, или неупорядоченности, в системе характеризуется функцией состояния системы, называемой энтропией. Энтропия является мерой
- 41. где k = R/NA = 1,38 • 10- 23 Дж/К; W - термодинамическая вероятность состояния системы,
- 42. Энтропия имеет размерность энергии, деленной на температуру, обычно ее относят к 1 молю вещества (мольная энтропия)
- 43. В изолированной системе самопроизвольно протекают только те процессы, которые сопровождаются увеличением энтропии — это одна из
- 44. Энтропия возрастает при плавлении, растворении, кипении, диссоциации молекул и т. п. Процессы, в результате которых упорядоченность
- 45. Рассчитывают изменение стандартной энтропии по уравнению Оба фактора - изменения энтальпии и энтропии - объединены в
- 46. Энергию Гиббса образования относят к 1 молю вещества и обычно выражают в кДж/моль; при этом ΔG0
- 47. Все самопроизвольные физические и химические превращения идут в направлении уменьшения энергии Гиббса. Они могут сопровождаться увеличением
- 48. Для нахождения изменения стандартной энергии Гиббса в реакции должны быть известны изменения стандартных энтальпии и энтропии,
- 50. Скачать презентацию









































 Испания.
Испания. Стена плача в Иерусалиме
Стена плача в Иерусалиме Объемы многогранников
Объемы многогранников Перспективні напрямки інтернет-проектів в Україні
Перспективні напрямки інтернет-проектів в Україні Помада Creamy Glam
Помада Creamy Glam Наш школьный дворик
Наш школьный дворик И как в рай, в Божий храм Запросилась душа
И как в рай, в Божий храм Запросилась душа Анализ проверки остроты зрения школьников
Анализ проверки остроты зрения школьников Семинар-тренинг. Регламентные операций по закрытию месяца. Внутреннее устройство и особенности применения
Семинар-тренинг. Регламентные операций по закрытию месяца. Внутреннее устройство и особенности применения Политическая партия в политической системе
Политическая партия в политической системе Управление временем
Управление временем Основы православной культуры. Храм
Основы православной культуры. Храм Движение заряженных частиц в магнитном поле
Движение заряженных частиц в магнитном поле Основные классы документов. Критерии отбора документов.
Основные классы документов. Критерии отбора документов. День профессии
День профессии Итоги государственного регулирования тарифов (цен) на территории Санкт-Петербурга на 2012 год
Итоги государственного регулирования тарифов (цен) на территории Санкт-Петербурга на 2012 год Осенний лес, ИЗО, 2 класс
Осенний лес, ИЗО, 2 класс 08
08 Презентация на тему Афины - самый прекрасный город Древней Греции
Презентация на тему Афины - самый прекрасный город Древней Греции Конституция России - путь к правовому государству
Конституция России - путь к правовому государству Языковой центр Speak Up
Языковой центр Speak Up Тест по теме «В гости к весне»
Тест по теме «В гости к весне» Формирование звукослогового анализа и синтеза у детей с ЗПР при обучении чтению и письму
Формирование звукослогового анализа и синтеза у детей с ЗПР при обучении чтению и письму Дискуссионные вопросы состава и структуры финансовой системы РФ
Дискуссионные вопросы состава и структуры финансовой системы РФ Во имя России, на благо Кубани
Во имя России, на благо Кубани Рейтинговая накопительная система (РНС): реализация воспитательного потенциала
Рейтинговая накопительная система (РНС): реализация воспитательного потенциала Сочи2014 (картинки)
Сочи2014 (картинки) Виртуальная психологическая студия по формированию и развитию личностных особенностей студентов
Виртуальная психологическая студия по формированию и развитию личностных особенностей студентов