Содержание
- 2. Пример: 2Cu0 + O2 =2 Cu2+O2- 2H+CL- + Zn0 = Zn2+CL2- + H20 Реакции, протекающие с
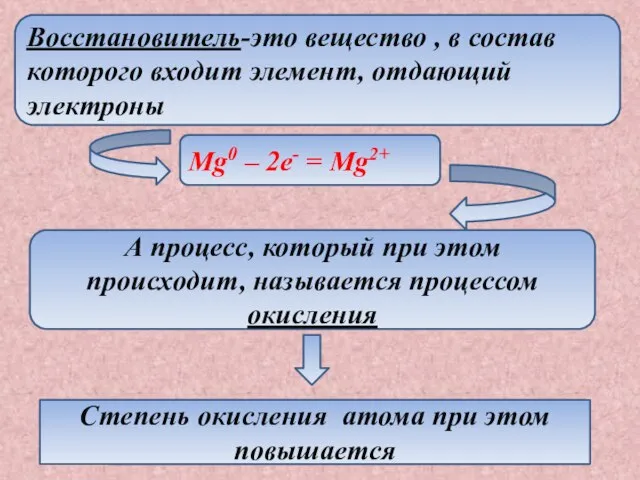
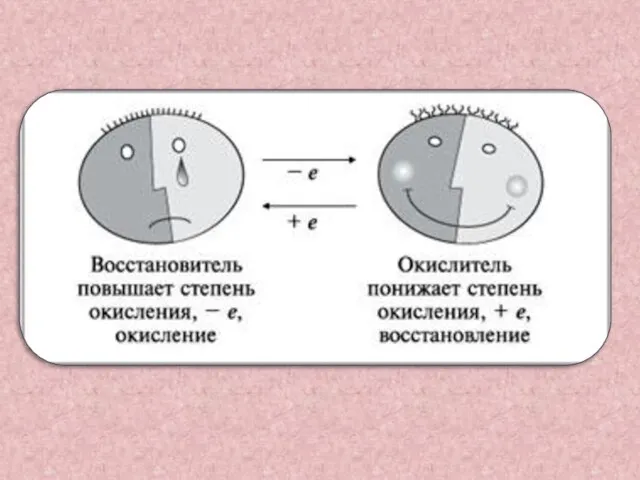
- 3. Восстановитель-это вещество , в состав которого входит элемент, отдающий электроны Mg0 – 2e- = Mg2+ А
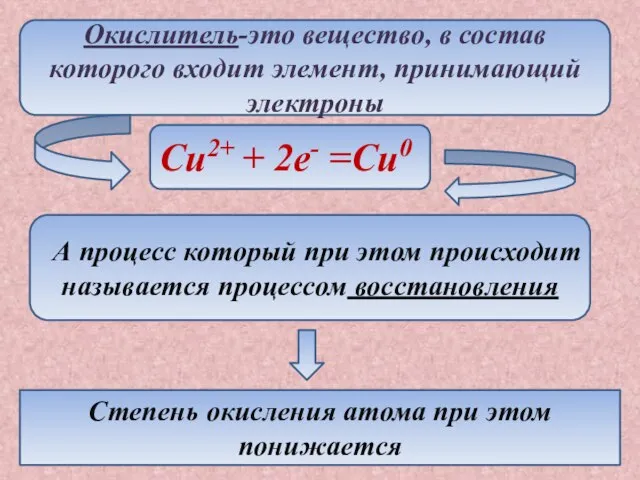
- 4. Окислитель-это вещество, в состав которого входит элемент, принимающий электроны Cu2+ + 2e- =Cu0 А процесс который
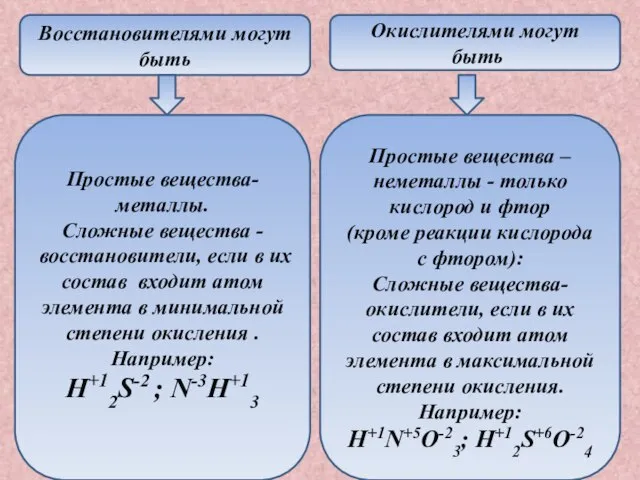
- 6. Восстановителями могут быть Окислителями могут быть Простые вещества-металлы. Сложные вещества - восстановители, если в их состав
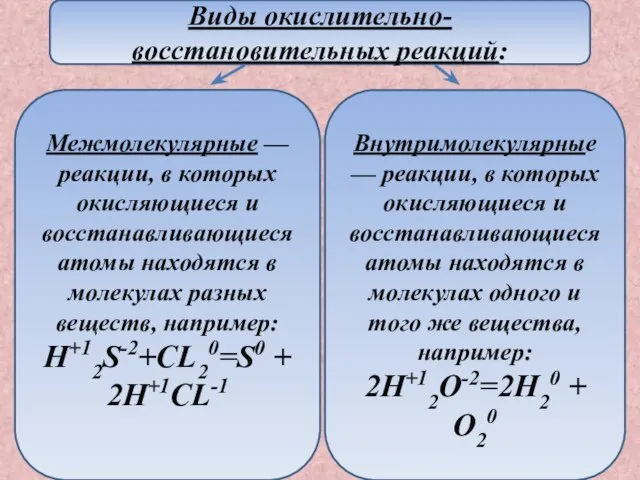
- 7. Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например: H+12S-2+CL20=S0
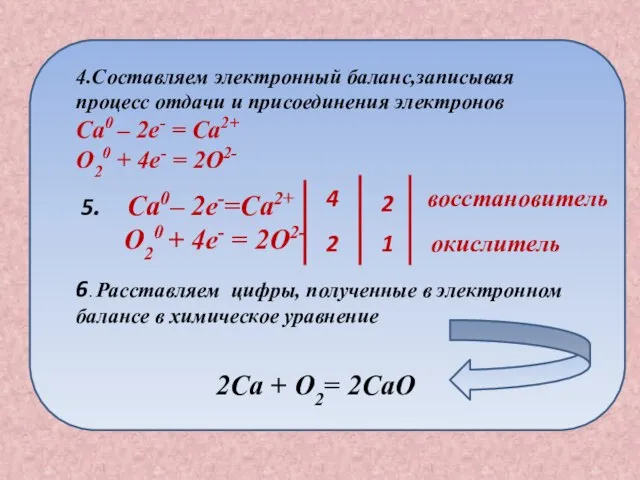
- 8. План составления окислительно -восстановительной реакции Записываем схему химической реакции Ca + O2 2. Расставляем степени окисления
- 9. 5. Ca0– 2e-=Ca2+ O20 + 4e- = 2O2- 4 2 2 1 восстановитель окислитель 6. Расставляем
- 10. Используя метод электронного баланса, допишите схемы и составьте уравнения, расставив коэффициенты Mg + O2 HCL +
- 12. Скачать презентацию



 «Мастер и Маргарита»В. Лакшин отмечал, что, «выбирая посмертную судьбу Мастеру, Булгаков выбирал судьбу себе». Это его изм
«Мастер и Маргарита»В. Лакшин отмечал, что, «выбирая посмертную судьбу Мастеру, Булгаков выбирал судьбу себе». Это его изм Я выбираю здоровый образ жизни
Я выбираю здоровый образ жизни Информация вокруг нас
Информация вокруг нас Взаимное расположение графиков линейных функций
Взаимное расположение графиков линейных функций Все люди любят праздники
Все люди любят праздники Wether
Wether Тема: «Тайны древних пирамид» Маркова Марина Валерьевна 2009 – 2010 учебный год
Тема: «Тайны древних пирамид» Маркова Марина Валерьевна 2009 – 2010 учебный год Прохождение производственной практики в Департаменте образования и науки Брянской области
Прохождение производственной практики в Департаменте образования и науки Брянской области Нейропсихологический аспект в речевой и познавательной деятельности
Нейропсихологический аспект в речевой и познавательной деятельности Русский Иерусалим Патриарха Никона
Русский Иерусалим Патриарха Никона Путешествие в Древнюю Индию
Путешествие в Древнюю Индию Как правильно презентовать стартап
Как правильно презентовать стартап Организация финансирования инвестиционной деятельности
Организация финансирования инвестиционной деятельности Книги про Новый год и Рождество
Книги про Новый год и Рождество Деловая игра Слалом
Деловая игра Слалом Различные способы решения квадратных уравнений
Различные способы решения квадратных уравнений Текст и его признаки
Текст и его признаки Управление проектамиЛекция 2.Структурное планирование
Управление проектамиЛекция 2.Структурное планирование Буклет ВМПИ
Буклет ВМПИ Команда Приморские Медведи
Команда Приморские Медведи Число-буквенный код. Техника запоминания картин
Число-буквенный код. Техника запоминания картин Кухар-кондитер
Кухар-кондитер  Система школьного мониторинга в управлении качеством образования
Система школьного мониторинга в управлении качеством образования Проект Evrikum. Стеклянный лабиринт
Проект Evrikum. Стеклянный лабиринт Реализация PR и IR стратегий: особенности национального информационного поля
Реализация PR и IR стратегий: особенности национального информационного поля КРИСТАЛЛИЧЕСКИЕ РЕШЕТКИ
КРИСТАЛЛИЧЕСКИЕ РЕШЕТКИ Правомерно ли Выделять категорию состояния, Как самостоятельную часть речи?
Правомерно ли Выделять категорию состояния, Как самостоятельную часть речи? Государственное учреждение образования Новосёлковский ясли – сад Пуховичского района
Государственное учреждение образования Новосёлковский ясли – сад Пуховичского района