Содержание
- 2. 8.8. Круговой процесс (цикл) Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд
- 3. Прямой цикл используется в тепловых двигателях — периодически действующих двигателях, совершающих работу за счет полученной извне
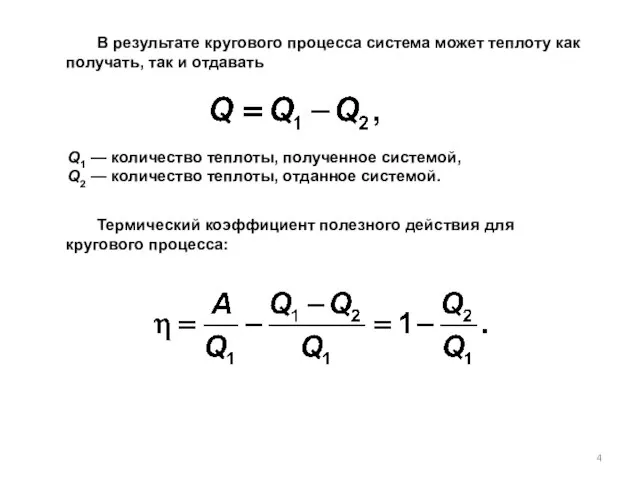
- 4. В результате кругового процесса система может теплоту как получать, так и отдавать Q1 — количество теплоты,
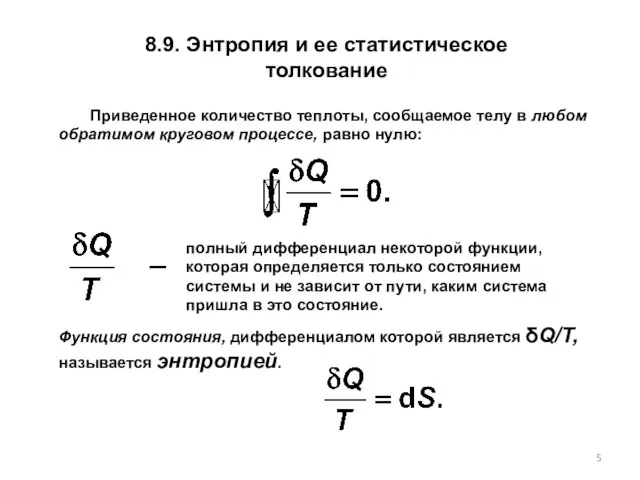
- 5. 8.9. Энтропия и ее статистическое толкование Приведенное количество теплоты, сообщаемое телу в любом обратимом круговом процессе,
- 6. Для обратимых процессов изменение энтропии: Для системы, которая обменивается теплотой с внешней средой, энтропия может быть:
- 7. Если система совершает равновесный переход из состояния 1 в состояние 2, то изменение ее энтропии:
- 8. или Замечания: Изменение энтропии ΔS1→2 идеального газа при переходе его из состояния 1 в состояние 2
- 9. Изменение энтропии при изотермическом процессе: Изменение энтропии при изохорном процессе: Следствия для приращения энтропии:
- 10. Термодинамическая вероятность состояния системы — это число микросостояний, определяющих данное макросостояние. Энтропия системы и термодинамическая вероятность
- 11. Статистическое толкование энтропии на основе формулы Больцмана: «энтропия является мерой неупорядоченности системы (мерой хаоса)». Другое определение
- 12. 8.10. Второе начало термодинамики Второе начало термодинамики определяет направление протекания термодинамических процессов. «В замкнутой системе при
- 13. В середине XIX в. возникла проблема так называемой тепловой смерти Вселенной. Рассматривая Вселенную как замкнутую систему
- 14. 8.11. Третье начало термодинамики Теорема Нернста — Планка: «энтропия всех тел в состоянии равновесия стремится к
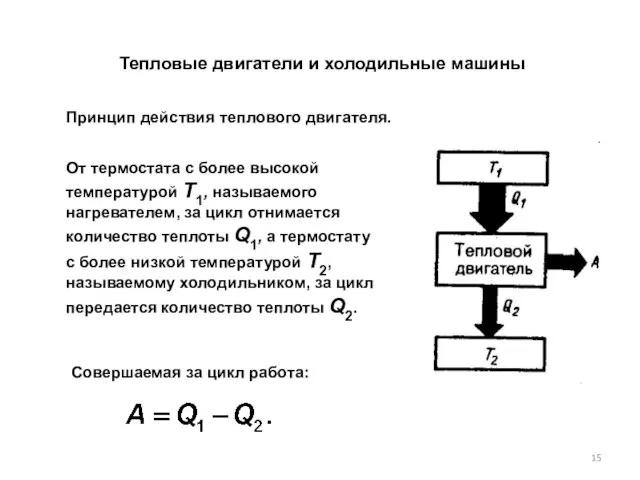
- 15. Тепловые двигатели и холодильные машины От термостата с более высокой температурой Т1, называемого нагревателем, за цикл
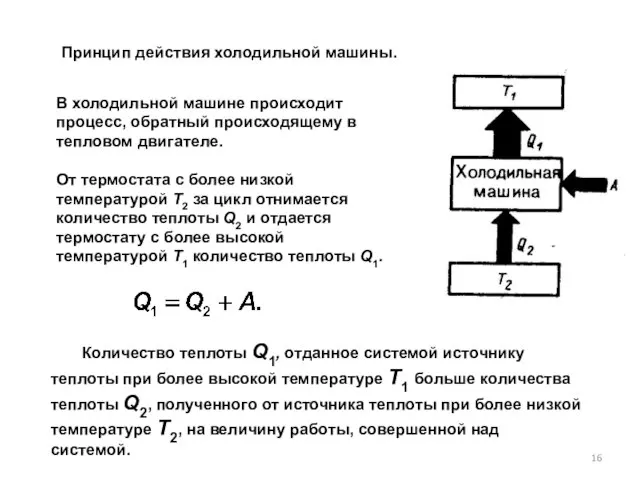
- 16. В холодильной машине происходит процесс, обратный происходящему в тепловом двигателе. От термостата с более низкой температурой
- 17. Теорема Карно: «из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей (T1) и холодильников (T2),
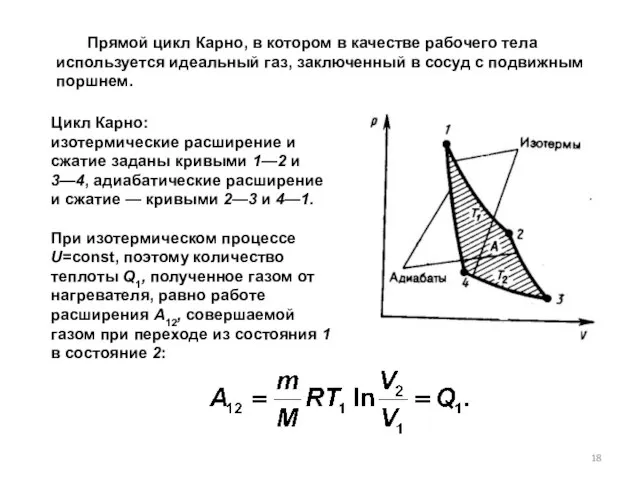
- 18. Цикл Карно: изотермические расширение и сжатие заданы кривыми 1—2 и 3—4, адиабатические расширение и сжатие —
- 19. При адиабатическом расширении 2—3 теплообмен с окружающей средой отсутствует и работа расширения А23 совершается за счет
- 21. Скачать презентацию













 Изучение строения растительной и животной клеток под микроскопом
Изучение строения растительной и животной клеток под микроскопом С праздником! С Международным женским днём!
С праздником! С Международным женским днём! МЕЖШКОЛЬНЫЙ УЧЕБНЫЙ КОМБИНАТ
МЕЖШКОЛЬНЫЙ УЧЕБНЫЙ КОМБИНАТ Третий путь продолжается
Третий путь продолжается Одноклеточные и многоклеточные организмы
Одноклеточные и многоклеточные организмы Формы и методы контроля
Формы и методы контроля Холодная война в карикатурах
Холодная война в карикатурах Отчет по работе столовой МОУ СОШ № 4г. Калининграда
Отчет по работе столовой МОУ СОШ № 4г. Калининграда Авиация. Первые летательные аппараты
Авиация. Первые летательные аппараты Профили обучения:«Государственное и муниципальное управление»,«Экономика»,«менеджмент»
Профили обучения:«Государственное и муниципальное управление»,«Экономика»,«менеджмент» Цветы клумбы
Цветы клумбы Учетная регистрация ломбардов
Учетная регистрация ломбардов Кроссворд по сказкамГанса Христиана Андерсена
Кроссворд по сказкамГанса Христиана Андерсена Оценка гражданских служащих - участников проектной деятельности
Оценка гражданских служащих - участников проектной деятельности "Прием платежей по картам Visa и MasterCard в Интернет и "на земле"
"Прием платежей по картам Visa и MasterCard в Интернет и "на земле" Прощание с ботаникой
Прощание с ботаникой ВИРУСЫ - НЕКЛЕТОЧНЫЕ ФОРМЫ ЖИЗНИ
ВИРУСЫ - НЕКЛЕТОЧНЫЕ ФОРМЫ ЖИЗНИ Мотивационные программы на 2021 год
Мотивационные программы на 2021 год ИСПОЛЬЗОВАНИЕ ЭНЕРГИИ ДВИЖУЩЕЙСЯ ВОДЫ И ВЕТРА
ИСПОЛЬЗОВАНИЕ ЭНЕРГИИ ДВИЖУЩЕЙСЯ ВОДЫ И ВЕТРА Касса ресторана
Касса ресторана Медицина катастроф (4)
Медицина катастроф (4) Сказки А.С. Пушкина
Сказки А.С. Пушкина Презентация на тему Памятные места города-героя Керчи
Презентация на тему Памятные места города-героя Керчи Презентация на тему Размножение и развитие растений
Презентация на тему Размножение и развитие растений  Фотоотчет Северо-Западного филиала Декабрь 2010г.
Фотоотчет Северо-Западного филиала Декабрь 2010г. Презентация на тему Стили речи презентация
Презентация на тему Стили речи презентация Презентация на тему: Понятие объема. Объем призмы
Презентация на тему: Понятие объема. Объем призмы Модель жизенного цикла организации Л. Грейнера
Модель жизенного цикла организации Л. Грейнера