Содержание
- 2. Альфред Вернер – первым попытался объяснить химическую связь в комплексных соединениях. 1893 г. – статья Вернера
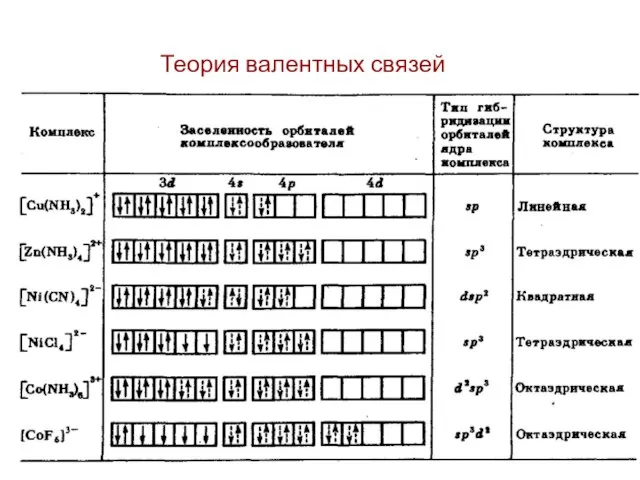
- 3. Теория валентных связей 1. Связь между комплексообразователем и лигандами является донорно-акцепторной. Лиганды предоставляют электронные пары, а
- 4. 2. Орбитали комплексообразователя подвергаются гибридизации. Тип гибридизации зависит от природы и электронной структурой центрального атома (Ц.А.).
- 5. 3. Магнитные свойства комплексного иона зависят от заселенности орбиталей комплексообразователя: а) При наличии неспаренных электронов комплекс
- 6. 4. Наиболее прочные связи образуются при использовании комплексообразователем своих d–орбиталей. Типичные комплексообразователи - элементы, у которых
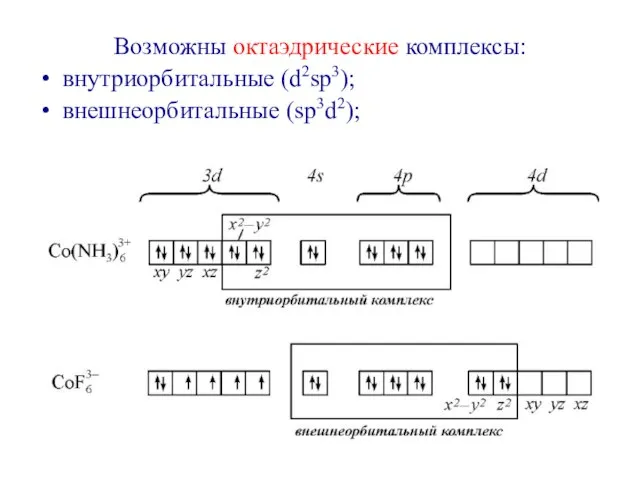
- 7. Возможны октаэдрические комплексы: внутриорбитальные (d2sp3); внешнеорбитальные (sp3d2);
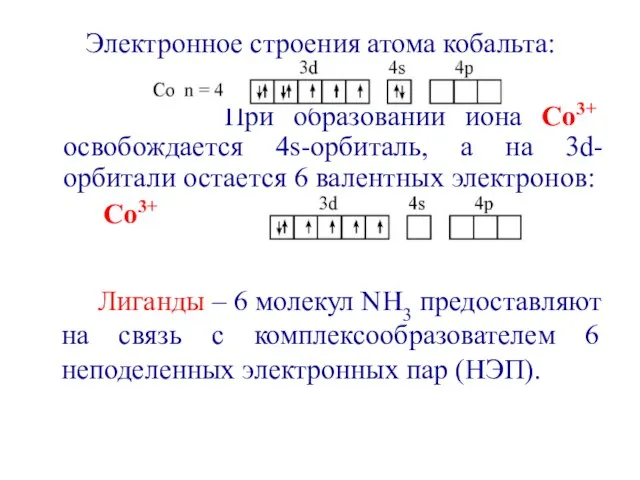
- 8. Электронное строения атома кобальта: При образовании иона Со3+ освобождается 4s-орбиталь, а на 3d-орбитали остается 6 валентных
- 9. 1. Лиганды, создающие сильное поле, могут влиять на комплексообразователь. Электроны Ц.А. могут спариваться и освобождать две
- 10. Все валентные электроны спарены. Комплекс [Co(NH3)6]3+ - диамагнитный, что согласуется с экспериментом.
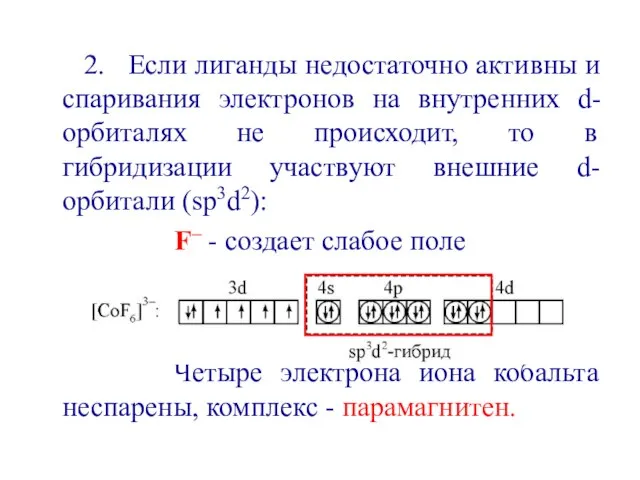
- 11. 2. Если лиганды недостаточно активны и спаривания электронов на внутренних d-орбиталях не происходит, то в гибридизации
- 12. 3. Если комплексообразователь при спаривании валентных электронов на внутренних d-орбиталях может освободить только одну квантовую ячейку,
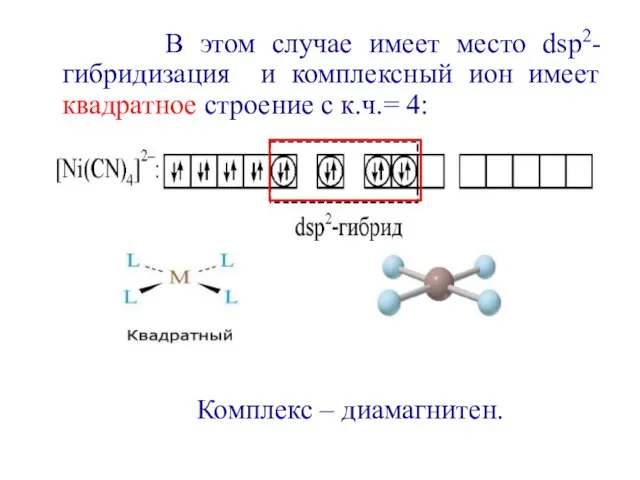
- 13. В этом случае имеет место dsp2-гибридизация и комплексный ион имеет квадратное строение с к.ч.= 4: Комплекс
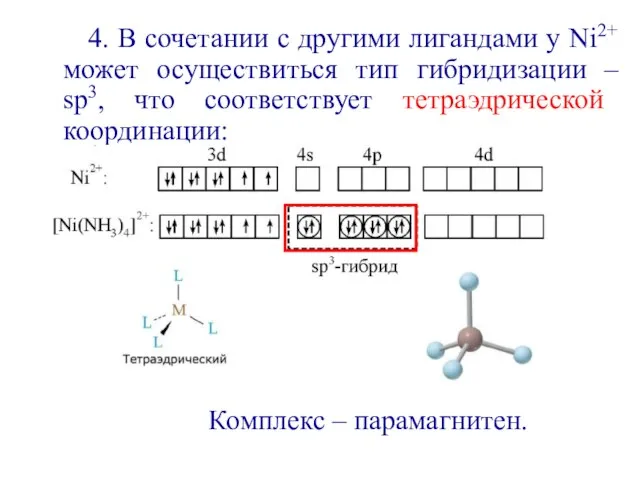
- 14. 4. В сочетании с другими лигандами у Ni2+ может осуществиться тип гибридизации – sp3, что соответствует
- 15. Теория валентных связей
- 16. Недостатки метода ВС: Не объясняет и не предсказывает оптические свойства (цветность). Не объясняет силу лигандов, т.е.
- 17. 2. Теория кристаллического поля Химическая связь между комплек-сообразователем и лигандами ионная или иондипольная. Лиганды считаются точечными
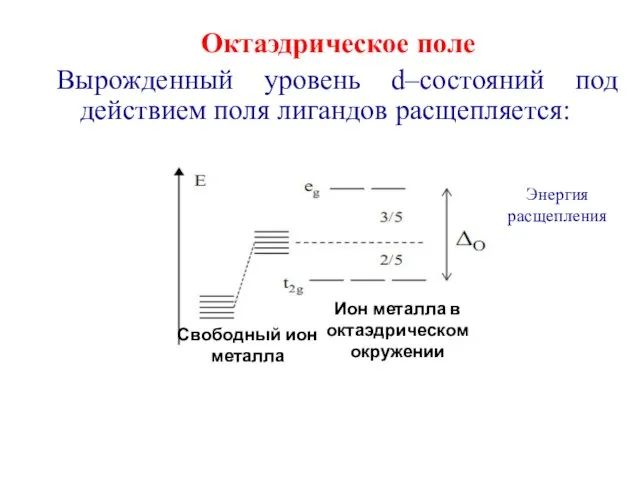
- 18. Октаэдрическое поле Вырожденный уровень d–состояний под действием поля лигандов расщепляется: Энергия расщепления Ион металла в октаэдрическом
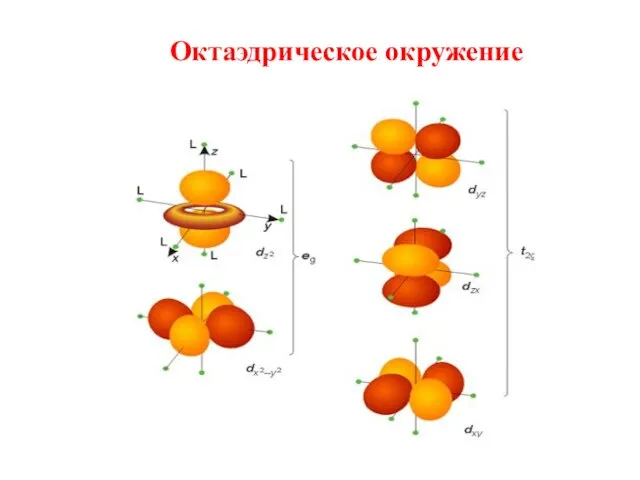
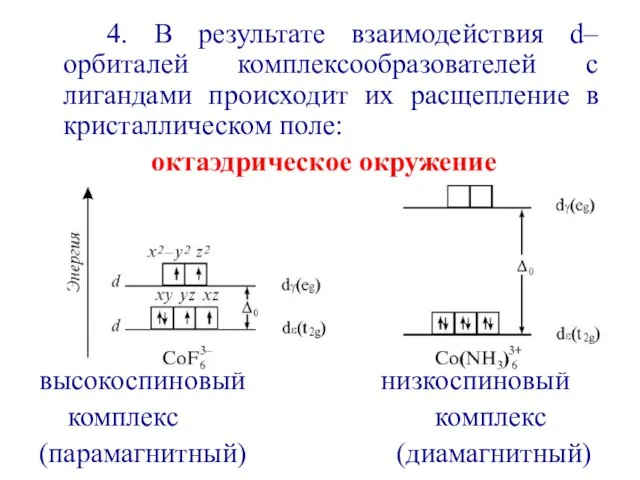
- 19. Октаэдрическое окружение
- 20. 4. В результате взаимодействия d–орбиталей комплексообразователей с лигандами происходит их расщепление в кристаллическом поле: октаэдрическое окружение
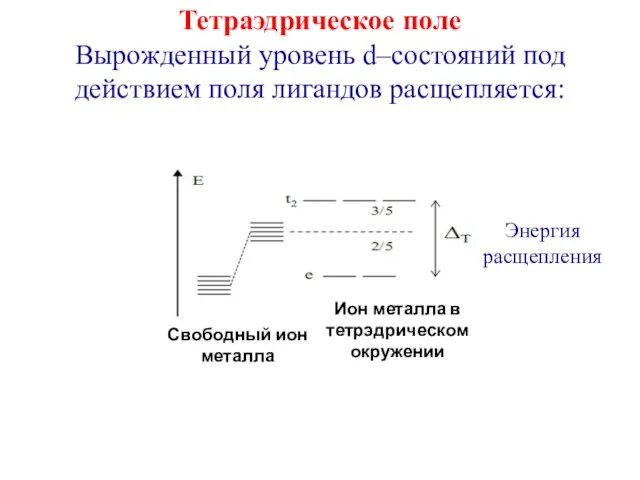
- 21. Тетраэдрическое поле Вырожденный уровень d–состояний под действием поля лигандов расщепляется: Энергия расщепления Ион металла в тетрэдрическом
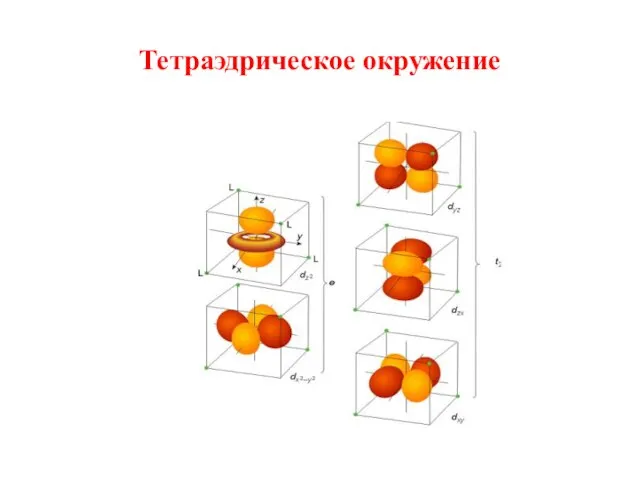
- 22. Тетраэдрическое окружение
- 23. 5. Значение энергии расщепления (∆) тем больше, чем сильнее воздействие лиганда. В спектрохимическом ряду лиганды расположены
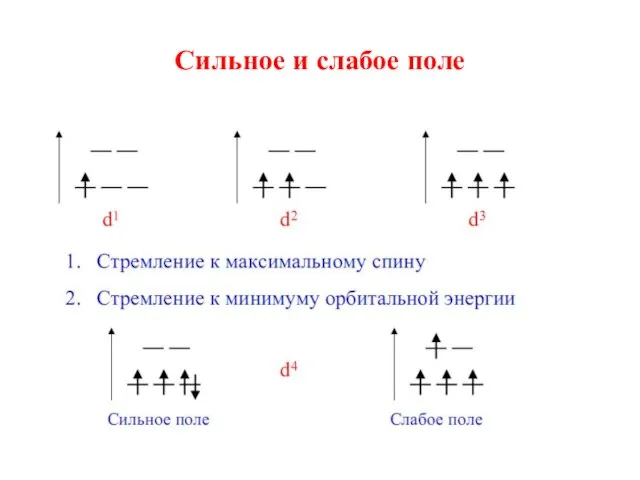
- 24. 6. Заполнение орбиталей происходит в соответствии с правилом Хунда: а) если имеются лиганды со слабым расщепляющим
- 25. Сильное и слабое поле
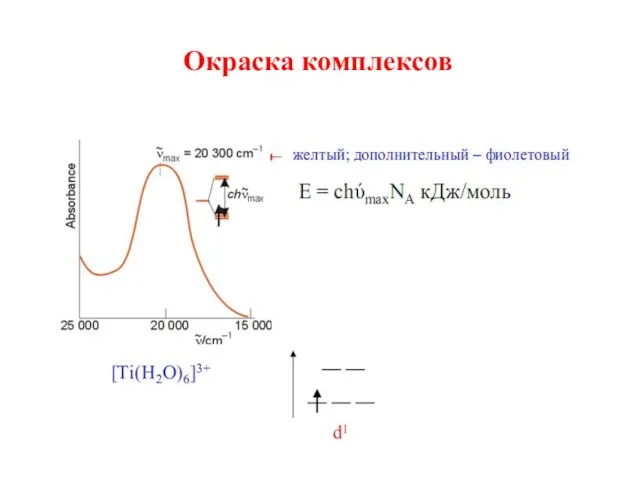
- 26. Окраску комплексов теория кристаллического поля объясняет поглощением света комплексными соединениями, при котором происходит переход электронов в
- 27. Окраска комплексов
- 28. Теория кристаллического поля
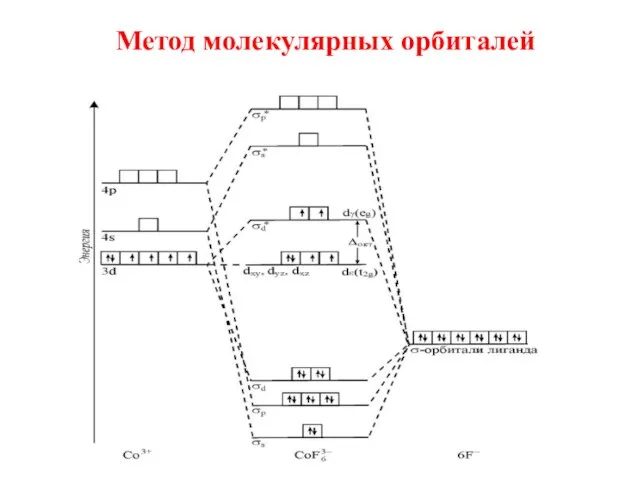
- 29. 3. Метод молекулярных орбиталей 1. В ММО учитывается детальная электронная структура не только комплексообразователя, но и
- 30. Метод молекулярных орбиталей
- 32. Скачать презентацию






![Все валентные электроны спарены. Комплекс [Co(NH3)6]3+ - диамагнитный, что согласуется с экспериментом.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/278922/slide-9.jpg)








 Презентация на тему Моё солнышко
Презентация на тему Моё солнышко Проект по теме Россия в первой половине 19 века
Проект по теме Россия в первой половине 19 века Начальная военная подготовка. Занятие 1
Начальная военная подготовка. Занятие 1 Здоровье – это вершина, на которую каждый должен подняться сам
Здоровье – это вершина, на которую каждый должен подняться сам ЗОНА УЧАЩИХСЯ ЗОНА УЧИТЕЛЕЙ ЗОНА РОДИТЕЛЕЙ ИНФОРМАЦИОННАЯ ЗОНА.
ЗОНА УЧАЩИХСЯ ЗОНА УЧИТЕЛЕЙ ЗОНА РОДИТЕЛЕЙ ИНФОРМАЦИОННАЯ ЗОНА. Риторическая компетенция как ведущее средство образования
Риторическая компетенция как ведущее средство образования Управление ассортиментом яиц, реализуемых в торговом предприятии
Управление ассортиментом яиц, реализуемых в торговом предприятии "Счастливый случай"
"Счастливый случай" Кой се страхува от сладката овчица?
Кой се страхува от сладката овчица? Подготовка к Крещению 2022
Подготовка к Крещению 2022 Twitter и геоинформационные сервисы – неиспользованные возможности
Twitter и геоинформационные сервисы – неиспользованные возможности A city of great opportunities
A city of great opportunities Задача создания инновационных кластеров в Санкт-Петербурге в контексте зарубежного опыта
Задача создания инновационных кластеров в Санкт-Петербурге в контексте зарубежного опыта Реализация пилотного проекта Цифровой РЭС – Крымэнерго
Реализация пилотного проекта Цифровой РЭС – Крымэнерго 8608_1_0
8608_1_0 Презентация на тему Старинные меры длины и веса
Презентация на тему Старинные меры длины и веса  Планирование. Приступаем к планированию
Планирование. Приступаем к планированию Анализ информации в изображении
Анализ информации в изображении Технология автоматической векторизации рельефа средствами ArcGIS при создании цифровой модели рельефа для ЦБКММ (на примере района
Технология автоматической векторизации рельефа средствами ArcGIS при создании цифровой модели рельефа для ЦБКММ (на примере района  Появление инея в природе
Появление инея в природе Презентация на тему Аутоиммунитет
Презентация на тему Аутоиммунитет  Компьютерная память
Компьютерная память Воздушный транспорт
Воздушный транспорт Назначение керамики
Назначение керамики Этикет. Правила этикета
Этикет. Правила этикета НАШИ ПЕРНАТЫЕ ДРУЗЬЯ
НАШИ ПЕРНАТЫЕ ДРУЗЬЯ Бюджет для граждан МО город Узловая
Бюджет для граждан МО город Узловая Валютные отношения и валютные системы
Валютные отношения и валютные системы