Содержание
- 2. H Cl Из галогеноводородов особое значение имеет хлороводород и его раствор в воде. Химическая формула хлороводорода
- 3. В промышленности хлороводород получают сжиганием водорода в хлоре. Н2 + Сl2 = 2HCl Водород сжигают до
- 4. Хлороводород- бесцветный газ, немного тяжелее воздуха, с резким запахом, во влажном воздухе дымит. Наиболее характерным свойством
- 5. Так, если заполненный хлороводородом цилиндр закрыть стеклянной пластинкой, опрокинуть вверх дном, внести в воду и пластинку
- 6. Хлороводород при обычных условиях не реагирует ни с неметаллами ни с их оксидами. Химические свойства.
- 7. Основная масса хлороводорода используется для производства соляной кислоты. Благодаря тому что хлороводород может присоединяться к молекулам
- 8. Синтетический каучук в процессе изготовления.
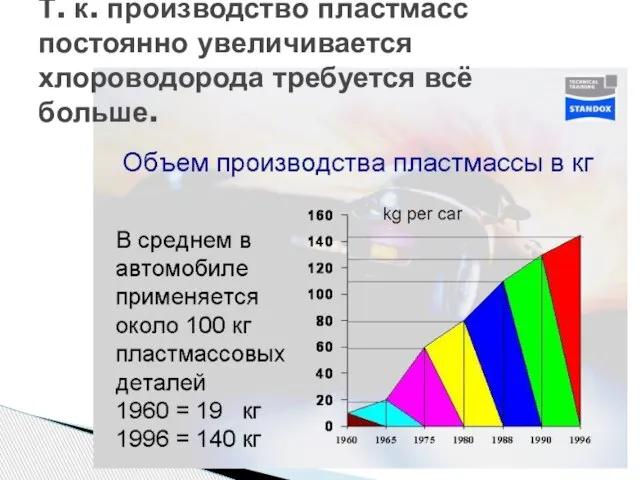
- 9. Т. к. производство пластмасс постоянно увеличивается хлороводорода требуется всё больше.
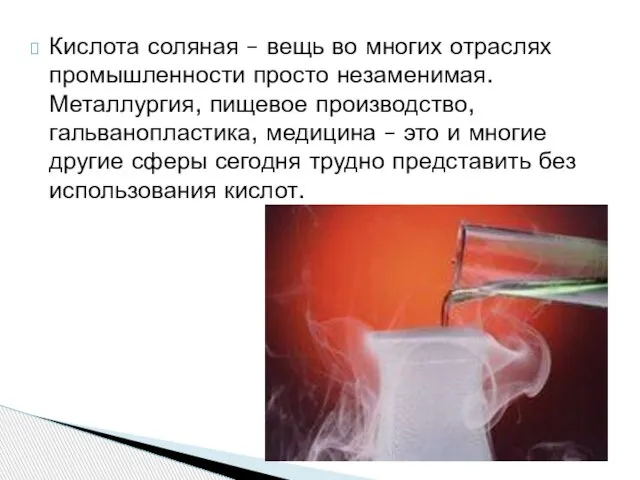
- 10. Кислота соляная – вещь во многих отраслях промышленности просто незаменимая. Металлургия, пищевое производство, гальванопластика, медицина –
- 11. Металлургия. Соляная кислота техническая применяется для зачистки металлов при лужении и паянии. Также кислота соляная используется
- 12. Взаимодействие с соляной кислотой: цинка; соды.
- 14. Скачать презентацию









 Государственная дума и развитие парламентаризма в России
Государственная дума и развитие парламентаризма в России Знакомство с техникой Айрис Фолдинг
Знакомство с техникой Айрис Фолдинг Бюджет для граждан 2021 год
Бюджет для граждан 2021 год Электрический ток в вакууме. Диод
Электрический ток в вакууме. Диод Графическая информация и компьютер 8 класс
Графическая информация и компьютер 8 класс Гжель. Урок изобразительного искусства 5 класс
Гжель. Урок изобразительного искусства 5 класс ПРЕДЛОГ – ЭТО ЧАСТЬ РЕЧИ, КОТОРАЯ ВЫРАЖАЕТ ОДНИХ СЛОВ ДРУГИХ СЛОВ СЛОВОСОЧЕТАНИИ И ПРЕДЛОЖЕНИИ
ПРЕДЛОГ – ЭТО ЧАСТЬ РЕЧИ, КОТОРАЯ ВЫРАЖАЕТ ОДНИХ СЛОВ ДРУГИХ СЛОВ СЛОВОСОЧЕТАНИИ И ПРЕДЛОЖЕНИИ Модель Митчелла и Хауса
Модель Митчелла и Хауса Презентация на тему Увеличиваем, уменьшаем число на 2
Презентация на тему Увеличиваем, уменьшаем число на 2 РОДИТЕЛЬСКОЕ СОБРАНИЕ тема: «Безопасный интернет»
РОДИТЕЛЬСКОЕ СОБРАНИЕ тема: «Безопасный интернет» ИТОГИ РАБОТЫ ЭКСПЕРТНОЙ ГРУППЫ
ИТОГИ РАБОТЫ ЭКСПЕРТНОЙ ГРУППЫ Команда «Ньютоновы яблоки»
Команда «Ньютоновы яблоки» Индивидуальная образовательная траектория Базовые образовательные предметы Профильные образовательные предметы Элективные кур
Индивидуальная образовательная траектория Базовые образовательные предметы Профильные образовательные предметы Элективные кур Flats for sale in Urban Skyline Ravet
Flats for sale in Urban Skyline Ravet Image Quality, digital tehnology
Image Quality, digital tehnology Урок физкультуры во 2 классе. Гибкость. Упражнения для развития гибкости
Урок физкультуры во 2 классе. Гибкость. Упражнения для развития гибкости Установка ГНБ
Установка ГНБ Обучение в сотрудничестве. Что это такое?
Обучение в сотрудничестве. Что это такое? Методы проведения дискуссии
Методы проведения дискуссии  океанова
океанова "УМНИЦА"
"УМНИЦА" Как жить сегодня, чтобы иметь шанс увидеть завтра
Как жить сегодня, чтобы иметь шанс увидеть завтра Необычные памятники
Необычные памятники Ekonomika_Praktika_2_1
Ekonomika_Praktika_2_1 Доступ к образованию в странах третьего мира
Доступ к образованию в странах третьего мира Software Design Lecture Outline
Software Design Lecture Outline  Учитель русского языка и литературы Воронков Алексей Михайлович Сохновская средняя школа
Учитель русского языка и литературы Воронков Алексей Михайлович Сохновская средняя школа Презентация на тему Основные этапы становления культурологии как науки
Презентация на тему Основные этапы становления культурологии как науки