Слайд 3Качественный
анализ (идентификация)
Элементный анализ.
Ионный анализ.
Фазовый анализ.
Функциональный анализ.
Молекулярный анализ.
Изотопный анализ

Слайд 4Количественный
анализ
Определение макрокомпонентов.
Определение микрокомпонентов.
Определение следовых количеств вещества.

Слайд 5Структурный
анализ
Определение взаимного расположения атомов в молекуле.
Определение параметров кристаллической решетки.

Слайд 6Этапы химического анализа:
постановка задачи;
выбор метода и схемы анализа;
отбор пробы;
4)

подготовка пробы к анализу;
5) измерение аналитического сигнала;
6) обработка результатов измерений.
Слайд 8Аналитическая реакция приводит к резкому изменению свойств анализируемого объекта, которое легко обнаруживается.

Внешний эффект аналитических реакций называется аналитическим сигналом. Реактив, под действием которого обнаруживаемый компонент вступает в аналитическую реакцию, называется аналитическим реагентом
Слайд 9Выделяют следующие основные виды аналитического сигнала:
Образование осадка, обладающего характерными физическими (цвет, форма

и размер кристаллов) и химическими (взаимодействие с теми или иными реагентами) свойствами:
Ag+ + Cl– → AgCl (т., бел.),
Слайд 10 Изменение цвета раствора:
2CrО2 –+ 3H2O2 + 2OH – → 2CrО42 – +

4H2O - при обнаружении ионов хрома (III) наблюдают изменение цвета раствора с зеленого (хромит-ион 2CrО2 –) на желтый (хромат-ион CrО42 –).
Выделение газа (обнаруживаемое по образованию пузырьков или появлению характерного запаха):
CO32 – + 2H+ → ( H2CO3 ) H2O + CO2 (г.) - при обнаружении карбонат-ионов наблюдают выделение пузырьков углекислого газа.
S2 – + 2HCl → H2S + 2Cl – - при обнаружении сульфид-ионов наблюдают появление характерного запаха сероводорода.
Слайд 11 Образование кристаллов определенной формы

Слайд 12Аналитические реакции и аналитические реактивы делятся на:
групповые (с реактивом одинаково взаимодействует

группа, т.е. несколько ионов);
избирательные реакции (с реактивом одинаково взаимодействует небольшое число ионов);
специфические или селективные реакции (с реактивом взаимодействует только одно вещество).
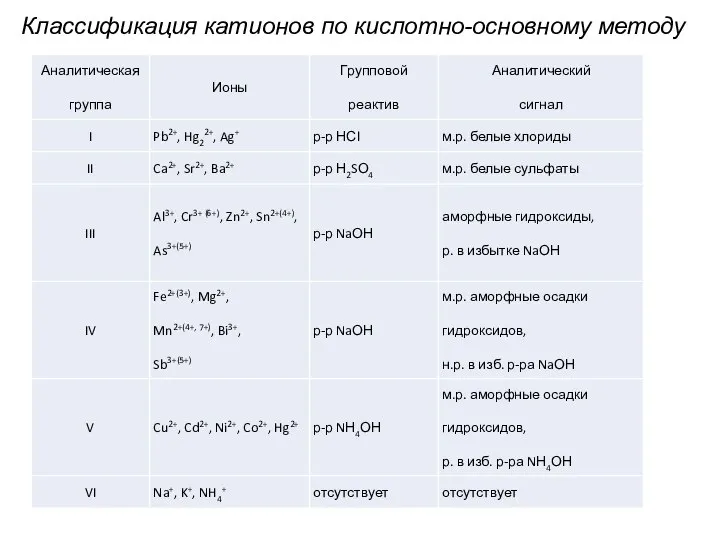
Слайд 14Классификация катионов по кислотно-основному методу
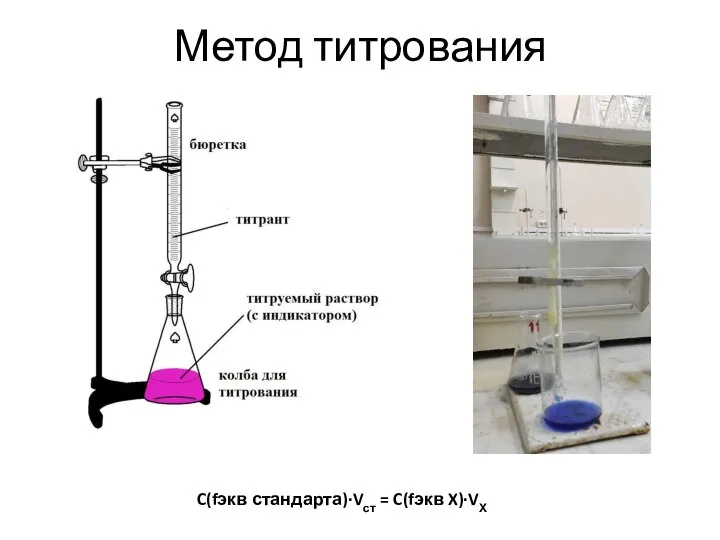
Слайд 16Метод титрования
C(fэкв стандарта)∙Vст = C(fэкв X)∙VХ
Слайд 17Важнейшие характеристики аналитической методики:
Предел обнаружения.
Предел определения.
Селективность.
Надежность.














 Проектирование образовательных программ
Проектирование образовательных программ В гостях у фараона
В гостях у фараона Суд над алкоголем.
Суд над алкоголем. Экономия компаний на страховых взносах
Экономия компаний на страховых взносах ПРАВО КАК ПРОЦЕДУРА
ПРАВО КАК ПРОЦЕДУРА Презентация на тему Что такое окружающий мир (1 класс)
Презентация на тему Что такое окружающий мир (1 класс) Презентация на тему Алгоритм и его свойства
Презентация на тему Алгоритм и его свойства Работа ученика 3 «А»класса Работа ученика 3 «А»класса Речистова Димы.
Работа ученика 3 «А»класса Работа ученика 3 «А»класса Речистова Димы. Расширение Единой системы газоснабжения ДЛЯ ОБЕСПЕЧЕНИЯ ПОДАЧИ ГАЗА В ГАЗОПРОВОД «ЮЖНЫЙ ПОТОК»
Расширение Единой системы газоснабжения ДЛЯ ОБЕСПЕЧЕНИЯ ПОДАЧИ ГАЗА В ГАЗОПРОВОД «ЮЖНЫЙ ПОТОК» УПРАВЛЕНИЕ GML (ПРОДОЛЖЕНИЕ)
УПРАВЛЕНИЕ GML (ПРОДОЛЖЕНИЕ) Мир звуков. Каков он?
Мир звуков. Каков он? Международно-правовая защита жертв вооружённых конфликтов
Международно-правовая защита жертв вооружённых конфликтов Мартеновская печь
Мартеновская печь УБРАНСТВО ТРАДИЦИОННОГО ЖИЛИЩА
УБРАНСТВО ТРАДИЦИОННОГО ЖИЛИЩА Бизнес – план инвестиционного проекта строительство «Аква-парка»
Бизнес – план инвестиционного проекта строительство «Аква-парка» Контакт-центр
Контакт-центр Трудные случаи обособления
Трудные случаи обособления Мейоз
Мейоз Дисахариды (биозы)
Дисахариды (биозы)  Шаблоны грамот. Главное финансовое управление Витебского областного исполнительного комитета
Шаблоны грамот. Главное финансовое управление Витебского областного исполнительного комитета Презентация на тему Углеводороды 10 класс
Презентация на тему Углеводороды 10 класс Игры с буквами - презентация для начальной школы_
Игры с буквами - презентация для начальной школы_ Презентация на тему Древесные материалы
Презентация на тему Древесные материалы  Русские народные загадки
Русские народные загадки Программа Социальный маркетинг
Программа Социальный маркетинг Графики вокруг нас
Графики вокруг нас Медиа-Евангелие от Матвея
Медиа-Евангелие от Матвея Презентация на тему о вреде алкоголя
Презентация на тему о вреде алкоголя