Слайд 2Растворы (дисперсные системы)
Растворы – это физико-химические дисперсные системы состоящие из двух или

более компонентов.
Слайд 3Дисперсная система, фаза, среда
В растворах частицы одного вещества равномерно распределены в другом

веществе, возникает дисперсная система. Растворенное вещество называется дисперсной фазой, а вещество, в котором распределена дисперсная фаза, — дисперсионной средой(растворитель).
Слайд 4По величине частиц дисперсной фазы растворы разделяют на:
Грубодисперсные системы(взвеси) – это

гетерогенные системы (неоднородные). Размеры частиц этой фазы от 10⁻⁵ до 10⁻⁷м. Не устойчивы и видны невооруженным глазом (суспензии, эмульсии, пены, порошки).
Слайд 5По величине частиц дисперсной фазы растворы разделяют на:
Коллоидные растворы(тонкодисперсные системы или золи)

– это микрогетерогенные системы. Размер частиц от 10⁻⁷ до 10⁻⁹м. Частицы уже не видны невооруженным глазом, но система не устойчивая. В зависимости от природы дисперсионной среды золи называют гидрозолями – дисперсионная среда – жидкость, аэрозолями – дисперсионная среда воздух.
Слайд 6По величине частиц дисперсной фазы растворы разделяют на:
Истинные растворы (молекулярнодисперсные и ионнодисперсные
системы). Они не видны невооруженным глазом. Размеры частиц составляют 10ˉ8 см, т.е. равны размерам молекул и ионов. В таких системах гетерогенность исчезает - системы становятся гомогенными и устойчивыми, образуются истинные растворы. К ним относятся растворы сахара, спирта, неэлектролитов, электролитов и слабых электролитов.
Слайд 7Растворимость
Растворимость – способность данного вещества растворятся в данном растворителе и при данных

условиях. Растворимость зависит от нескольких факторов: от природы растворителя и растворенного вещества; от температуры; от давления.
Если молекулы растворителя неполярны или малополярны, то этот растворитель будет хорошо растворять вещества с неполярными молекулами. Хуже будет растворять с большей полярностью. И практически не будет с ионным типом связи.
Слайд 8Растворимость
К полярным растворителям относят воду и глицерин.
К малополярным спирт и ацетон.
К неполярным

хлороформ, эфир, жиры, масла.
Слайд 9Растворимость газов
Растворимость газов в жидкостях увеличивается с повышением давления и понижением температуры.
При

нагревании растворимость газов уменьшается, а кипячением можно полностью добиться освобождения раствора от газа.
Газы лучше растворимы в неполярных растворителях.
Слайд 10Растворимость жидкости
Растворимость жидкости в жидкости увеличивается с повышением температуры и практически не

зависти от давления.
В системах жидкость-жидкость, когда имеет место ограниченную растворимость 1 жидкости во 2 и 2 в 1, наблюдается расслаивание.
При повышении температуры растворимость возрастает и при некоторых температурах происходит полное взаимное растворение этих жидкостей. Эта температура называется критичной температурой растворения и выше нее расслаивание не наблюдается.
Слайд 11Растворимость твердых веществ
Растворимость твердых веществ в жидкостях мало зависит от температуры и

не зависти от давления. Жидкость является растворителем, может растворять вещества до тех пор пока не достигается определенная концентрация, которая не может быть увеличена, как бы долго не происходил контакт между растворителем и растворенным веществом. Достижение таким образом равновесия, раствор называется насыщенным.
Слайд 12Раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе, и

в котором при данных условиях можно растворить еще некоторое его количество, называется ненасыщенным раствором.
Раствор, содержащий при данных условиях больше растворённого вещества, чем в насыщенном растворе, избыток вещества легко выпадает в осадок, называется пересыщенным раствором.
Слайд 13Гидратная теория Менделеева
К концу 19 века сформировались 2 противоположные точки зрения на

природу раствора: физическая и химическая
Физическая теория рассматривала растворы, как смеси образовавшиеся в результате дробления растворимого вещества в среде растворителя без химического воздействия между ними.
Химическая теория рассматривала процесс образования растворов, как химическое взаимодействие молекул растворяемого вещества и молекул растворителя.












 По радуге звуков и букв
По радуге звуков и букв День Защитника Отечества
День Защитника Отечества Презентация на тему Музыка эпохи классицизма
Презентация на тему Музыка эпохи классицизма ОАО «ВЕРХНЕКАМТИСИЗ»
ОАО «ВЕРХНЕКАМТИСИЗ» Тропические леса Африки
Тропические леса Африки Развитие социальной педагогики за рубежом
Развитие социальной педагогики за рубежом Презентация на тему железы внутренних секреции
Презентация на тему железы внутренних секреции ABC-анализ
ABC-анализ Общие положения по монтажу внутренних газопроводов и газоиспользующего оборудования
Общие положения по монтажу внутренних газопроводов и газоиспользующего оборудования Об условиях оплаты труда работников государственных учреждений здравоохранения Республики Татарстан
Об условиях оплаты труда работников государственных учреждений здравоохранения Республики Татарстан Мотивация как функция управления
Мотивация как функция управления ПРОБЛЕМЫ ПОСТРОЕНИЯ СЕТЕЙ СВЯЗИ СЛЕДУЮЩЕГО ПОКОЛЕНИЯ
ПРОБЛЕМЫ ПОСТРОЕНИЯ СЕТЕЙ СВЯЗИ СЛЕДУЮЩЕГО ПОКОЛЕНИЯ Электронный процессор Excel
Электронный процессор Excel Демонстрационный эксперимент
Демонстрационный эксперимент Введение
Введение Микрофон DPA 4071 для кинопроизводства, театральных постановок, телевещания
Микрофон DPA 4071 для кинопроизводства, театральных постановок, телевещания Дарья Андреевна Халтурина Пути разработки алкогольной политики России: мировой опыт и научные исследования Москва, 2007
Дарья Андреевна Халтурина Пути разработки алкогольной политики России: мировой опыт и научные исследования Москва, 2007 Добро пожаловать в псма рус!
Добро пожаловать в псма рус! ЭЛЕМЕНТЫ ПСИХОЛОГИЧЕСКОГО ВОЗДЕЙСТВИЯ УПАКОВКИ НА ПОТРЕБИТЕЛЯ
ЭЛЕМЕНТЫ ПСИХОЛОГИЧЕСКОГО ВОЗДЕЙСТВИЯ УПАКОВКИ НА ПОТРЕБИТЕЛЯ Эффективная работа с жалобами. Почта Банк
Эффективная работа с жалобами. Почта Банк Выбор комплектующих
Выбор комплектующих Что такое Большая перемена. Предпринимай
Что такое Большая перемена. Предпринимай Армия Казахстана
Армия Казахстана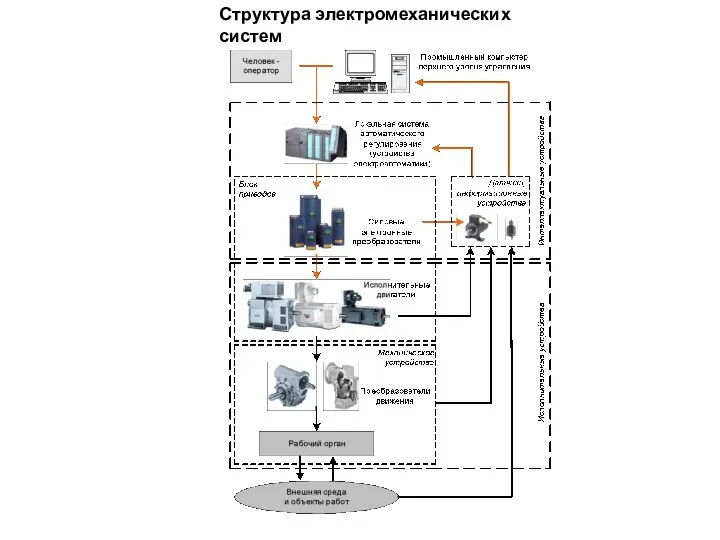 Структура электромеханических систем
Структура электромеханических систем Итоги диагностики качества письма и УУД в 1-м классе
Итоги диагностики качества письма и УУД в 1-м классе Презентация на тему Литература и история. Интерес писателей к историческому прошлому своего народ
Презентация на тему Литература и история. Интерес писателей к историческому прошлому своего народ Менеджер по работе с клиентами
Менеджер по работе с клиентами Искусство Хохломы
Искусство Хохломы