Содержание
- 2. Что читать? А. П. Чупахин «Ионные равновесия в водных растворах. Часть 1. Кислоты, основания, соли». Новосибирск,
- 3. (H2 + O2 = H2O)
- 4. Растворы вокруг нас Все природные жидкости - растворы
- 6. Классификация растворов
- 7. Что такое раствор? Что такое фаза?
- 8. Что такое раствор?
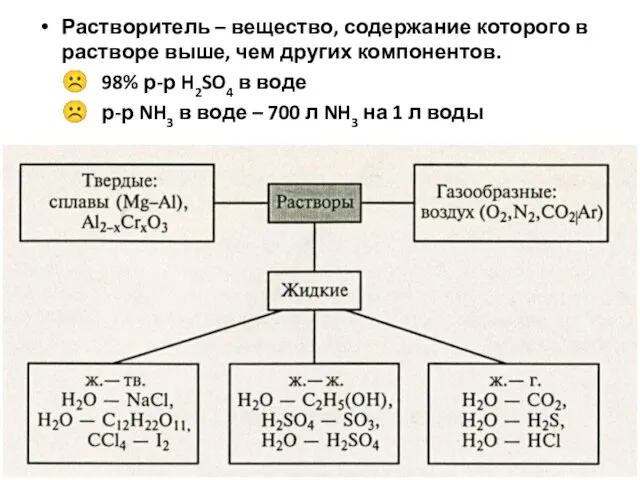
- 9. Растворитель – вещество, содержание которого в растворе выше, чем других компонентов. ☹ 98% р-р H2SO4 в
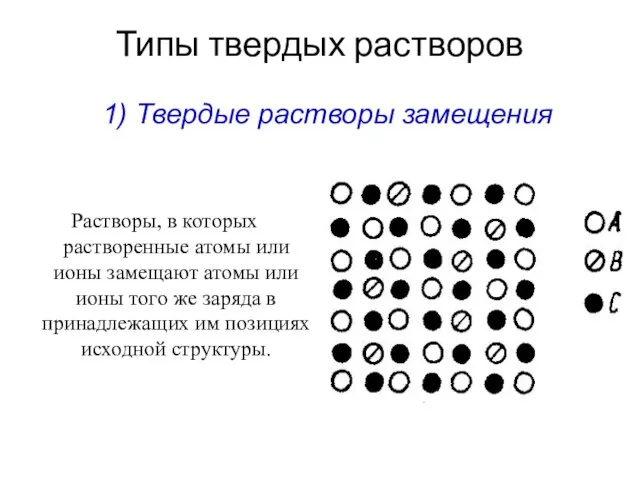
- 10. Типы твердых растворов Растворы, в которых растворенные атомы или ионы замещают атомы или ионы того же
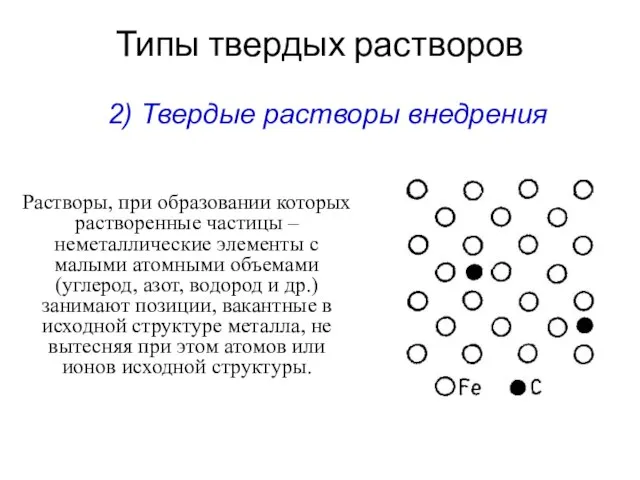
- 11. Типы твердых растворов Растворы, при образовании которых растворенные частицы –неметаллические элементы с малыми атомными объемами (углерод,
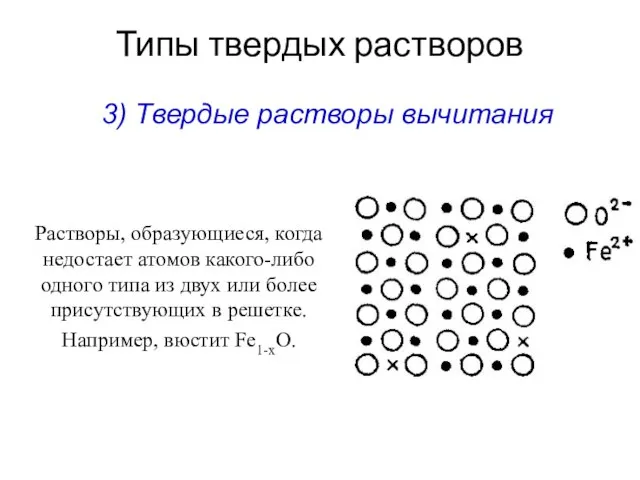
- 12. Типы твердых растворов Растворы, образующиеся, когда недостает атомов какого-либо одного типа из двух или более присутствующих
- 13. Газировка – сложный жидкий раствор
- 14. Дисперсная система
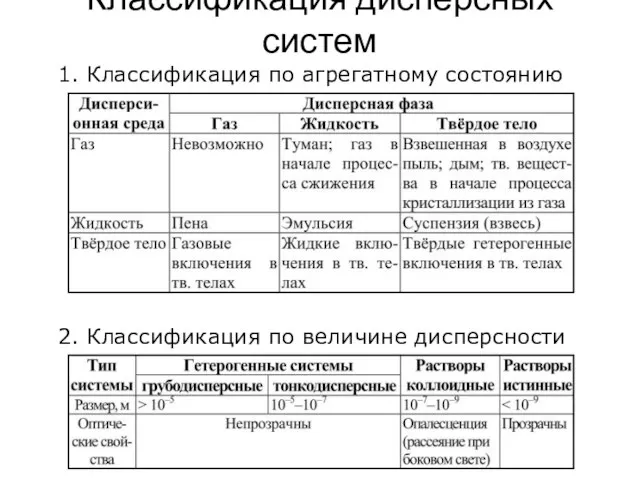
- 15. Классификация дисперсных систем 1. Классификация по агрегатному состоянию 2. Классификация по величине дисперсности
- 16. Истинные растворы В химической практике наиболее важны растворы, приготовленные на основе жидкого растворителя. Именно жидкие смеси
- 17. Истинные растворы В конце XIX века в науке существовало 2 полярных взгляда на природу растворов. Один
- 18. Способы выражения концентраций
- 19. Пример пересчета концентрации
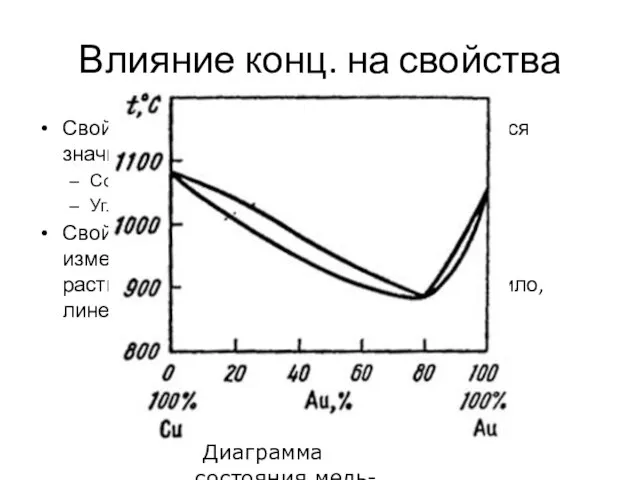
- 20. Влияние конц. на свойства Свойства растворенного вещества изменяются значительно. Соль. Была белой, твердой, тугоплавкой. Углекислый газ.
- 21. Первый закон Рауля Относительное понижение парциального давлениядавления пара растворителя над раствором не зависит от природы растворённого
- 22. Растворы электролитов Растворы веществ, проводящих электрический ток. В XIX веке знали, что проводимость – свойство заряженных
- 23. Аррениус Отклонения от закона Рауля. Пришлось вводить i – изотонический коэффициент (показывает, во сколько раз увеличилось
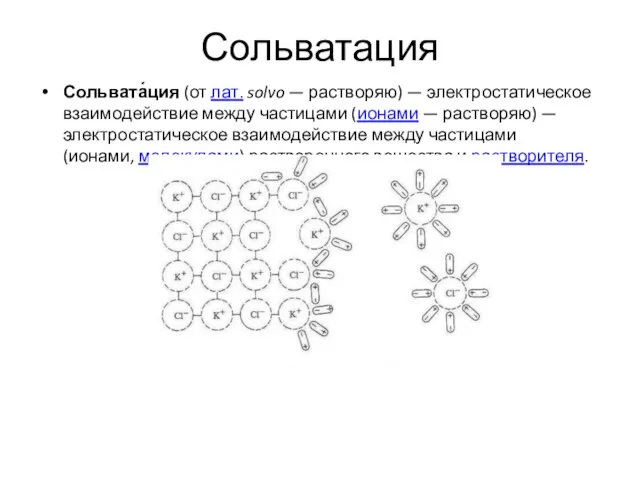
- 24. Сольватация Сольвата́ция (от лат. solvo — растворяю) — электростатическое взаимодействие между частицами (ионами — растворяю) —
- 25. Концентрации сильных электролитов При растворении образуется всегда больше ионов, чем исходного вещества. NaCl → Na+ +
- 26. Уравнение электронейтральности
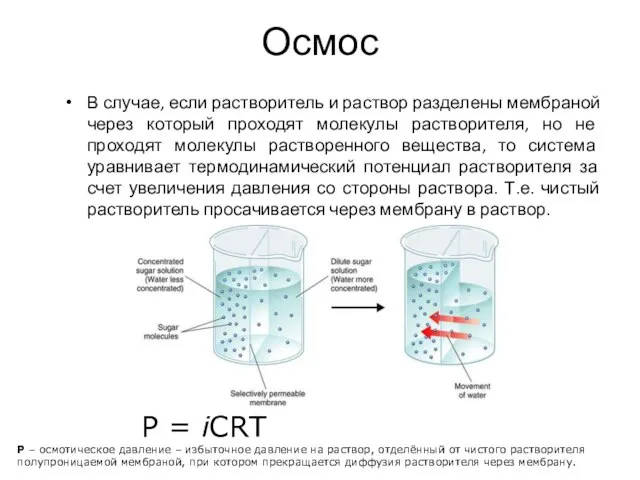
- 27. Осмос В случае, если растворитель и раствор разделены мембраной через который проходят молекулы растворителя, но не
- 28. Осмос Состояние эритроцита в растворах NаСI различной концентрации (в гипотоническом растворе - осмотический гемолиз).
- 30. Скачать презентацию



















 Реактивный двигатель ,
Реактивный двигатель , Проблемы и перспективы «дачной амнистии»: взгляд экспертов
Проблемы и перспективы «дачной амнистии»: взгляд экспертов Государство, его признаки и формы
Государство, его признаки и формы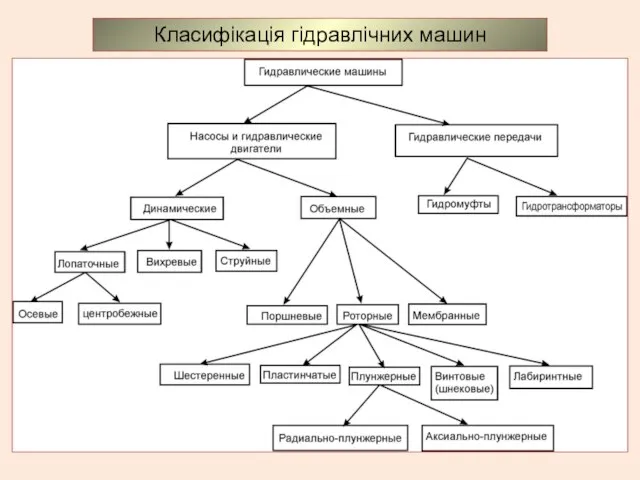 Класифікація гідравлічних машин
Класифікація гідравлічних машин Образы в социальной рекламе
Образы в социальной рекламе Турция
Турция К ВОПРОСУ О РЕГИОНАЛЬНОМ ТЕЛЕМЕДИЦИНСКОМ ЦЕНТРЕСАНКТ-ПЕТЕРБУРГА(ТМЦ СПБ)
К ВОПРОСУ О РЕГИОНАЛЬНОМ ТЕЛЕМЕДИЦИНСКОМ ЦЕНТРЕСАНКТ-ПЕТЕРБУРГА(ТМЦ СПБ) Ежегодно команда юношей принимает участиев межрегиональных соревнованиях среди кадетских корпусов, православных гимназий, дет
Ежегодно команда юношей принимает участиев межрегиональных соревнованиях среди кадетских корпусов, православных гимназий, дет одготовка специалистов для работы с лицами с ОВЗ в Норвегии
одготовка специалистов для работы с лицами с ОВЗ в Норвегии Применение анкерного крепления и хим. упрочнения кровли в условиях Ярегского месторождения
Применение анкерного крепления и хим. упрочнения кровли в условиях Ярегского месторождения Путешествие в город огород
Путешествие в город огород Презентация на тему Духовная жизнь
Презентация на тему Духовная жизнь Питание растений
Питание растений Нормативно-правовые основы и финансово-хозяйственные механизмы перехода на новую систему финансирования
Нормативно-правовые основы и финансово-хозяйственные механизмы перехода на новую систему финансирования Спорт — это здорово
Спорт — это здорово Лев Николаевич Толстой
Лев Николаевич Толстой Prince2 - структурированный метод управления проектами в социальной сфере
Prince2 - структурированный метод управления проектами в социальной сфере Кайнозойская эра
Кайнозойская эра Все профессии важны, с математикой дружны
Все профессии важны, с математикой дружны Физиология, биохимия микроорганизмов (прокариотов: бактерий, эукариотов: простейших, грибов, вирусов)
Физиология, биохимия микроорганизмов (прокариотов: бактерий, эукариотов: простейших, грибов, вирусов) Парад Профессий - ХХI век. Автор Сохибкулова Марина
Парад Профессий - ХХI век. Автор Сохибкулова Марина Trinkgeld für azubis
Trinkgeld für azubis Семинар FCI для судей IGP
Семинар FCI для судей IGP Многогранники
Многогранники Чем интересны музеи
Чем интересны музеи "Пожарные
"Пожарные ОПТИМИЗАЦИЯ ШКОЛЬНОГО САЙТА
ОПТИМИЗАЦИЯ ШКОЛЬНОГО САЙТА к 8 марта с музыкой
к 8 марта с музыкой