5; б) 3; в) 1; г) 7.
2 В реакции, схема которой Fe + Cl2 → FeCl3, окислительные свойства проявляют:
а) молекула хлора; б) атомы железа; в) ионы железа; г) ионы хлора.
3 Все галогены могут проявлять в соединения следующую степень окисления:
а) +7; б) -7; в) +1; г) -1.
4 Соляную кислоту и хлориды можно распознать по их реакции с:
а) хлоридом серебра; б) ионами меди; в) ионами серебра; г) серебром.
5 В порядке усиления окислительных свойств записана пара неметаллов:
а) Br2 и I2 ; б) O2 и S ; в) Cl2 и Ar ; г ) N2 и F2 .
6 Соляная кислота реагирует с обоими веществами в ряду:
а) Hg и AgNO3; б) Mg и K2CO3; в) Zn и Au; г) CaO и CO2.
7 Укажите формулу вещества, необходимого для проведения реакции на этапе 2 в схеме превращений:
1 2
Cl2 → HCl →H2;
а) Ag; б) AgNO3 ; в) Zn ; г) Cu.
8 Со сколькими из перечисленных веществ реагирует соляная кислота: хлорид натрия, карбонат калия, железо, оксид алюминия, кислород, медь, сульфат натрия?
а) 7; б) 6; в) 5; г) 4.
9 Укажите неверные утверждения:
хлор – желто-зеленая жидкость (н.у.)
в соединениях с кислородом хлор имеет отрицательную степень окисления;
температура кипения в группе галогенов сверху вниз увеличивается;
молекула хлороводорода – диполь.
а) 1 и 2; б) 1 и 3; в) 1, 2 и 4 г) 1, 3 и 4.
10 Для реакции алюминия массой 21,6 необходим хлор объёмом (дм3, н.у.)
А) 22,4; б) 17, 92; в) 26, 88; г) 35,84.
1 Число электронов, находящихся у галогенов на внешнем слое равно:
а) 5; б) 3; в) 1; г) 7.
2 В реакции, схема которой Al + Cl2 → AlCl3, окислительные свойства проявляют:
а) молекула хлора; б) атомы алюминия; в) ионы алюминия; г) ионы хлора.
3 Все галогены могут проявлять в соединения следующую степень окисления:
а) +7; б) -7; в) +1; г) -1.
4 Соляную кислоту и хлориды можно распознать по их реакции с:
а) хлоридом серебра; б) ионами железа; в) ионами серебра; г) серебром.
5 В порядке усиления окислительных свойств записана пара неметаллов:
а) O2 и I2 ; б) Cl2 и S ; в) Br2 и Kr ; г)Br2 и F2 .
6 Соляная кислота реагирует с обоими веществами в ряду:
а) Cu и AgNO3; б) Ca и Na2CO3; в) Zn и Hg; г) Al2O3 и P2 O5.
7 Укажите формулу вещества, необходимого для проведения реакции на этапе 2 в схеме превращений:
1 2
H2 → HCl → HNO3 ;
а) Ag; б) AgNO3 ; в) Zn(NO3)2 ; г) Cu.
8 Со сколькими из перечисленных веществ реагирует соляная кислота: хлорид калия, карбонат натрия, магний, оксид цинка , кислород, золото, сульфат калия?
а) 7; б) 6; в) 5; г) 4.
9 Укажите неверные утверждения:
фтор – желто-зеленый газ (н.у.)
в соединениях с кислородом бром имеет отрицательную степень окисления;
температура плавления в группе галогенов сверху вниз увеличивается;
хлороводород плохо растворим в воде.
а) 1 и 2; б) 1 и 3; в) 1, 2 и 4 г) 1, 3 и 4.
10 Для реакции железа массой 44,8 г необходим фтор объёмом (дм3, н.у.)
А) 22,4; б) 17, 92; в) 26, 88; г) 35,84.
















 Сервис Мечты
Сервис Мечты Основи формування і реєстраціi корисного сигналу в діапазоні
Основи формування і реєстраціi корисного сигналу в діапазоні Комплексная система автоматизации
Комплексная система автоматизации Телепорт
Телепорт Осторожно! Сосульки
Осторожно! Сосульки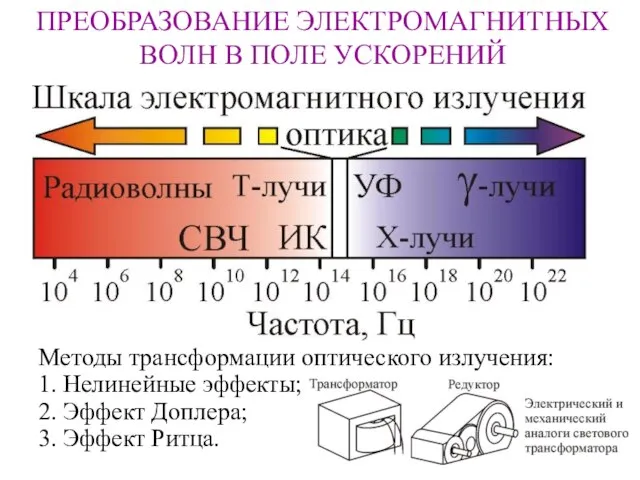 ПРЕОБРАЗОВАНИЕ ЭЛЕКТРОМАГНИТНЫХ ВОЛН В ПОЛЕ УСКОРЕНИЙ
ПРЕОБРАЗОВАНИЕ ЭЛЕКТРОМАГНИТНЫХ ВОЛН В ПОЛЕ УСКОРЕНИЙ Примеры комбинаторных задач (9 класс)
Примеры комбинаторных задач (9 класс) Решение логических задач из курса кибернетики
Решение логических задач из курса кибернетики Бедность
Бедность Nocturnal eczema: Review of sleep and circadian rhythms
Nocturnal eczema: Review of sleep and circadian rhythms Microsoft Office Word 2007
Microsoft Office Word 2007 Международное сотрудничество в освоении космического пространства
Международное сотрудничество в освоении космического пространства Золото
Золото Презентация на тему Загадки о диких животных
Презентация на тему Загадки о диких животных Королева оркестра
Королева оркестра Экологическое просвещение в творчествеВладимира Алексеевича Чивилихина
Экологическое просвещение в творчествеВладимира Алексеевича Чивилихина Ҳозирги замон ҳуқуқи ва унинг моҳияти ҳақидаги концепциялар
Ҳозирги замон ҳуқуқи ва унинг моҳияти ҳақидаги концепциялар Образ Чичикова в поэме "Мертвые души"
Образ Чичикова в поэме "Мертвые души" Табір "Світанок"
Табір "Світанок" Презентация на тему Уфа – столица Башкортостана
Презентация на тему Уфа – столица Башкортостана Онтология
Онтология  Источники загрязнения окружающей среды
Источники загрязнения окружающей среды Project_A
Project_A Типы связи слов в словосочетании
Типы связи слов в словосочетании Всероссийский флешмоб Голубь мира
Всероссийский флешмоб Голубь мира Работа головного мозга находится в прямой зависимости от качества нашего питания, чем оно лучше, тем выше наши интеллектуальные во
Работа головного мозга находится в прямой зависимости от качества нашего питания, чем оно лучше, тем выше наши интеллектуальные во БИОСИНТЕЗ
БИОСИНТЕЗ Сусымалы компоненттерді мөлшерлеу мен қоспалау желісі. Дарис 12
Сусымалы компоненттерді мөлшерлеу мен қоспалау желісі. Дарис 12