Слайд 2
Мета: поглибити знання про умови протікання реакцій обміну; повторити правила складання

молекулярних рівнянь реакцій обміну; навчитися визначати чи відбувається іонний обмін між розчинами електролітів та складати іонні рівняння для реакцій обміну.
Слайд 3Актуалізація знань:
Які типи хімічних реакцій нам відомі?
Сполучення – А+В=АВ
Заміщення – АВ +

С = СВ + А
Обміну – АВ + СД = СВ + АД
Розкладу , як виняток вчать напам'ять.
Слайд 4Актуалізація знань:
Запишіть розв’язок рівнянь реакцій:
P(V) + O2 =
Li + O2 =
Fe(ІІІ) + Cl2 =
FeCl2 + Cl2 =
H2 + F2 =
Ca + O2 =
N2(ІІІ) + O2 =
Al(OH)3 + HCl =
FeBr3 + Cl2 =
P2O5 + H2O =
Ca + H3PO4 =
KClO3 =
Na + Br2 =
Ag + S(ІІ) =

Слайд 5Алгоритм складання рівнянь реакцій іонного обміну
Записуємо умову рівняння:
FeBr3 + Ba(OH)2 =
Складаємо молекулярне

рівняння:
3FeBr3 + 2Ba(OH)2=2Fe(OH)3 + 3BaBr2
р р н р
Класифікуємо речовини на електроліти та неелктроліти.
Слайд 6Алгоритм складання рівнянь реакцій іонного обміну
Кожний електроліт розщеплюємо на іони, неелектроліти залишаємо

в молекулярному вигляді:
Fe3+ + Br- +Ba2+ +ОН- =
= 2Fe(OH)3 + Ba2+ + Fe3+
Слайд 7Алгоритм складання рівнянь реакцій іонного обміну
Урівнюємо іонне і молекулярне рівняння:
2FeBr3 + 3Ba(OH)2=2Fe(OH)3

+ 3BaBr2
2Fe3+ + 6Br- +3Ba2+ +6ОН- =
= 2Fe(OH)3 +3Ba2+ + 6Br-
Слайд 8Алгоритм складання рівнянь реакцій іонного обміну
Однакові іони не впливають на перебіг іонного

обміну, тому в рівнянні їх скорочують:
2Fe3+ + 6Br- +3Ba2+ +6ОН- =
= 2Fe(OH)3 +3Ba2+ + 6Br-
Отримуємо скорочене іонне ріняння:
2Fe3+ 6ОН- = 2Fe(OH)3
Слайд 9Результат роботи:
3FeBr3 + 3Ba(OH)2=2Fe(OH)3 + 3BaBr2
Fe3+ + 6Br- +3Ba2+ +6ОН- =
=

2Fe(OH)3 +3Ba2+ + 6Br-
2Fe3+ 6ОН- = 2Fe(OH)3
Слайд 10Підсумки:
Отже запам'ятайте – реакції іонного обміну відбуваються, якщо:
Випадає осад ( утворюється нерозчинна

речовина);
Виділяється газ: H2CO3=H2O+CO2 ↑
H2SO3=H2O+SO2 ↑
H2S ↑
Утворюється вода : H2O
Слайд 11Обмін не відбувається:
Якщо в результаті реакції всі утворені речовини електроліти:
2NaOH + K2SO4

= Na2SO4 + 2KOH
р р р р
2NaOH + K2SO4 ↔Na2SO4 + 2KOH
Слайд 12Завдання на закріплення:
Визначте чи відбувається іонний обмін, та запишіть рівняння іонного обміну:
CaCl2

+ Na2CO3 =
K2S + HCl =
KOH + H3PO4 =
ZnBr2 + NaNO3 =
Слайд 13Перевірка:
CaCl2 + Na2CO3 = CaCO3 +2NaCl
р р н р
Ca2+ +2Cl- +2Na+
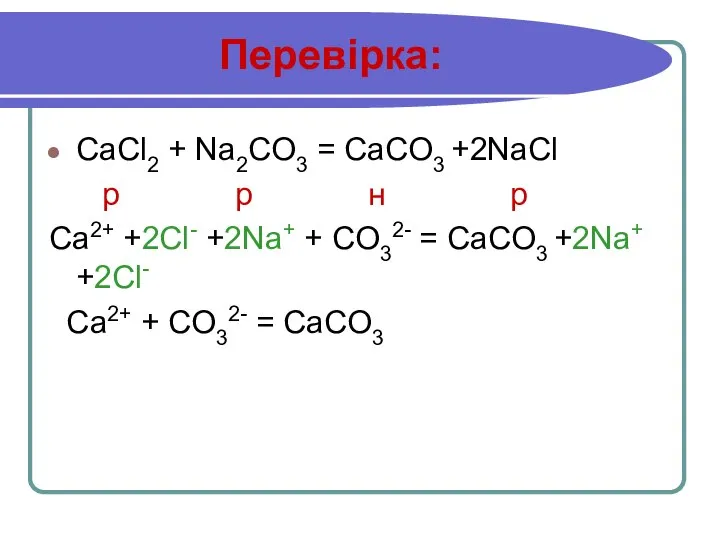
+ CO32- = CaCO3 +2Na+ +2Cl-
Ca2+ + CO32- = CaCO3
Слайд 14Перевірка:
K2S + 2HCl =2KCl +H2S
р р р н
2K++ S2- +
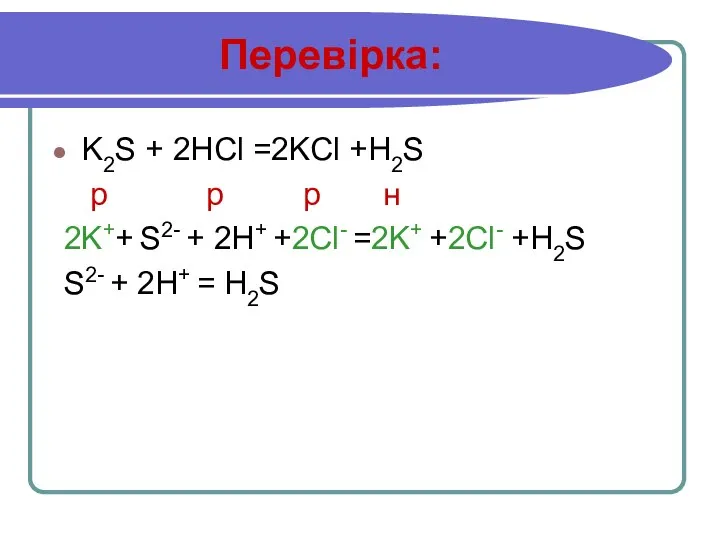
2H+ +2Cl- =2K+ +2Cl- +H2S
S2- + 2H+ = H2S
Слайд 15Перевірка:
3KOH + H3PO4 =K3PO4 +3H2O
р р р н
3K+ +3OH- + 3H++PO43-
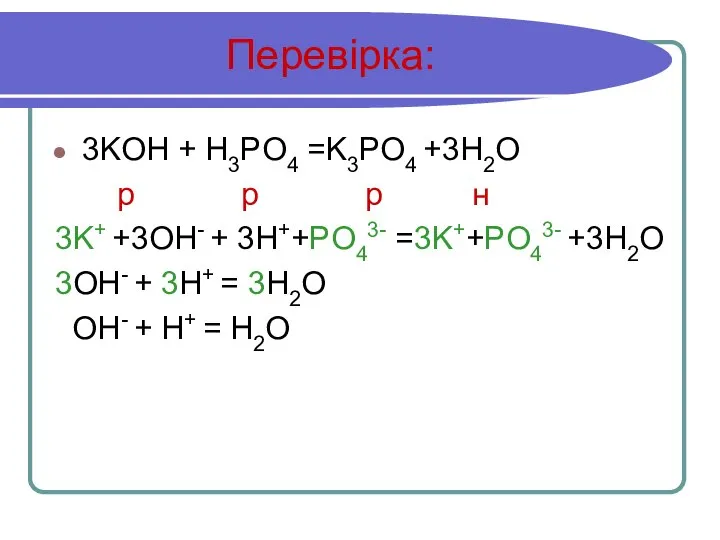
=3K++PO43- +3H2O
3OH- + 3H+ = 3H2O
OH- + H+ = H2O














 Презентация на тему Андропов
Презентация на тему Андропов  Создание индивидуального образа
Создание индивидуального образа Логопсихологическое обследование
Логопсихологическое обследование Презентация
Презентация Тема урока:Решение неравенств второй степени с одной переменной
Тема урока:Решение неравенств второй степени с одной переменной Генерация идей. Принципы и необходимость брейнсторминга
Генерация идей. Принципы и необходимость брейнсторминга Сладкие супы
Сладкие супы Российские железные дороги. Аналитическое исследование. Анализ действующего прейскуранта №10-01 на перевозки грузов
Российские железные дороги. Аналитическое исследование. Анализ действующего прейскуранта №10-01 на перевозки грузов Умные каникулы в музее
Умные каникулы в музее Пушкин Сказки
Пушкин Сказки Поэтическая мастерская
Поэтическая мастерская ПОП-АРТ
ПОП-АРТ Плюсы и минусы верховой езды
Плюсы и минусы верховой езды Рестайлинг Darrio
Рестайлинг Darrio Турецкий Язык. Урок № 1, часть 1. Введение в турецкий язык
Турецкий Язык. Урок № 1, часть 1. Введение в турецкий язык Present Simple
Present Simple Пример структуры презентации
Пример структуры презентации Тема: Страхование убытков от перерывов в производстве
Тема: Страхование убытков от перерывов в производстве Презентация для гильдии маркетологовМосква, 26.09.2011
Презентация для гильдии маркетологовМосква, 26.09.2011 Промоушены к экстраваганзе сентябрь 2021
Промоушены к экстраваганзе сентябрь 2021 Псалом 4. Вечнозаветная псалтирь на святорусском языке
Псалом 4. Вечнозаветная псалтирь на святорусском языке Социально-демографический портрет студента Школы педагогики ДВФУ
Социально-демографический портрет студента Школы педагогики ДВФУ Портфолио
Портфолио Порядок прохождения тестовых испытаний
Порядок прохождения тестовых испытаний ИТОГИ 2006 ГОДА.ГОД ЛИКВИДАЦИИ
ИТОГИ 2006 ГОДА.ГОД ЛИКВИДАЦИИ Мир начинается с мамы
Мир начинается с мамы Тария и Тёрн. Роды Норта
Тария и Тёрн. Роды Норта От Золотого слова Святослава к политике ХХ I века
От Золотого слова Святослава к политике ХХ I века