Слайд 2Лекция 9 Слайд 2
При взаимодействии электронов пучка с электронами атомов твердого тела, переданная
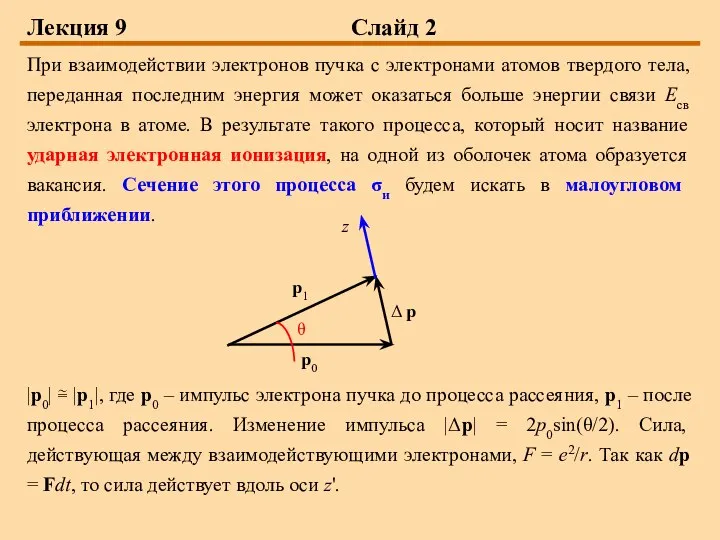
последним энергия может оказаться больше энергии связи Есв электрона в атоме. В результате такого процесса, который носит название ударная электронная ионизация, на одной из оболочек атома образуется вакансия. Сечение этого процесса σи будем искать в малоугловом приближении.
|р0| ≅ |р1|, где р0 – импульс электрона пучка до процесса рассеяния, р1 – после процесса рассеяния. Изменение импульса |Δр| = 2р0sin(θ/2). Сила, действующая между взаимодействующими электронами, F = e2/r. Так как dp = Fdt, то сила действует вдоль оси z'.
Слайд 3Лекция 9 Слайд 3
При переходе в с.ц.м. и рассмотрении рассеяния частицы приведенной массы
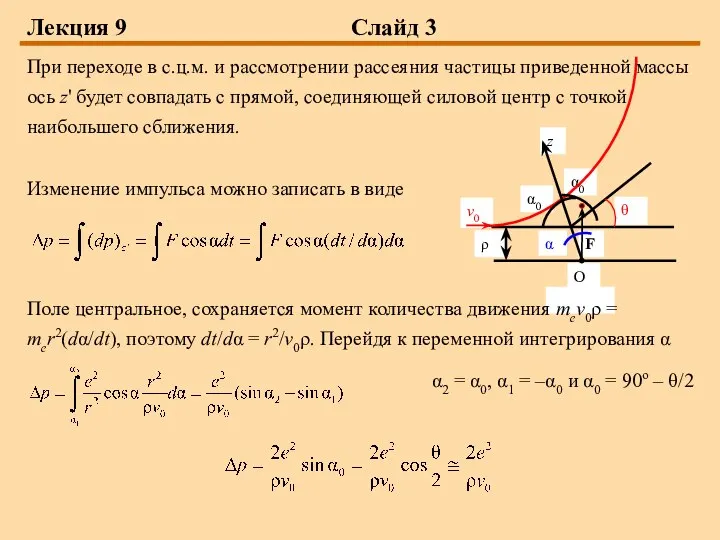
ось z' будет совпадать с прямой, соединяющей силовой центр с точкой наибольшего сближения.
Изменение импульса можно записать в виде
Поле центральное, сохраняется момент количества движения mev0ρ = mer2(dα/dt), поэтому dt/dα = r2/v0ρ. Перейдя к переменной интегрирования α
α2 = α0, α1 = –α0 и α0 = 90о – θ/2
Слайд 4Лекция 9 Слайд 4
Энергия, переданная атомному электрону
Е0 – энергия электрона пучка перед

процессом взаимодействия с атомным электроном.
Следовательно ρ2 = (е4/Е0)/Т 2ρdρ = –(е4/Е0)(dТ/Т2).
Дифференциальное сечение ударной электронной ионизации
Чтобы получить σи необходимо проинтегрировать по всем возможным переданным энергиям от Tmin = Eсв до Tmax = E0.
Слайд 5Лекция 9 Слайд 5
Если E0 >> Eсв, то σи = πе4/E0Eсв = πе4/(Eсв)2х,
где х = E0/Eсв.
При х ≤ 1 процесс ударной электронной ионизации невозможен и, следовательно, σи = 0.
С другой стороны при больших х величина σи ~ 1/х, следовательно, σи(х) должно иметь максимум.
Более детальный расчет показывает, что сечение ударной электронной ионизации имеет максимум при E0 = (3-4) Eсв
Слайд 6Лекция 9 Слайд 6
Для описания состояния отдельного электрона в атоме необходимо задать четыре

квантовых числа:
главное квантовое число n = 1, 2, 3, …7 – определяет основное значение энергии электрона в атоме, которое в первом приближении есть –13,6Z 2/n2 эВ;
орбитальное квантовое число l при заданном n может принимать значения 0, 1, 2, …, n – 1, определяет угловой орбитальный момент электрона;
квантовое число углового момента j при заданном l может принимать значения ⏐l ± 1⏐, характеризует полный угловой момент электрона, складывающийся из орбитального углового момента и спина;
магнитное квантовое число mj при заданном j может принимать все полуцелые значения от - j до + j , определяет проекцию полного углового момента электрона на заданное направление.
Слайд 7Лекция 9 Слайд 7
Электроны, занимающие в атоме энергетические уровни с одинаковым главным квантовым

числом n, образуют оболочку. Максимальное число электронов в оболочке 2n2, так как в соответствии с принципом Паули в каждом состоянии может находиться один электрон. Электронные оболочки с различными значениями n обозначают заглавными латинскими буквами следующим образом:
Состояния с различными значениями l имеют следующие спектроскопические обозначения:
Число состояний с одинаковыми n, l и j равно 2j + 1.
Совокупность электронов с такими квантовыми числами - подоболочка, на которой может быть до 2j +1 электронов, различающихся значениями mj.
Слайд 8Лекция 9 Слайд 8
Существует два способа обозначения энергетических уровней в атоме: спектроскопическое и
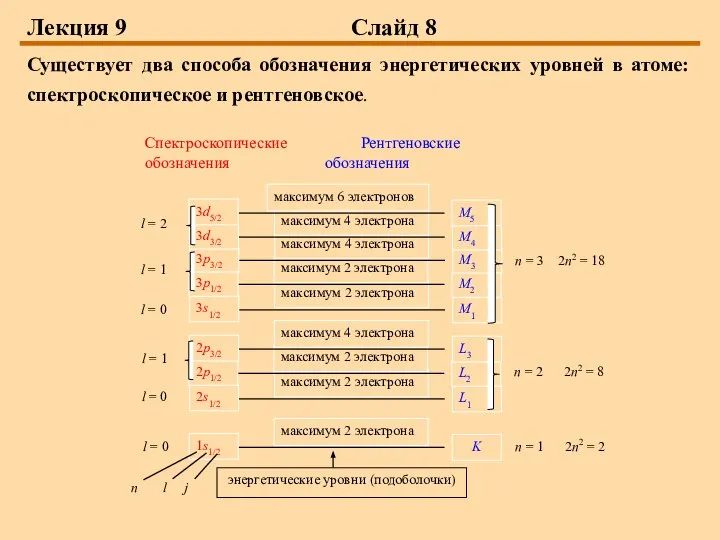
рентгеновское.
Слайд 9Лекция 9 Слайд 9
Оже-процесс
испущенный атомом электрон – Оже-электрон
Данный переход обозначается KL1L1
на первом месте
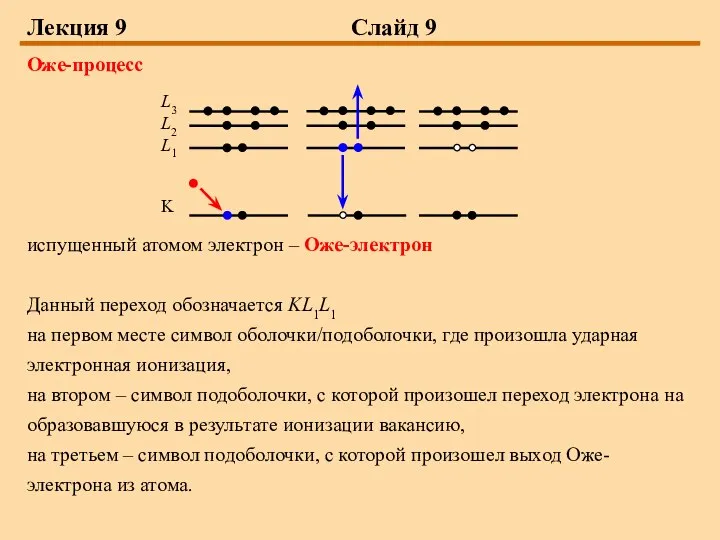
символ оболочки/подоболочки, где произошла ударная электронная ионизация,
на втором – символ подоболочки, с которой произошел переход электрона на образовавшуюся в результате ионизации вакансию,
на третьем – символ подоболочки, с которой произошел выход Оже-электрона из атома.
Слайд 10Лекция 9 Слайд 10
Полное обозначение Оже-перехода включает также конечное состояние атома в

спектроскопических обозначениях. Рассмотренный переход оставляет пустой оболочку 2s и полностью заполненными оболочки 2р, поэтому полное обозначение данного перехода KL1L1 (2s02р6).
При ионизации К-оболочки возможны также переходы KL1L2,3 с конечным состоянием (2s12р5), KL2L2,3 и KL3L3с конечным состоянием (2s22р4), т.е. всего 6 переходов. Наибольшую интенсивность имеет переход KL2L3.
Если ударная электронная ионизация произошла на L-оболочке, то вакансию заполняет электрон с М-оболочки, а другому электрону М-оболочки передается избыток энергии и он выходит из атома. Обозначения подобных переходов LММ.
Слайд 11Лекция 9 Слайд 11
Переходы Костера-Кронига
Если в конечном состоянии одна из вакансий находится
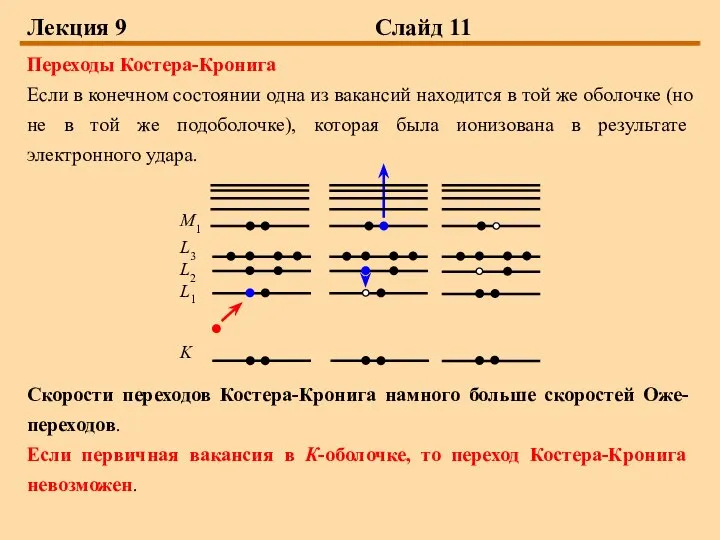
в той же оболочке (но не в той же подоболочке), которая была ионизована в результате электронного удара.
Скорости переходов Костера-Кронига намного больше скоростей Оже-переходов.
Если первичная вакансия в К-оболочке, то переход Костера-Кронига невозможен.
Слайд 12Лекция 9 Слайд 12
Энергия Оже-электрона в первом приближении может быть вычислена исходя

из энергий связи электронов, участвующих в Оже-процессе. В частности, для перехода KL2L3
Это выражение не учитывает наличие вакансий, которое немного изменяет энергии связи. Точные значения ЕА приведены в справочниках.
Так как энергии связи разные для разных элементов, то, определив энергию Оже-электрона, можно сказать, каким элементом испущен данный электрон. На этом основан метод Оже-электронной спектроскопии, который будет подробно рассмотрен в следующем семестре.
Слайд 13Лекция 9 Слайд 13
При образовании первичной вакансии за счет ионизации электронным ударом
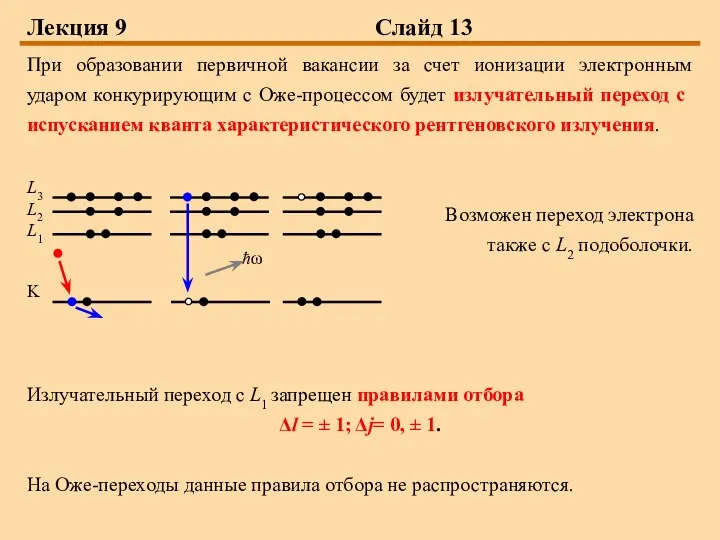
конкурирующим с Оже-процессом будет излучательный переход с испусканием кванта характеристического рентгеновского излучения.
Возможен переход электрона
также с L2 подоболочки.
Излучательный переход с L1 запрещен правилами отбора
Δl = ± 1; Δj= 0, ± 1.
На Оже-переходы данные правила отбора не распространяются.
Слайд 14Лекция 9 Слайд 14
Схема излучательного перехода при заполнении вакансии с подоболочки L3
Энергия
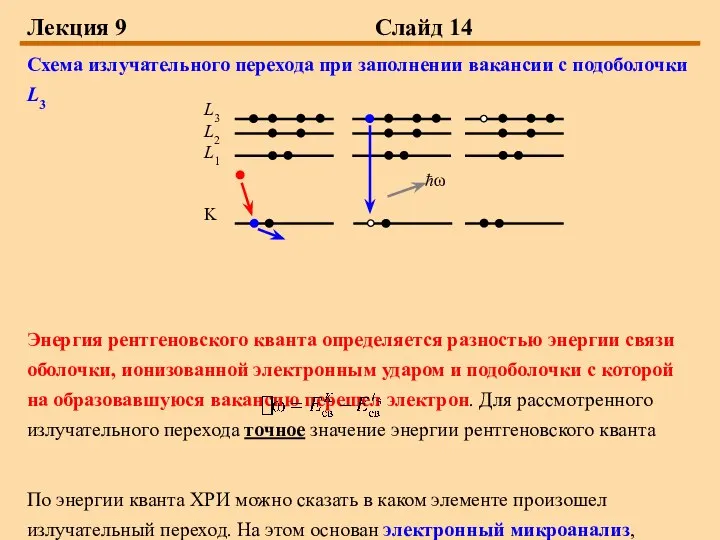
рентгеновского кванта определяется разностью энергии связи оболочки, ионизованной электронным ударом и подоболочки с которой на образовавшуюся вакансию перешел электрон. Для рассмотренного излучательного перехода точное значение энергии рентгеновского кванта
По энергии кванта ХРИ можно сказать в каком элементе произошел излучательный переход. На этом основан электронный микроанализ, который будет подробно рассмотрен в следующем семестре.
Слайд 15Лекция 9 Слайд 15
Система обозначений для излучательных переходов (линии ХРИ)
Наиболее интенсивные линии
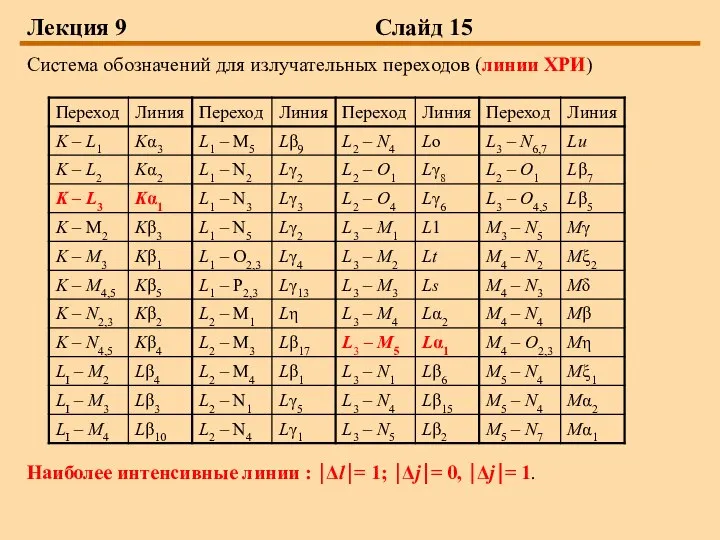
: ⏐Δl⏐= 1; ⏐Δj⏐= 0, ⏐Δj⏐= 1.














 несанкционированный митинг: все об ответственности за организацию и участие
несанкционированный митинг: все об ответственности за организацию и участие Гражданские правоотношения. Конституция РФ
Гражданские правоотношения. Конституция РФ Операционная система MS-DOS
Операционная система MS-DOS Борис Андреевич Ярков
Борис Андреевич Ярков Презентация на тему Внутренняя политика Ивана Грозного. Последние годы правления.
Презентация на тему Внутренняя политика Ивана Грозного. Последние годы правления.  Исследование функции по графику
Исследование функции по графику Цветные металлы и сплавы
Цветные металлы и сплавы  Всемирный день моря
Всемирный день моря Моя малая Родина – Горная Шория
Моя малая Родина – Горная Шория Как риэлтору зарабатывать от 300 тысяч в месяц? Обучающий курс
Как риэлтору зарабатывать от 300 тысяч в месяц? Обучающий курс Современные технологии в строительстве
Современные технологии в строительстве ПРОЕКТ по теме: «The variety of sport games in Great Britain and Russia» «Разнообразие спортивных игр в Великобритании и России»
ПРОЕКТ по теме: «The variety of sport games in Great Britain and Russia» «Разнообразие спортивных игр в Великобритании и России» Мегаполис. Ценности компании
Мегаполис. Ценности компании Нелинейная корреляционная зависимость
Нелинейная корреляционная зависимость Братья Гримм. Жизнь и творчество
Братья Гримм. Жизнь и творчество Магнитное поле тока. Магнитные линии
Магнитное поле тока. Магнитные линии Презентация на тему Путешествие в мир химии
Презентация на тему Путешествие в мир химии а=и Ал гора тм
а=и Ал гора тм История средств обмена информацией
История средств обмена информацией Природа Африки
Природа Африки Buy-to-let in Russia Moscow
Buy-to-let in Russia Moscow Креативные фокус-группы
Креативные фокус-группы А.С. Пушкин и Защитники Отечества 1812 г.
А.С. Пушкин и Защитники Отечества 1812 г. Формирование ключевых компетенций через проектную и исследовательскую деятельность учащихся
Формирование ключевых компетенций через проектную и исследовательскую деятельность учащихся Презентация на тему «Золотые ворота» в Древнюю Русь (3 класс)
Презентация на тему «Золотые ворота» в Древнюю Русь (3 класс) Сегодня, по данным международных организаций, Россия входит в группу стран с наиболее развитой коррупцией. В борьбе с этим злом нео
Сегодня, по данным международных организаций, Россия входит в группу стран с наиболее развитой коррупцией. В борьбе с этим злом нео Что есть красота?
Что есть красота? Тема войны и мира в искусстве
Тема войны и мира в искусстве