Содержание
- 2. Сера и ее соединения Цель работы: Изучение физических и химических свойства серы и ее соединений. Выявление
- 3. Сера и ее соединения Самородная сера известна человеку с древнейших времен. Считалось, что голубое пламя и
- 4. Сера - биогенный элемент. 0,3-1,2 %, 0,5-2 % 1402 г
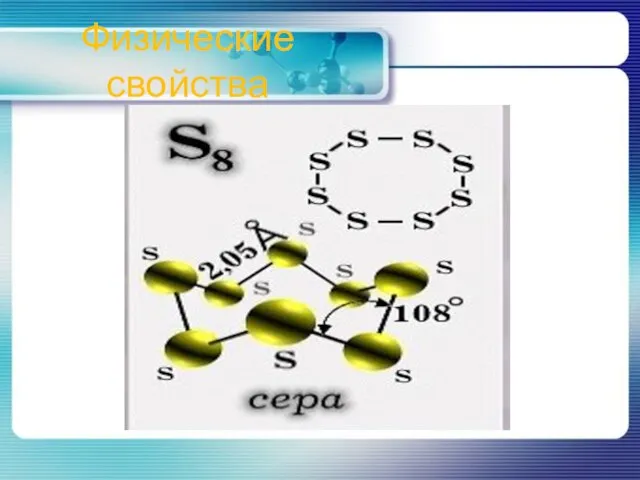
- 5. Физические свойства
- 6. Химические свойства S + O2= SO2
- 7. Химические свойства со фтором, S + 3F2 = SF6 Расплав серы реагирует с хлором, 2S +
- 8. Химические свойства При нагревании сера взаимодействует со многими металлами, 2Na + S = Na2S С концентрированными
- 9. Сероводород Газ бесцветный запах тухлых яиц ядовит хорошо растворим в воде (сероводородная кислота) FeS + 2HCl=
- 10. Диоксид серы 4 Fe S2 + 11 O2 = 2 Fe2 O3 + 8 S O2
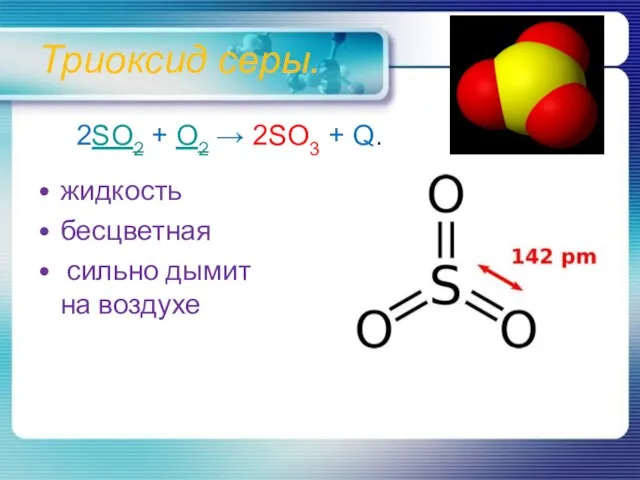
- 11. Триоксид серы. жидкость бесцветная сильно дымит на воздухе 2SO2 + O2 → 2SO3 + Q.
- 12. Серная кислота H2O+SO3 =>H2SO4 Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn,
- 13. Взаимодействие серной кислоты с металлами
- 14. Серная кислота-окислитель Концентрированная серная кислота ,особенно горячая ,- энергичный окислитель 8HJ + H2 SO4 = 4
- 15. Сера и окружающая среда. 96% серы в виде SО2
- 16. Кислотные дожди.
- 17. Кислотные дожди. Кислотные осадки разрушают сооружения из мрамора и известняка. Исторические памятники Греции и Рима, простояв
- 18. Сероводород в атмосфере. 4-16 млн. т соединений серы Сероводород
- 19. Зачем нужна сера ?
- 20. 88 из 150
- 22. Скачать презентацию
















 Итоговая и промежуточная аттестация выпускников учреждений НПО
Итоговая и промежуточная аттестация выпускников учреждений НПО Автоматизированная система релейной защиты и автоматики фидеров КС-3,3 кВ ОАО РЖД
Автоматизированная система релейной защиты и автоматики фидеров КС-3,3 кВ ОАО РЖД Fact and opinion
Fact and opinion Парусник «Надежда»
Парусник «Надежда» Презентация на тему Нахождение наибольшего и наименьшего значения функции
Презентация на тему Нахождение наибольшего и наименьшего значения функции  Халява.NET: бизнес по-русски
Халява.NET: бизнес по-русски Новость как базовая модель журналистского текста
Новость как базовая модель журналистского текста  Теоретические подходы к изучению международных отношений
Теоретические подходы к изучению международных отношений  Ресторанный комплекс Фрегат Благодать
Ресторанный комплекс Фрегат Благодать Оборудование ОРУ
Оборудование ОРУ Презентация на тему Степени сравнения наречий
Презентация на тему Степени сравнения наречий Определение центра тяжести
Определение центра тяжести Проблема наркомании
Проблема наркомании Презентация для программы «Учебное пособие по Turbo Pascal 7.0»
Презентация для программы «Учебное пособие по Turbo Pascal 7.0» Италия
Италия Плакатное искусство в годы Великой Отечесвенной войны
Плакатное искусство в годы Великой Отечесвенной войны Integrated Social Communication Platform Новое слово в интернет-коммуникациях
Integrated Social Communication Platform Новое слово в интернет-коммуникациях Проектно-ознакомительный урок в 3 «Б» классе по теме: «Мой лучший друг: кошка или собака» Учитель: Лучкина А.В.
Проектно-ознакомительный урок в 3 «Б» классе по теме: «Мой лучший друг: кошка или собака» Учитель: Лучкина А.В. Институты развития: преодолевая «узкие места» IX Красноярский экономический форум
Институты развития: преодолевая «узкие места» IX Красноярский экономический форум Accounts Receivable Management
Accounts Receivable Management  Правила выживания в химической лаборатории
Правила выживания в химической лаборатории Участок слайсера
Участок слайсера Черты темной триады и личностный рост
Черты темной триады и личностный рост «Функции и графики»
«Функции и графики» Relations between Russia and Ukraine
Relations between Russia and Ukraine Экосистема. Структура экосистемы
Экосистема. Структура экосистемы Радио онлайн
Радио онлайн Lake Wilson & Nash Street
Lake Wilson & Nash Street