Содержание
- 2. Состав Кислоты - это сложные вещества, в молекулах которых содержат атомы водорода и кислотный остаток H-R,
- 3. Классификация кислот Одноосновные кислоты, например, HCl, HNO3 (отщепляют при диссоциации один атом водорода) Многоосновные кислоты, например,
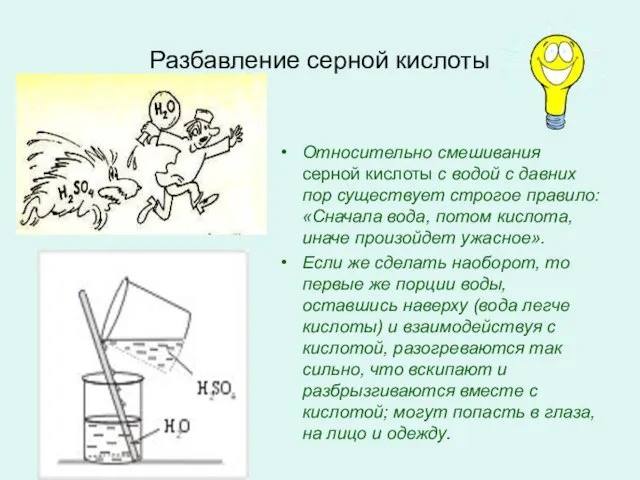
- 4. Разбавление серной кислоты Относительно смешивания серной кислоты с водой с давних пор существует строгое правило: «Сначала
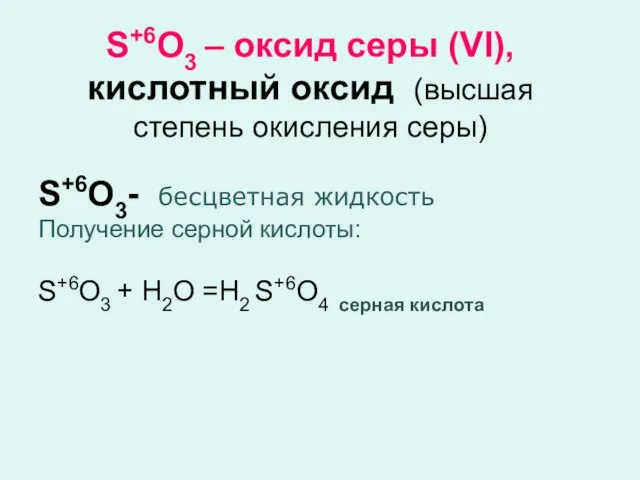
- 5. S+6O3 – оксид серы (VI), кислотный оксид (высшая степень окисления серы) S+6O3- бесцветная жидкость Получение серной
- 6. Химические свойства серной кислоты разбавленная серная кислота проявляет все характерные свойства кислот: С оксидами металлов.(реакция обмена)
- 7. Качественная реакция на ион –SO42- Реактивом на серную кислоту и ее соли является катион бария ,
- 8. Концентрированная серная кислота Ме+Н2SO4(кoнц)→МеSO4+H2O+(Н2S,S,SO2) Серная кислота(конц) восстанавливается до (Н2S,S,SO2) в зависимости от активности металла и условий
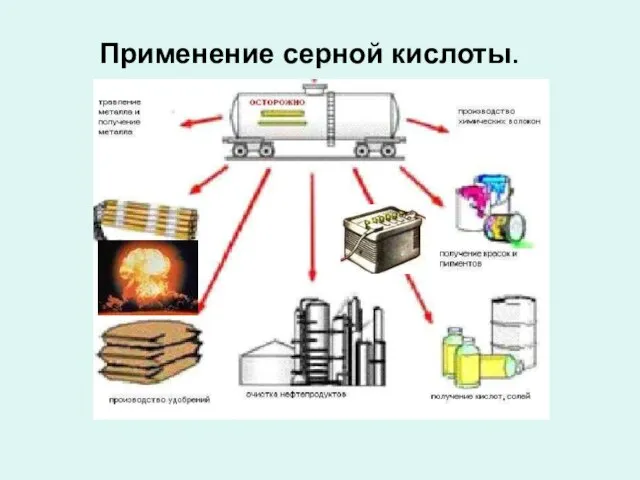
- 9. Применение серной кислоты.
- 10. Сульфат натрия.
- 11. Сульфат никеля
- 12. Сульфат меди дать классификацию химическим реакциям.
- 14. Скачать презентацию








 Talk for a minute
Talk for a minute Литературная игра для младших школьников по произведениям Н.Н.Носова «Затейники и фантазёры»
Литературная игра для младших школьников по произведениям Н.Н.Носова «Затейники и фантазёры» L`italiano è facile
L`italiano è facile Коммуникации. Техника 3-х касаний
Коммуникации. Техника 3-х касаний Муниципальное образовательное учреждение "Ковылкинская средняя общеобразовательная школа № 1"
Муниципальное образовательное учреждение "Ковылкинская средняя общеобразовательная школа № 1" Грант 2013г
Грант 2013г Тема урока: «Бунташный век».
Тема урока: «Бунташный век». History & Mystery of the English language
History & Mystery of the English language Внутренняя среда организма. Кровеносная система
Внутренняя среда организма. Кровеносная система Современные средства поражений
Современные средства поражений ПЕРСПЕКТИВНАЯ НАЧАЛЬНАЯШКОЛА
ПЕРСПЕКТИВНАЯ НАЧАЛЬНАЯШКОЛА lecture_1
lecture_1 Тукай начал изучать русский язык
Тукай начал изучать русский язык История праздника Новый Год
История праздника Новый Год Проект: видеоблог
Проект: видеоблог Расчет теплоусвоения внутренней поверхности полов
Расчет теплоусвоения внутренней поверхности полов ЭФФЕКТ КАЗИМИРА: ОТ НАНОТЕХНОЛОГИЙ ДО ФИЗИКИ ВСЕЛЕННОЙ
ЭФФЕКТ КАЗИМИРА: ОТ НАНОТЕХНОЛОГИЙ ДО ФИЗИКИ ВСЕЛЕННОЙ Цифровые права
Цифровые права Сетевой маркетинг
Сетевой маркетинг культура и достопримечательности Греции
культура и достопримечательности Греции Мектеп бітірушілердің психологиялық-физиологиялық жағдайын ескере отырып қобалжу деңгейін төмендету
Мектеп бітірушілердің психологиялық-физиологиялық жағдайын ескере отырып қобалжу деңгейін төмендету Решение текстовых задач. Закрепление пройденного
Решение текстовых задач. Закрепление пройденного Традиционная реклама
Традиционная реклама Saint Patricks day
Saint Patricks day КОМПЬЮТЕРНАЯ ДОЛИНА
КОМПЬЮТЕРНАЯ ДОЛИНА Литературная игра по творчеству А.С. Пушкина
Литературная игра по творчеству А.С. Пушкина Презентация на тему Семейство Губоцветные
Презентация на тему Семейство Губоцветные ФИЗИЧЕСКАЯ КУЛЬТУРА
ФИЗИЧЕСКАЯ КУЛЬТУРА