Содержание
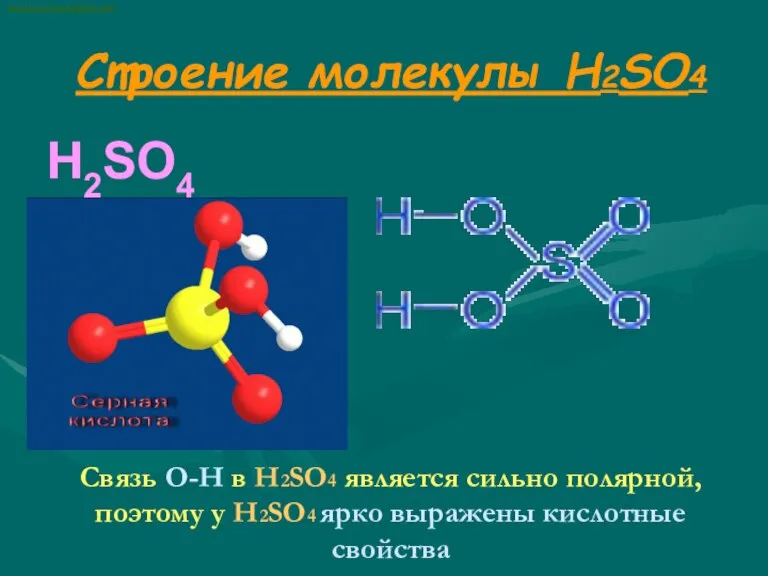
- 2. Строение молекулы H2SO4 H2SO4 Связь О-Н в H2SO4 является сильно полярной, поэтому у H2SO4 ярко выражены
- 3. Производство серной кислоты 1-я стадия. Печь для обжига колчедана. 4FeS2 + 11O2 => 2Fe2O3 + 8SO2
- 4. Физические свойства Тяжелая маслянистая жидкость ("купоросное масло"); p = 1,84 г/см3; Нелетучая, хорошо растворима в воде
- 5. Химические свойства H2SO4 - сильная двухосновная кислота H2SO4 ⬄ H+ + HSO4- ⬄2H+ + SO42- 1)
- 6. 3) с основаниями: H2SO4 + 2NaOH => Na2SO4 + 2H2O H+ + OH- => H2O H2SO4
- 7. ВАСИЛИЙ КАДЕВИЧ 2008 5) концентрированная H2+6SO4 – сильный окислитель; при взаимодействии с металлами (кроме Au, Pt)
- 8. 6) концентрированная H2S+6O4 реагирует при нагревании с некоторыми неметаллами за счет своих сильных окислительных свойств, превращаясь
- 9. 6) Гигроскопичность серной кислоты Концентрированная серная кислота жадно набирает воду отовсюду, образуя гидраты, и способна для
- 10. Концентрированная серная кислота энергично обугливает сахарозу
- 12. Помните! При приготовлении раствора кислоту вливать малыми порциями в воду, а не наоборот!
- 13. В природе встречается 180 минералов сульфатов, и на их долю приходится ~0,5 % массы земной коры.
- 14. Серная кислота в природе Кислые озёра
- 15. Существуют предположения, что кислотное озеро возникло сравнительно недавно в результате извержения, произошедшего незаметно для людей. Тот,
- 16. Серная кислота – очень активная жидкость, особенно концентрированная, которая реагирует со многими неорганическими веществами, также она
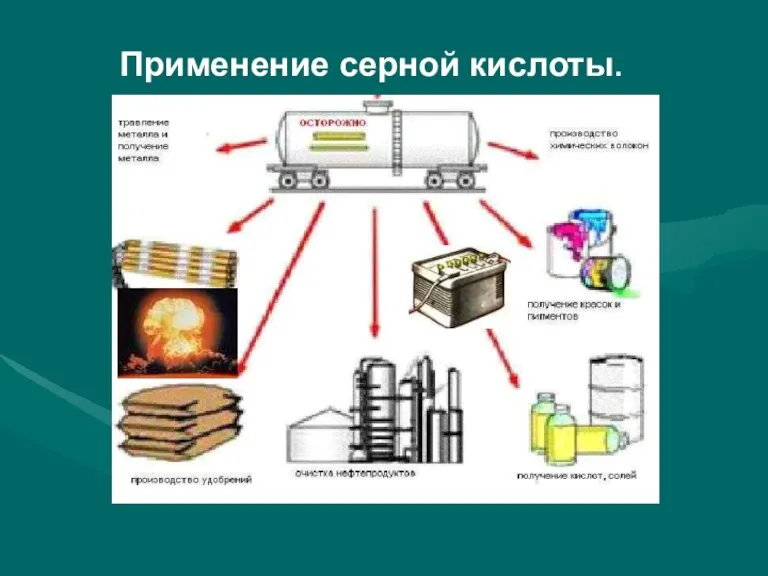
- 17. ВАСИЛИЙ КАДЕВИЧ 2008 Применение H2SO4 В производстве пластмассы В производстве синтетического волокна В средствах защиты растений
- 18. Применение серной кислоты.
- 19. Сульфат меди
- 20. Сульфат натрия.
- 21. Сульфат натрия.
- 22. СОЛИ СЕРНОЙ КИСЛОТЫ CaSO4• 2H2O - гипс CaSO4• 0,5H2O - алебастр CuSO4• 5H2O – медный купорос
- 23. Домашнее задание Составьте инструкцию по правилам обращения с серной кислотой • для лаборанта кабинета химии; •
- 24. Лабораторный опыт № 7 Исследование химических свойств раствора серной кислоты ВНИМАНИЕ ! При работе с кислотой
- 25. В пробирках в виде растворов представлены вещества: NaCl, NaBr, NaI, NaF, H2SO4, Na2CO3, Na2SO4, NaOH Предложите
- 26. Если эти утверждения верны на Ваш взгляд, то напротив них поставьте знак «+», а если нет,
- 28. Скачать презентацию























 Опасные места
Опасные места 20140317_merzlikinaip_doc
20140317_merzlikinaip_doc ВИЧ и СПИД
ВИЧ и СПИД Анатомия
Анатомия Электронный документооборот как инструмент борьбы с бюрократией
Электронный документооборот как инструмент борьбы с бюрократией Винсент Виллем ван Гог
Винсент Виллем ван Гог Как выполнить выгрузкуотчетности в электронном виде из программ системы 1С:Предприятие
Как выполнить выгрузкуотчетности в электронном виде из программ системы 1С:Предприятие Преобразования фигур в пространстве
Преобразования фигур в пространстве Предельные одноосновные карбоновые кислоты. Сложные эфиры
Предельные одноосновные карбоновые кислоты. Сложные эфиры Дизайн. Коллаборация. Цифровые технологии. Кейс №3 Перерождение одного изделия в другое
Дизайн. Коллаборация. Цифровые технологии. Кейс №3 Перерождение одного изделия в другое Презентация на тему ДЕЙСТВИЕ ТАБАКА НА ОРГАНИЗМ ЧЕЛОВЕКА
Презентация на тему ДЕЙСТВИЕ ТАБАКА НА ОРГАНИЗМ ЧЕЛОВЕКА  Where is the dog?
Where is the dog? . 1)Прочитать числа: 509, 6001, 90050, 7000850127, 620022. Назвать в каждом из чисел цифру в разряде десятков, сотен. Какие из чисел меньше 1000? 2)Найти
. 1)Прочитать числа: 509, 6001, 90050, 7000850127, 620022. Назвать в каждом из чисел цифру в разряде десятков, сотен. Какие из чисел меньше 1000? 2)Найти ООО ГарантСтройХаус
ООО ГарантСтройХаус Пончики Пончкофф (фотографии)
Пончики Пончкофф (фотографии) Определение культуры. Типы культур
Определение культуры. Типы культур Искусства бумагокручения
Искусства бумагокручения Технологический процесс ручной дуговой сварки листовых конструкций из стали (ст-3пс)
Технологический процесс ручной дуговой сварки листовых конструкций из стали (ст-3пс) МЫ СКОРО УЙДЁМ СО ШКОЛЬНОГО ДВОРА…
МЫ СКОРО УЙДЁМ СО ШКОЛЬНОГО ДВОРА… Эффективные приёмы запоминания учебного материала
Эффективные приёмы запоминания учебного материала Административно-правовой статус
Административно-правовой статус Развитие личности младшего школьника средствами учебного диалога
Развитие личности младшего школьника средствами учебного диалога БЭК-ОФИС СОЗДАНИЕ, РАЗВИТИЕ, АВТОМАТИЗАЦИЯ
БЭК-ОФИС СОЗДАНИЕ, РАЗВИТИЕ, АВТОМАТИЗАЦИЯ Внеурочная работа по математике
Внеурочная работа по математике Слайды
Слайды ГОГОЛЬ: знакомый и незнакомый
ГОГОЛЬ: знакомый и незнакомый The Cable News Network
The Cable News Network Сила. Основы методики ее воспитания
Сила. Основы методики ее воспитания