Слайд 2Подготовили: ученики 9 класса А
Гимназии №1
Зорин Сергей
Шакенов Серик
Югай Дмитрий
Огай Артём
С Е

Р О В О Д О Р ОД
Слайд 3Сероводоро́д, сернистый водород (H2S) — бесцветный газ с резким запахом.
Химическая формула H2S
Отн. молек.
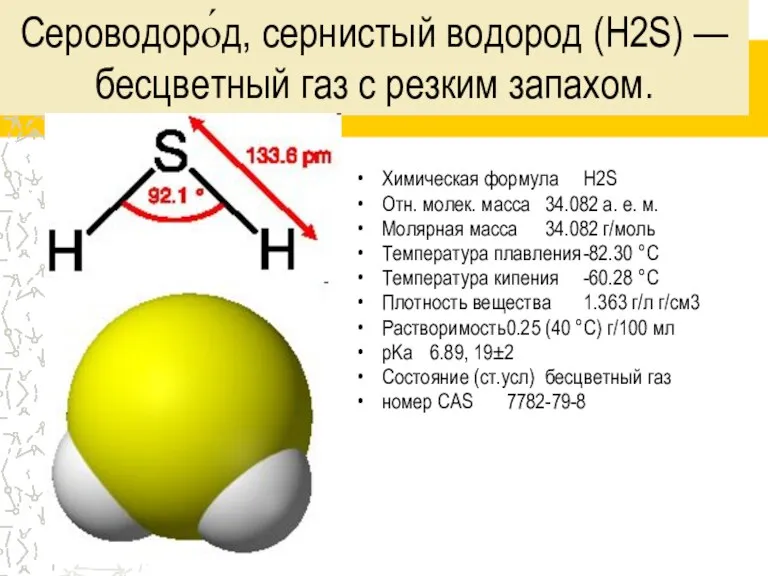
масса 34.082 а. е. м.
Молярная масса 34.082 г/моль
Температура плавления -82.30 °C
Температура кипения -60.28 °C
Плотность вещества 1.363 г/л г/см3
Растворимость 0.25 (40 °C) г/100 мл
pKa 6.89, 19±2
Состояние (ст.усл) бесцветный газ
номер CAS 7782-79-8
Слайд 4Нахождение в природе
Встречается в природе в составе нефти, природного газа, вулканического газа

и в горячих источниках.
Слайд 5Свойства
Термически неустойчив (при температурах больше 400 °C разлагается на простые вещества —

S и H2), ядовитый газ тяжелее воздуха с неприятным запахом тухлых яиц. Молекула сероводорода имеет угловую форму, поэтому она полярна (μ = 0,34·10-29 Кл·м). В отличие от молекул воды, молекулы сероводорода не образуют прочных водородных связей, поэтому H2S — газ. Насыщенный водный раствор H2S является сероводородной кислотой.
Слайд 6Получение
В лаборатории обычно получают действием разбавленных кислот на сульфиды:
FeS + 2HCl =
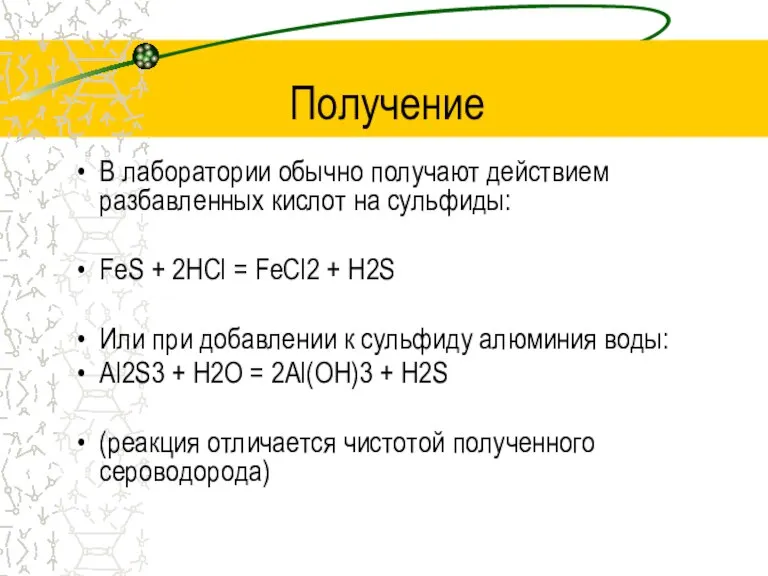
FeCl2 + H2S
Или при добавлении к сульфиду алюминия воды:
Al2S3 + H2O = 2Al(OH)3 + H2S
(реакция отличается чистотой полученного сероводорода)
Слайд 7Применение
Сероводород из-за своей токсичности находит ограниченное применение.
В аналитической химии сероводород и сероводородная

вода используются как реагент для осаждения тяжёлых металлов, сульфиды которых очень слабо растворимы
В медицине — в составе сероводородных ванн
Сероводород применяют для получения серной кислоты, элементной серы, сульфидов
Используют в органическом синтезе для получения тиофена и меркаптанов
В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического и химического сырья.






 MadameTussaud’s Музей Восковых фигур Мадам Тюссо
MadameTussaud’s Музей Восковых фигур Мадам Тюссо Место учебного исследования в программе Intel «Обучение для будущего»
Место учебного исследования в программе Intel «Обучение для будущего» Потребительские кредиты
Потребительские кредиты Организация пастбищного содержания животных
Организация пастбищного содержания животных А
А Структура ВС РФ
Структура ВС РФ Северная Америка
Северная Америка «Как продолжается детство»
«Как продолжается детство» Молодые менеджеры и предприниматели Кубани
Молодые менеджеры и предприниматели Кубани Презентация на тему Углекислый газ СО2
Презентация на тему Углекислый газ СО2  Солнце воздух и вода – наши лучшие друзья
Солнце воздух и вода – наши лучшие друзья Лапта. История развития
Лапта. История развития Что такое система LanDrive ? LanDrive – это универсальная система управления по витой паре. Предназначена для автоматического и централиз
Что такое система LanDrive ? LanDrive – это универсальная система управления по витой паре. Предназначена для автоматического и централиз Презентация на тему Экологические кризисы и экологические катастрофы
Презентация на тему Экологические кризисы и экологические катастрофы История Громова Процессы на постсоветском пространстве
История Громова Процессы на постсоветском пространстве Шамшур
Шамшур Приобщение дошкольников к народной культуре в разных видах музыкальной деятельности»
Приобщение дошкольников к народной культуре в разных видах музыкальной деятельности» Тема урока
Тема урока Понятие о причастном обороте. Знаки препинания в предложениях с причастными оборотами. 6 класс
Понятие о причастном обороте. Знаки препинания в предложениях с причастными оборотами. 6 класс Презентация на тему Свет и его законы
Презентация на тему Свет и его законы  Презентация "Николай I и его портреты в изобразительном искусстве" - скачать презентации по МХК
Презентация "Николай I и его портреты в изобразительном искусстве" - скачать презентации по МХК Art City. Подбор квартиры
Art City. Подбор квартиры Фалсафа - 5
Фалсафа - 5 врол
врол Бабаево – взгляд с любовью (городской путеводитель)
Бабаево – взгляд с любовью (городской путеводитель) Бесприборные тесты для подтверждения ВИЧ-Инфекции
Бесприборные тесты для подтверждения ВИЧ-Инфекции Техника безопасностииорганизация рабочего места
Техника безопасностииорганизация рабочего места Конспект урока по окружающему миру (история)с использованием информационно-коммуникационных технологий (3 класс, программа 1-4).
Конспект урока по окружающему миру (история)с использованием информационно-коммуникационных технологий (3 класс, программа 1-4).