Содержание
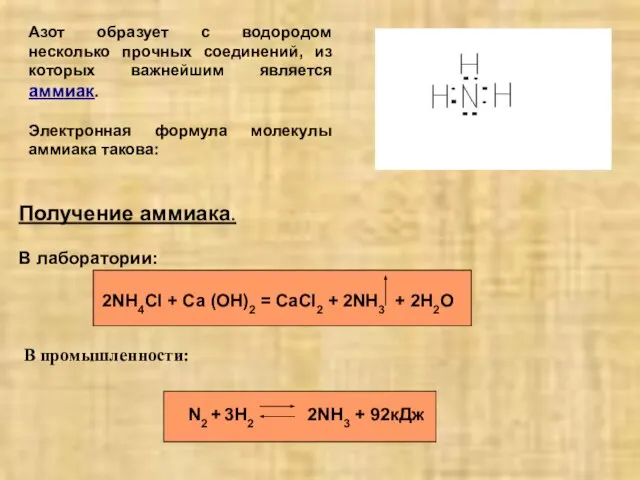
- 2. Азот образует с водородом несколько прочных соединений, из которых важнейшим является аммиак. Электронная формула молекулы аммиака
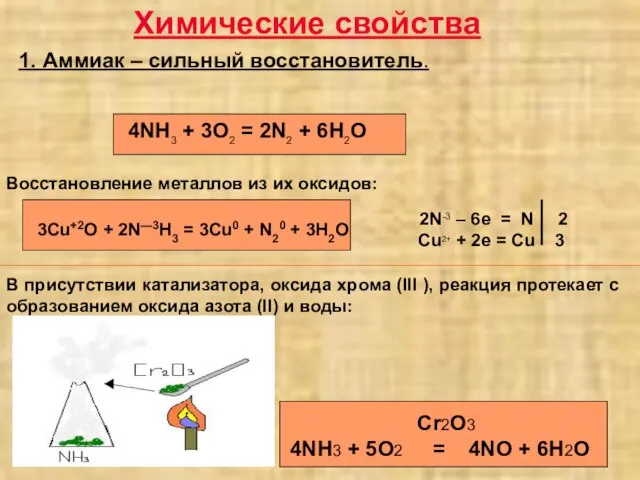
- 3. Химические свойства 1. Аммиак – сильный восстановитель. 3Cu+2O + 2N—3H3 = 3Cu0 + N20 + 3H2O
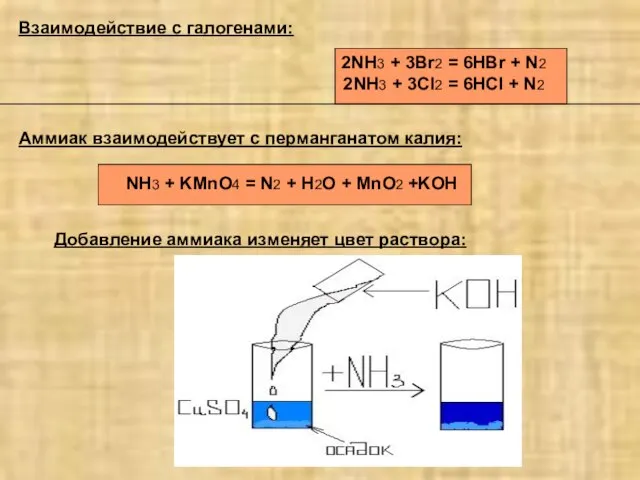
- 4. Аммиак взаимодействует с перманганатом калия: NH3 + KMnO4 = N2 + H2O + MnO2 +KOH Взаимодействие
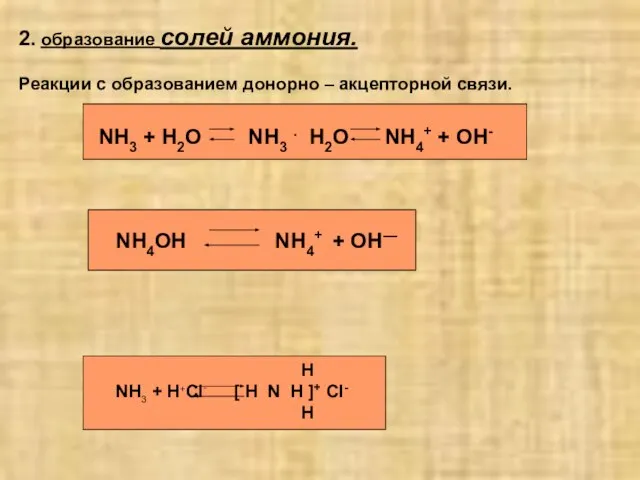
- 5. 2. образование солей аммония. Реакции с образованием донорно – акцепторной связи. NH3 + H2O NH3 .
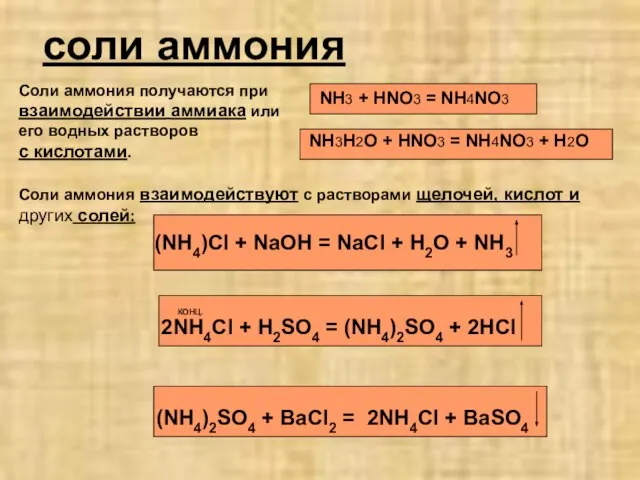
- 6. соли аммония Соли аммония получаются при взаимодействии аммиака или его водных растворов с кислотами. NH3 +
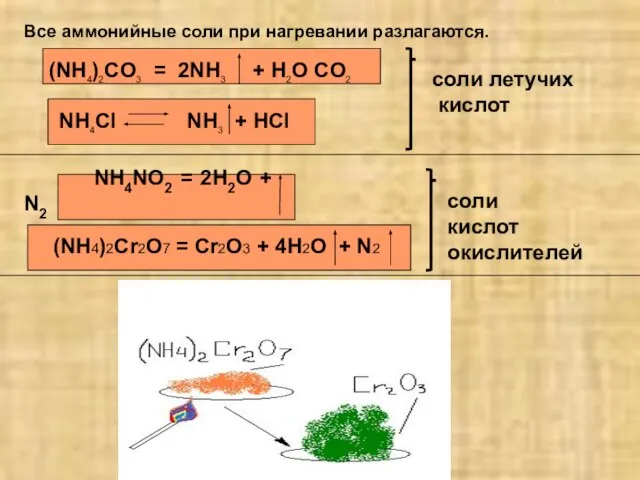
- 7. Все аммонийные соли при нагревании разлагаются. (NH4)2CO3 = 2NH3 + H2O CO2 NH4NO2 = 2H2O +
- 8. Качественная реакция на ион аммония. NH4+ + OH- H2O + NH3 Очень важным свойством солей аммония
- 9. Оксиды азота. Азот образует шесть кислородных соединений. степени окисления +1 N2O +2 NO +3 N2O3 +4
- 10. N2O Получение: NH4NO = N2O +2H2O Химические свойства: 1. разложение при нагревании 2N2+1O = 2N20+O2 2.
- 11. NO +2 Получение: 1. В природе: N2 + O2 = 2NO 2. В промышленности: 4NH3 +
- 12. N2O3 +3 Химические свойства: NO2 + NO N2O3 Получение: ВСЕ свойства кислотных оксидов. кислотный оксид
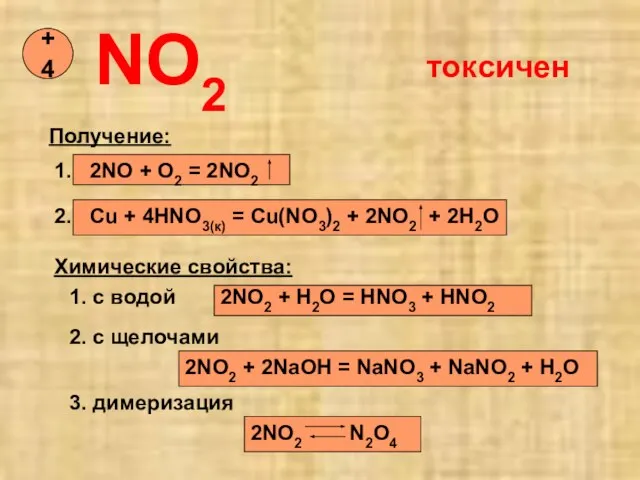
- 13. NO2 +4 Получение: 1. 2NO + O2 = 2NO2 2. Cu + 4HNO3(к) = Cu(NO3)2 +
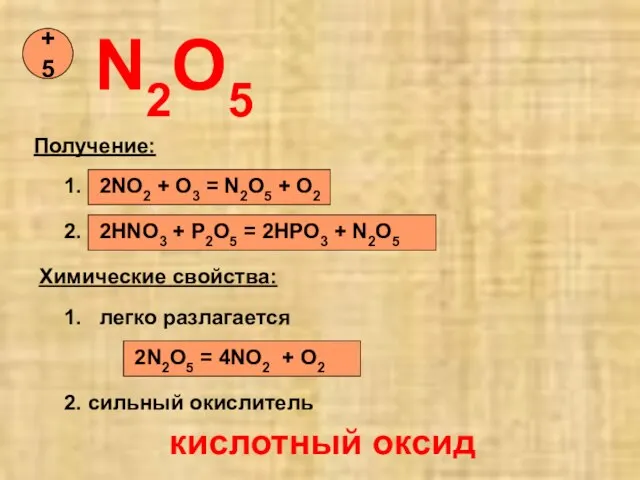
- 14. N2O5 +5 Получение: 1. 2NO2 + O3 = N2O5 + O2 2. 2HNO3 + P2O5 =
- 15. Азотная кислота. Получение азотной кислоты: KNO3 + H2SO4 = HNO3 + KHSO4 В лаборатории, при слабом
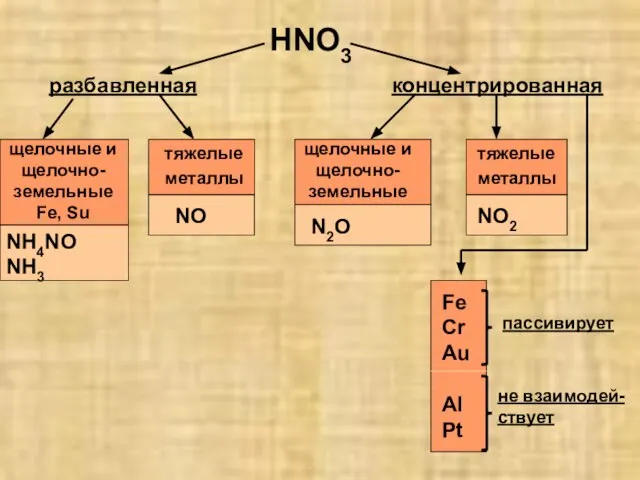
- 16. HNO3 разбавленная концентрированная щелочные и щелочно-земельные Fe, Su тяжелые металлы NH4NO NH3 NO щелочные и щелочно-земельные
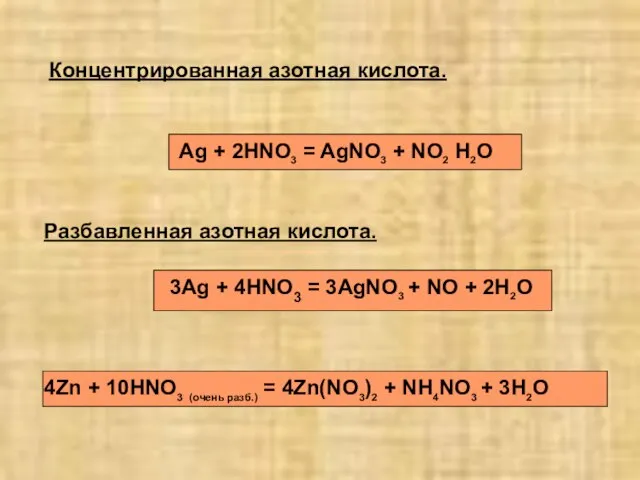
- 17. Разбавленная азотная кислота. Концентрированная азотная кислота. Ag + 2HNO3 = AgNO3 + NO2 H2O 3Ag +
- 18. Азотная кислота взаимодействует со многими неметаллами, окисляя их до соответствующих кислот: 3P + 5HNO3 + H2O
- 19. Нитраты – соли азотной кислоты, получают при действии кислоты на металлы, их оксиды и гидроксиды. Селитры
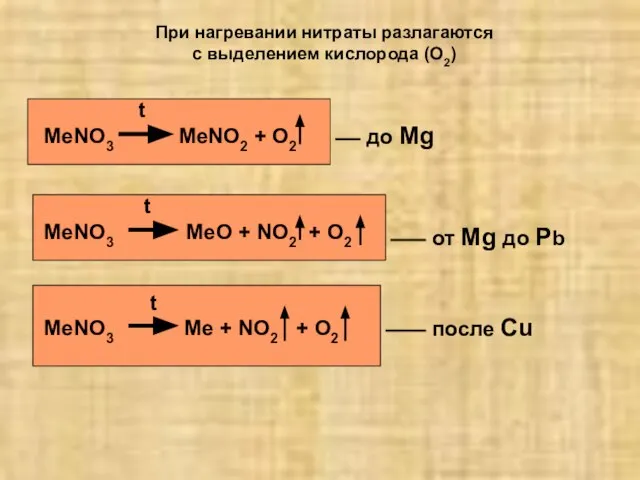
- 20. При нагревании нитраты разлагаются с выделением кислорода (O2) t MeNO3 MeNO2 + O2 t MeNO3 MeO
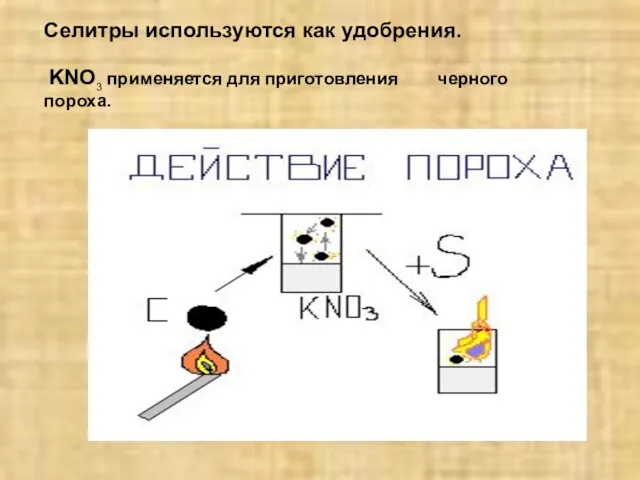
- 21. Селитры используются как удобрения. KNO3 применяется для приготовления черного пороха.
- 22. 1 Аммиак при нормальных условиях – это… 1) бесцветный газ без запаха 2) бурый, остро пахнущий
- 23. II вариант 1 азотная кислота – это сильная кислота, так как она… 1)полностью диссоциирована в водном
- 25. Скачать презентацию










 Истерический стиль и тест Роршаха
Истерический стиль и тест Роршаха Международный день социального бизнеса
Международный день социального бизнеса Кровь и деньги
Кровь и деньги Договор купли-продажи виды содержание ответственность за неисполнение
Договор купли-продажи виды содержание ответственность за неисполнение Малое инвестиционное предприятие Скоробей тек
Малое инвестиционное предприятие Скоробей тек Волкова Н.А. Городецкая роспись. Цветочная полоса
Волкова Н.А. Городецкая роспись. Цветочная полоса Презентация на тему Что такое ноосфера
Презентация на тему Что такое ноосфера Презентация на тему Словообразование
Презентация на тему Словообразование  Организация бизнеса Т6
Организация бизнеса Т6 Урок 16
Урок 16 Электронная рабочая тетрадь по информатике Ученика 8 класса «Б» Беланова Вячеслава Учитель: Казакова Н.С., Кабинет № 307 2-я четверть
Электронная рабочая тетрадь по информатике Ученика 8 класса «Б» Беланова Вячеслава Учитель: Казакова Н.С., Кабинет № 307 2-я четверть Zumba Gold. Танцуя, мы худеем. Заряжаемся позитивом
Zumba Gold. Танцуя, мы худеем. Заряжаемся позитивом Пойди туда – не знаю куда, возьми то – не знаю что…
Пойди туда – не знаю куда, возьми то – не знаю что… Женщина. Тюрьма. Общество
Женщина. Тюрьма. Общество Аффилированный маркетинг. Лекция 21
Аффилированный маркетинг. Лекция 21 2022.10.12 - Стратегия inSales
2022.10.12 - Стратегия inSales Письменная речь, чтение и письмо: психологический анализ
Письменная речь, чтение и письмо: психологический анализ Марина Ивановна Цветаева. Жизнь, творчество, судьба
Марина Ивановна Цветаева. Жизнь, творчество, судьба Универмаг: новая концепция или возрождение старых традиций? Ассортимент, зонирование, управление
Универмаг: новая концепция или возрождение старых традиций? Ассортимент, зонирование, управление musicday-1011-presentation
musicday-1011-presentation 12-ая ежегодная региональная научно-практическая студенческая конференция «Проблемы сертификации управления качеством»
12-ая ежегодная региональная научно-практическая студенческая конференция «Проблемы сертификации управления качеством» Заседание проблемной группы
Заседание проблемной группы Проект-игра Его величество спортивный мяч
Проект-игра Его величество спортивный мяч Экскурсия по Австралии
Экскурсия по Австралии Стиль в искусстве – это мироощущение времени.
Стиль в искусстве – это мироощущение времени. Фестиваль танцев Ural Dance Night 2019
Фестиваль танцев Ural Dance Night 2019 1
1 Тема урока
Тема урока