Содержание
- 2. Окислительно–восстановительные реакции – это реакции протекающие с изменением степеней окисления элементов.
- 3. При составлении уравнений окислительно- восстановительных реакций следует учесть, что число электронов, отданных восстановителем, равно числу электронов,
- 4. Метод электронного баланса
- 5. 1. Составьте химическое уравнение Al + H2SO4 Al2(SO4)3 + H2
- 6. 2. Определите и поставьте степени окисления всех элементов в формулах веществ в левой и правой частях
- 7. 3. Подчеркните знаки элементов, у которых степень окисления изменяется в процессе реакции: Al0 + H2+1S+6O4-2 Al2+3(S+6O4-2)3
- 8. 4. Определите, сколько электронов отдают или присоединяют соответствующие атомы или ионы. Составьте схему электронного баланса Al0
- 9. 5. Составив электронный баланс, мы определим коэффициенты при окислителе и восстановителе. Расставим коэффициенты в уравнении реакции:
- 10. 6. Проверьте, правильно ли расставлены коэффициенты с учетом общей суммы атомов кислорода. 2Al + 3H2SO4 Al2(SO4)3
- 11. Попробуй сам 1 вариант А) Fe2O3 + HCl = FeCl3 + H2O Б) O2 + Na2SO3
- 12. Проверь себя 1 вариант А) Fe2O3 + HCl = FeCl3 + H2O Fe2+3O3-2 + H+1Cl-1 =
- 14. Скачать презентацию











 Основные психологические феномены малой группы
Основные психологические феномены малой группы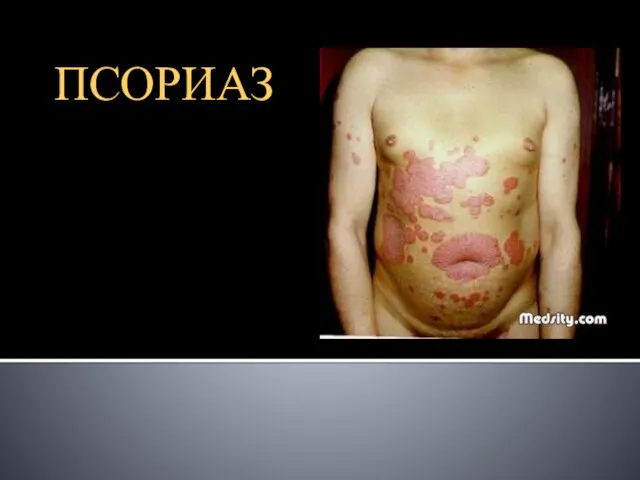 Презентация на тему Псориаз
Презентация на тему Псориаз начало ералаш
начало ералаш Античные образы в музыкальной культуре
Античные образы в музыкальной культуре Моя любимая игра волейбол
Моя любимая игра волейбол Балки составного сечения. Конструкция и расчёт
Балки составного сечения. Конструкция и расчёт Тема работы: "ИДЕНТИФИКАЦИЯ ИНДУКЦИОННОЙ ТИГЕЛЬНОЙ ПЕЧИ КАК ОБЪЕКТА УПРАВЛЕНИЯ С УЧЕТОМ ПЕРЕМЕННОГО УРОВНЯ РАСПЛАВА В ТИГЛЕ" Ра
Тема работы: "ИДЕНТИФИКАЦИЯ ИНДУКЦИОННОЙ ТИГЕЛЬНОЙ ПЕЧИ КАК ОБЪЕКТА УПРАВЛЕНИЯ С УЧЕТОМ ПЕРЕМЕННОГО УРОВНЯ РАСПЛАВА В ТИГЛЕ" Ра Апокалипсис – 2012 и новая энергетическая цивилизация
Апокалипсис – 2012 и новая энергетическая цивилизация Прежде чем приступать к разработке приложений средствами APEX, необходимо подготовить и настроить пространство для работы.
Прежде чем приступать к разработке приложений средствами APEX, необходимо подготовить и настроить пространство для работы. РУССКИЙ ЯЗЫК
РУССКИЙ ЯЗЫК Презентация на тему НАЛОГИ (шпаргалка)
Презентация на тему НАЛОГИ (шпаргалка) Основные сценарии использования мобильных платформ для работы с системами электронного документооборота: проблемы и поиск пут
Основные сценарии использования мобильных платформ для работы с системами электронного документооборота: проблемы и поиск пут Урок-игра в 8-Б классе Разработка Олейник И.Г.
Урок-игра в 8-Б классе Разработка Олейник И.Г. Проект “ПИРС”Педагогические Инновации – Реальная Стратегия
Проект “ПИРС”Педагогические Инновации – Реальная Стратегия Отряд Подёнки
Отряд Подёнки КВН
КВН Буквы З и С в приставках
Буквы З и С в приставках Метод проектов на уроке математики
Метод проектов на уроке математики Лидировать,развивая отношения
Лидировать,развивая отношения Сказка С. Маршака «Двенадцать месяцев»
Сказка С. Маршака «Двенадцать месяцев» Материал к педсовету ЕДИНЫЕ ТРЕБОВАНИЯ К ОБУЧАЮЩИМСЯ
Материал к педсовету ЕДИНЫЕ ТРЕБОВАНИЯ К ОБУЧАЮЩИМСЯ ДЕЯТЕЛЬНОСТЬ МЕТОДИЧЕСКОЙ СЛУЖБЫ
ДЕЯТЕЛЬНОСТЬ МЕТОДИЧЕСКОЙ СЛУЖБЫ День защиты детей
День защиты детей ТестМатематика 4 кл
ТестМатематика 4 кл 56 ДА! энергоэффективности
56 ДА! энергоэффективности Проект: Создание корпоративного информационно-образовательного Центра БФ ГОУ ВПО СибГУТИ Научный руководитель: Самсонов В.С., д
Проект: Создание корпоративного информационно-образовательного Центра БФ ГОУ ВПО СибГУТИ Научный руководитель: Самсонов В.С., д How bills become laws
How bills become laws Полупрямая
Полупрямая