Современные аспекты проведения клинических исследований, в которых участвуют пациенты с ВИЧ-инфекцией
Содержание
- 2. Виды исследований в области ВИЧ/СПИДа медицинское (клиническое) терапевтическое исследование медицинское (клиническое) не терапевтическое исследование эпидемиологическое исследование
- 3. Хельсинская декларация В соответствии с Хельсинской декларацией протокол любого биомедицинского исследования должен быть рассмотрен независимым от
- 4. Основные этические принципы Уважение к людям Милосердие Справедливость
- 5. Руководящие принципы этики биомедицинских исследований (1) Исследования на человеке должны основываться на: адекватных лабораторных исследованиях доклинических
- 6. Руководящие принципы этики биомедицинских исследований (2) Информированное согласие исследователь обязан получить до начала исследования письменное подтверждение
- 7. Руководящие принципы этики биомедицинских исследований (3) Ответственность за здоровье испытуемого несёт исследователь Испытуемому должны быть гарантированы
- 8. Руководящие принципы этики биомедицинских исследований (4) Справедливость в распределении трудностей и преимуществ исследования Право участников исследования
- 9. Медицинские клинические исследования в Санкт-Петербурге у пациентов с ВИЧ инфекцией Имеется более чем 10-летний опыт проведения
- 10. Актуальные проблемы (1) Организационные — длительный срок между предварительным этапом и непосредственно набором пациентов часть потенциальных
- 11. В России более длительный процесс получения документального разрешения на проведение исследований, это приводит к более короткому
- 12. Актуальные проблемы (3) Психосоциальные проблемы включение в исследование связано с подписанием целого ряда документов, описывающих права
- 13. Позитивное влияние исследований Увеличение числа исследований и объемов дополнительной документации должно повысить роль локальных этических комитетов
- 15. Скачать презентацию












 Презентация на тему Алгебра и логика высказываний
Презентация на тему Алгебра и логика высказываний Заболевание височно-нижнечелюстного сустава
Заболевание височно-нижнечелюстного сустава  Конфликтный треугольник: семья-ребенок-образовательное учреждение. Детская агрессия
Конфликтный треугольник: семья-ребенок-образовательное учреждение. Детская агрессия кольцово
кольцово Проблемы преемственности начального и основного (общего) образования
Проблемы преемственности начального и основного (общего) образования Проектная деятельность
Проектная деятельность Власть. Структурная и ситуационная власть
Власть. Структурная и ситуационная власть Свечникова В.В. правоведение тема 2 презентация
Свечникова В.В. правоведение тема 2 презентация Майолика. Гутные изделия. Ковка
Майолика. Гутные изделия. Ковка Saint Petersburg state University
Saint Petersburg state University 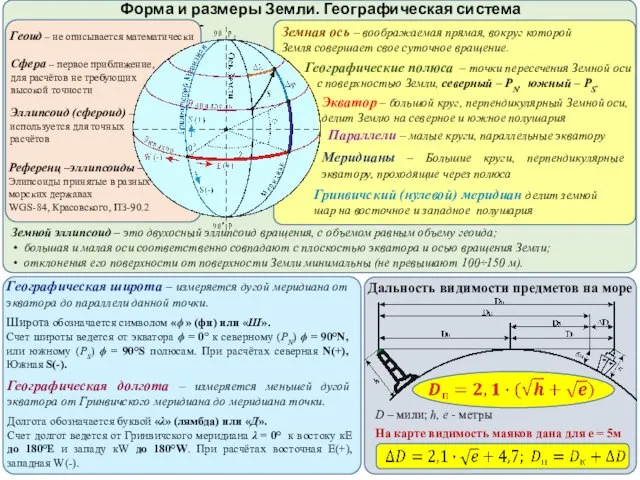 Форма и размеры Земли
Форма и размеры Земли Поздравление крестной жениха
Поздравление крестной жениха Гендерные аспекты образования и рынка труда
Гендерные аспекты образования и рынка труда Геометрия на службе у архитектуры
Геометрия на службе у архитектуры Психология двигательно-волевой сферы психической деятельности
Психология двигательно-волевой сферы психической деятельности Команда звёздочки
Команда звёздочки История семейного образования в СанктПетербурге
История семейного образования в СанктПетербурге Русский пейзаж в поэзии и живописи
Русский пейзаж в поэзии и живописи Физическая культура в период самоизоляции студентов педагогического вуза
Физическая культура в период самоизоляции студентов педагогического вуза Заповедники России
Заповедники России Презентация на тему Прощание с 1 классом
Презентация на тему Прощание с 1 классом Клёш и фалды
Клёш и фалды Быть нормальным
Быть нормальным Основные формы рельефа Алтайского края
Основные формы рельефа Алтайского края  Проект: Комплексное сопровождение покупки страховой компании
Проект: Комплексное сопровождение покупки страховой компании Сделка. Предпринимательская деятельность
Сделка. Предпринимательская деятельность русский язык - язык международного общения
русский язык - язык международного общения Условия признания и исполнения иностранных судебных решений
Условия признания и исполнения иностранных судебных решений