Содержание
- 2. Химическая реакция — превращение одного или нескольких исходных веществ в отличающиеся от них по химическому составу
- 3. Химические реакции происходят: при смешении или физическом контакте реагентов самопроизвольно при нагревании при участии катализаторов действии
- 4. Все реакции сопровождаются тепловыми эффектами. При разрыве химических связей в реагентах выделяется энергия, которая, в основном,
- 5. Реакции, протекающие с выделением теплоты и света называются - РЕАКЦИЯМИ ГОРЕНИЯ Реакции, протекающие с выделением теплоты,
- 6. Условия для химической реакции: 1. Необходимо, чтобы реагирующие вещества соприкоснулись и чем больше площадь их соприкосновения,
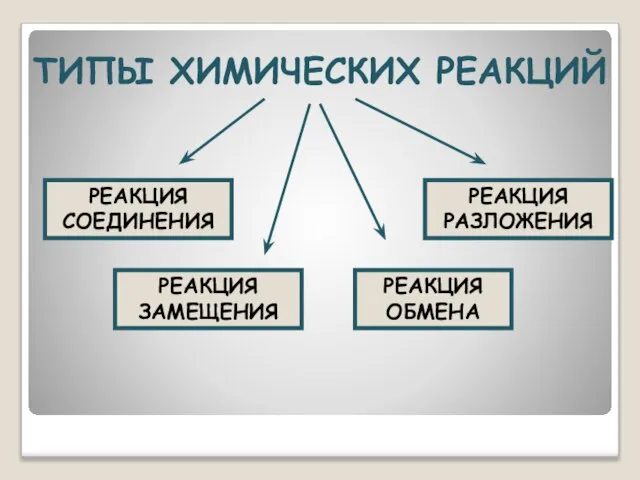
- 7. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ РЕАКЦИЯ СОЕДИНЕНИЯ РЕАКЦИЯ РАЗЛОЖЕНИЯ РЕАКЦИЯ ЗАМЕЩЕНИЯ РЕАКЦИЯ ОБМЕНА
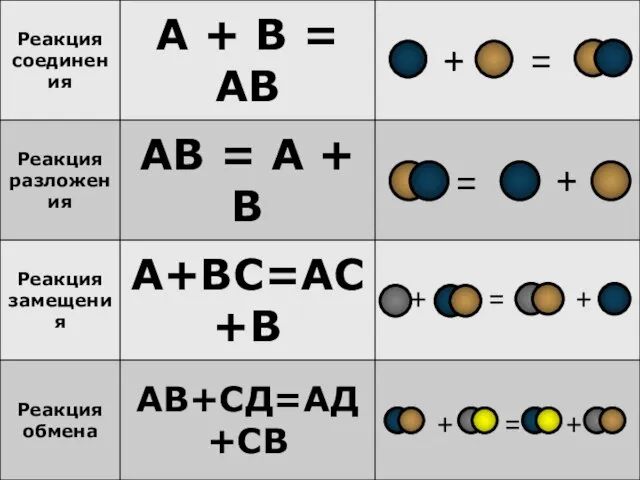
- 8. Реакция разложения одного сложного вещества с образованием несколько новых веществ, называется реакцией разложения. Например: 2KMnO4?K2MnO4+ MnO2
- 9. – это реакции, в результате которых сложное вещество разлагается на несколько других, более простых веществ. Реакции
- 10. Реакции соединения – химические реакции, в которых из двух или нескольких менее сложных по элементному составу
- 11. – это реакции, в которых из нескольких простых или сложных веществ образуется одно более сложное вещество.
- 12. Реакция, протекающая между простыми и сложными веществами, при которой атомы простого вещества замещают атомы одного из
- 13. Реакции между простым и сложным веществом, в результате которых атомы простого вещества замещают атомы одного из
- 14. Реакция, протекающая между двумя сложными веществами, при которой атомы или группы атомов одного вещества замещают атомы
- 15. Реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями называются реакциями обмена.
- 17. Обратимые реакции -химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном) Например: 3H2 +
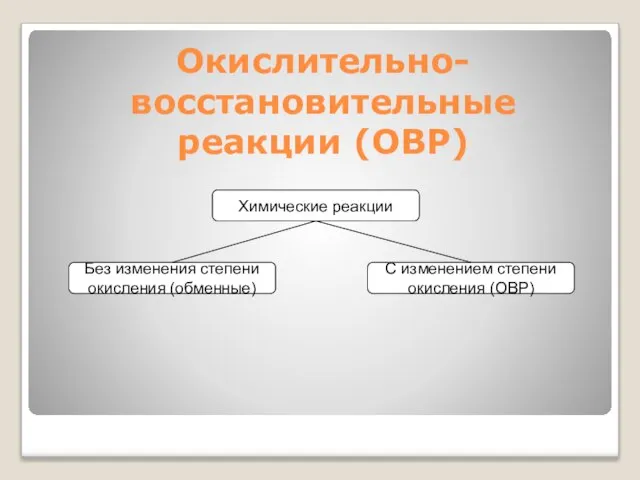
- 18. Окислительно-восстановительные реакции (ОВР)
- 19. Степень окисления формальный (условный) заряд атома в соединении, вычисленный, исходя из предположения, что соединение состоит из
- 20. Подбор коэффициентов в уравнениях ОВР Метод электронного баланса 1. Записывают формулы реагентов и продуктов, находят элементы,
- 21. Подбор коэффициентов в уравнениях ОВР Метод электронного баланса FeS2 + O2 → Fe2O3 + SO2 FeII
- 22. Подбор коэффициентов в уравнениях ОВР Метод электронно-ионных полуреакций 1. Записывают формулы реагентов и продуктов, находят окислитель,
- 24. Скачать презентацию


















 Презентация на тему Первые жилища человека
Презентация на тему Первые жилища человека Принцип работы АК -74. Назначение, боевые свойства, устройство,
Принцип работы АК -74. Назначение, боевые свойства, устройство, Что хочет клиент? – пытается выяснить рекламное агентство
Что хочет клиент? – пытается выяснить рекламное агентство учителей английского языка
учителей английского языка высокое качество, исполнение в срок.
высокое качество, исполнение в срок. Структура проекта
Структура проекта Презентация на тему Язык и человек. Общение устное и письменное 5 класс
Презентация на тему Язык и человек. Общение устное и письменное 5 класс  Вывод на российский рынок средства для ухода за кожей с помощью PR в Интернете
Вывод на российский рынок средства для ухода за кожей с помощью PR в Интернете Кем быть
Кем быть О деятельности классных руководителей в рамках реализации приоритетного национального проекта «Образование»
О деятельности классных руководителей в рамках реализации приоритетного национального проекта «Образование» Актуальность темы
Актуальность темы Презентация на тему Мыльные фантазии
Презентация на тему Мыльные фантазии Реализация плана действий муниципальных образований и учреждений образования по переводу работников учреждений, включенных в пе
Реализация плана действий муниципальных образований и учреждений образования по переводу работников учреждений, включенных в пе КУЛЬТУРА РОССИИ XIV — XVI ВЕКА
КУЛЬТУРА РОССИИ XIV — XVI ВЕКА Ресторан Ялта
Ресторан Ялта Основные понятия информационной безопасности. Основы законодательства в сфере информационной безопасности. Лекция 1
Основные понятия информационной безопасности. Основы законодательства в сфере информационной безопасности. Лекция 1 Материнство и заработная плата: почему женщины с детьми зарабатывают меньше?
Материнство и заработная плата: почему женщины с детьми зарабатывают меньше? Введение в теорию графов
Введение в теорию графов Управління талантами як напрямок розвитку людського капіталу організації
Управління талантами як напрямок розвитку людського капіталу організації Герои родных полей
Герои родных полей Тепловые машины
Тепловые машины Управление технологическими платформами:взгляд на проблему
Управление технологическими платформами:взгляд на проблему Выполнение зарисовки лица человека в разных ракурсах
Выполнение зарисовки лица человека в разных ракурсах Сложноподчиненные предложения с придаточными определительными
Сложноподчиненные предложения с придаточными определительными Гидросфера и проблемы загрязнения водной среды
Гидросфера и проблемы загрязнения водной среды Классическое исламское право и правовые системы исламских государств
Классическое исламское право и правовые системы исламских государств СВОЯ ФИНАНСОВАЯ ИГРА ПРОЕКТ
СВОЯ ФИНАНСОВАЯ ИГРА ПРОЕКТ Проектирование полуботинок с настрочной союзкой
Проектирование полуботинок с настрочной союзкой