Слайд 2Ура́н ( ура́ний) — химический элемент с атомным номером 92 в периодической системе, атомная масса 238,029; обозначается символом U (лат. Uranium),

относится к семейству актиноидов.
Слайд 3Общая характеристика элемента:

Слайд 492 номер в таблице Менделеева
Электронная формула основного состояния: 1s2 2s2p6 3s2p6d10 4s2p6d10f14

5s2p6d10f3 6s2p6d1 7s2
Электронная формула возбужденного состояния: 1s2 2s2p6 3s2p6d10 4s2p6d10f14 5s2p6d10f3 6s2p6d2 7s1 (или сокращенно: ...5f3 6d2 7s1)
Атом урана в возбужденном состоянии имеет 6 неспаренных электронов (3 - на 5-м уровне, 2 - на 6-м и 1 на внешнем) и может проявлять валентность 6 и степень окисления +6, например, в оксиде UO3
Слайд 5Валентных электронов в атоме урана 6
Характерные степени окисления:
Уран может проявлять степени

окисления от +3 до +6.
Кроме того, существует оксид U3O8. Степень окисления в нём формально дробная, а реально он представляет собой смешанный оксид урана (V) и (VI).
Слайд 7Содержание урана в земной коре составляет 0,0003 %, он встречается в поверхностном слое

земли в виде четырёх разновидностей отложений.
Во-первых, это жилы уранинита, или урановой смолки (диоксид урана UO2), очень богатые ураном, но редко встречающиеся. Им сопутствуют отложения радия, так как радий является прямым продуктом изотопного распада урана. Такие жилы встречаются в Демократической Республике Конго, Канаде (Большое Медвежье озеро), Чехии и Франции.
Слайд 8Вторым источником урана являются конгломераты ториевой и урановой руды совместно с рудами других

важных минералов. Конгломераты обычно содержат достаточные для извлечения количества золота и серебра, а сопутствующими элементами становятся уран и торий. Большие месторождения этих руд находятся в Канаде, ЮАР, России и Австралии.
Третьим источником урана являются осадочные породы и песчаники, богатые минералом карнотитом (уранил-ванадат калия), который содержит, кроме урана, значительное количество ванадия и других элементов. Такие руды встречаются в западных штатах США.
Слайд 9 Железоурановые сланцы и фосфатные руды составляют четвёртый источник отложений. Богатые отложения обнаружены в

глинистых сланцах Швеции. Некоторые фосфатные руды Марокко и США содержат значительные количества урана, а фосфатные залежи в Анголе и Центральноафриканской Республике ещё более богаты ураном. Большинство лигнитов и некоторые угли обычно содержат примеси урана. Богатые ураном отложения лигнитов обнаружены в Северной и Южной Дакоте (США) и битумных углях Испании и Чехии. В слое литосферы толщиной 20 км содержится ~ 1014 т, в морской воде 109—1010 т.
Слайд 10 Россия по запасам урана, с учетом резервных месторождений, занимает третье место

в мире (после Австралии и Казахстана). В месторождениях России содержится почти 550 тыс.т запасов урана, или немногим менее 10 % его мировых запасов; около 63 % их сосредоточено в Республике Саха (Якутия). Основными месторождениями урана в России являются: Стрельцовское, Октябрьское, Антей, Мало-Тулукуевское, Аргунское молибден-урановые в вулканитах (Читинская область), Далматовское урановое в песчаниках (Курганская область), Хиагдинское урановое в песчаниках (Республика Бурятия), Южное золото-урановое в метасоматитах и Северное урановое в метасоматитах (Республика Якутия). Кроме того, выявлено и оценено множество более мелких урановых месторождений и рудопроявлений.
Слайд 12Уран — очень тяжёлый, серебристо-белый глянцеватый металл. В чистом виде он немного мягче стали,

ковкий, гибкий, обладает небольшими парамагнитными свойствами. Уран имеет три аллотропные формы: (призматическая, стабильна до 667,7 °C), (четырёхугольная, стабильна от 667,7 °C до 774,8 °C), (с объёмно центрированной кубической структурой, существующей от 774,8 °C до точки плавления).
Слайд 15Химически уран весьма активен. Он быстро окисляется на воздухе и покрывается радужной

пленкой оксида. Мелкий порошок урана самовоспламеняется на воздухе, он зажигается при температуре 150—175 °C, образуя U3O8. Реакции металлического урана с другими неметаллами приведены в таблице.
Вода способна разъедать металл, медленно при низкой температуре, и быстро при высокой, а также при мелком измельчении порошка урана:
Слайд 16В кислотах-неокислителях уран растворяется, образуя UO2 или соли U4+ (при этом выделяется водород). С

кислотами-окислителями (азотной, концентрированной серной) уран образует соответствующие соли уранила UO22+
С растворами щелочей уран не взаимодействует.
При сильном встряхивании металлические частицы урана начинают светиться.
Слайд 17В кислотах-неокислителях уран растворяется, образуя UO2 или соли U4+ (при этом выделяется водород). С

кислотами-окислителями (азотной, концентрированной серной) уран образует соответствующие соли уранила UO22+
С растворами щелочей уран не взаимодействует.
При сильном встряхивании металлические частицы урана начинают светиться.
Слайд 19Соли урана(+3) (преимущественно, галогениды) — восстановители. На воздухе при комнатной температуре они обычно

устойчивы, однако при нагревании окисляются до смеси продуктов. Хлор окисляет их до UCl4 Образуют неустойчивые растворы красного цвета, в которых проявляют сильные восстановительные свойства:
Слайд 20Галогениды урана III образуются при восстановлении галогенидов урана (IV) водородом:
(550—590оC)
или

иодоводородом:
(500оC)
а также при действии галогеноводорода на гидрид урана UH3.
Слайд 21Кроме того, существует гидрид урана (III) UH3. Его можно получить, нагревая порошок урана в

водороде при температурах до 225оС, а выше 350оС он разлагается. Большую часть его реакций (например, реакцию с парами воды и кислотами) можно формально рассматривать как реакцию разложения с последующей реакцией металлического урана:
Слайд 22Соединения урана IV
Уран (+4) образует легко растворимые в воде соли зеленого цвета.

Они легко окисляются до урана (+6)
Слайд 24Соединения урана(+5) неустойчивы и легко диспропорционируют в водном растворе:
Хлорид урана V

при стоянии частично диспропорционирует:
а частично отщепляет хлор:
Слайд 26Степени окисления +6 соответствует оксид UO3. В кислотах он растворяется с образованием

соединений катиона уранила UO22+:
C основаниями UO3 (аналогично CrO3, MoO3 и WO3) образует различные уранат-анионы (в первую очередь, диуранат U2O72-). Последние, однако, чаще получают действием оснований на соли уранила:
Слайд 27Из соединений урана (+6), не содержащих кислород, известны только гексахлорид UCl6 и фторид UF6.

Последний играет важнейшую роль в разделении изотопов урана.
Соединения урана (+6) наиболее устойчивы на воздухе и в водных растворах.
Ураниловые соли, такие как уранилхлорид, распадаются на ярком свету или в присутствии органических соединений.
Уран также образует ураноорганические соединения.
Слайд 29В микроколичествах (10−5—10−8 %) обнаруживается в тканях растений, животных и человека. В наибольшей

степени накапливается некоторыми грибами и водорослями. Соединения урана всасываются в желудочно-кишечном тракте (около 1 %), в легких — 50 %. Основные депо в организме: селезёнка, почки, скелет, печень, лёгкие и бронхо-лёгочные лимфатические узлы. Содержание в органах и тканях человека и животных не превышает 10−7г.
Слайд 31Уран и его соединения токсичны. Особенно опасны аэрозоли урана и его соединений. Для

аэрозолей растворимых в воде соединений урана ПДК в воздухе 0,015 мг/м³, для нерастворимых форм урана ПДК 0,075 мг/м³. При попадании в организм уран действует на все органы, являясь общеклеточным ядом. Уран практически необратимо, как и многие другие тяжелые металлы, связывается с белками, прежде всего, с сульфидными группами аминокислот, нарушая их функцию. Молекулярный механизм действия урана связан с его способностью подавлять активность ферментов. В первую очередь поражаются почки (появляются белок и сахар в моче, олигурия). При хронической интоксикации возможны нарушения кроветворения и нервной системы.
Слайд 34Наибольшее применение имеет изотоп урана 235U, в котором возможна самоподдерживающаяся цепная ядерная реакция. Поэтому этот изотоп

используется как топливо в ядерных реакторах, а также в ядерном оружии. Выделение изотопа U235 из природного урана — сложная технологическая проблема.
Изотоп U238 способен делиться под влиянием бомбардировки высокоэнергетическими нейтронами, эту его особенность используют для увеличения мощности термоядерного оружия (используются нейтроны, порождённые термоядерной реакцией).
В результате захвата нейтрона с последующим β-распадом 238U может превращаться в 239Pu, который затем используется как ядерное топливо.
Слайд 35Уран-233, искусственно получаемый в реакторах из тория (торий-232 захватывает нейтрон и превращается в

торий-233, который распадается в протактиний-233 и затем в уран-233), может в будущем стать распространённым ядерным топливом для атомных электростанций (уже сейчас существуют реакторы, использующие этот нуклид в качестве топлива, например KAMINI в Индии) и производства атомных бомб (критическая масса около 16 кг).
Уран-233 также является наиболее перспективным топливом для газофазных ядерных ракетных двигателей.
Слайд 36Тепловыделяющая способность урана
1 тонна обогащенного урана по тепловыделяющей способности равна 1 миллиону

350 тысячам тонн нефти или природного газа.
Слайд 38Основное применение урана в геологии — определение возраста минералов и горных пород с целью

выяснения последовательности протекания геологических процессов. Этим занимается геохронология. Существенное значение имеет также решение задачи о смешении и источниках вещества.
В связи с тем, что горные породы содержат различные концентрации урана, они обладают различной радиоактивностью. Это свойство используется при выделении горных пород геофизическими методами. Наиболее широко этот метод применяется в нефтяной геологии при геофизических исследованиях скважин.
Слайд 40Несмотря на бытующие легенды о десятках тысяч долларов за килограммовые или даже

грамовые количества урана, реальная его цена на рынке не столь высока — стоимость килограмма необогащённой окиси урана U3O8 росла от $21 в январе 2002, достигла пиковых $300 в середине 2007 г., в дальнейшем понижалась и колеблется между нынешними $90-130 за кг с некоторой тенденцией к росту. При этом следует понимать, что открытого мирового рынка урана как такового не существует, в отличие, например от золота.







































 USA
USA История термометра
История термометра Блок Двенадцать
Блок Двенадцать Электроника. Законы электричества. Варианты электрических цепей
Электроника. Законы электричества. Варианты электрических цепей Озеленение классной комнаты
Озеленение классной комнаты Рейтинговое оценивание университетов
Рейтинговое оценивание университетов История психологии
История психологии Эмоциональный интеллект
Эмоциональный интеллект Учебно-лабораторный комплекс для подготовки специалистов по защите речевой информации от утечки по каналам акустики и вибрации о
Учебно-лабораторный комплекс для подготовки специалистов по защите речевой информации от утечки по каналам акустики и вибрации о Действия при возникновении чрезвычайной ситуации техногенного характера и опасности попадания в зону заражения
Действия при возникновении чрезвычайной ситуации техногенного характера и опасности попадания в зону заражения Презентация на тему Страны мира
Презентация на тему Страны мира  «Новая система оценки качества»
«Новая система оценки качества» Брейн - ринг(математика и информатика)
Брейн - ринг(математика и информатика) Презентация на тему Теория относительности
Презентация на тему Теория относительности «Человека, умеющего наблюдать и анализировать, обмануть невозможно» Артур Конан Дойл
«Человека, умеющего наблюдать и анализировать, обмануть невозможно» Артур Конан Дойл Ситуация на рынке труда г. Чайковский
Ситуация на рынке труда г. Чайковский Эволюция органического мира
Эволюция органического мира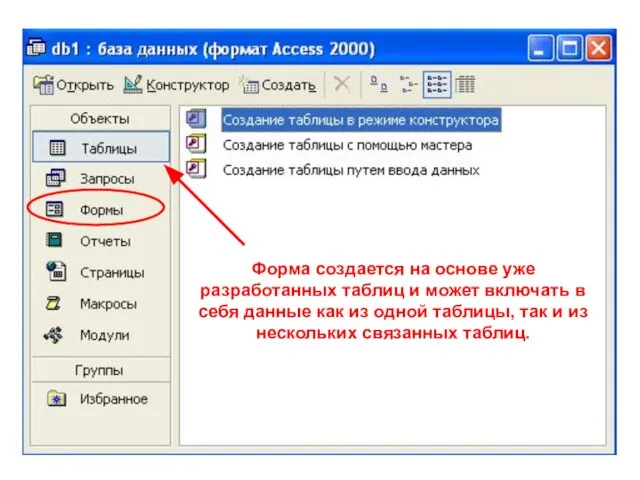 Форма создается на основе уже разработанных таблиц и может включать в себя данные как из одной таблицы, так и из нескольких связанн
Форма создается на основе уже разработанных таблиц и может включать в себя данные как из одной таблицы, так и из нескольких связанн Оперативная память. Общая характеристика
Оперативная память. Общая характеристика Обеспечение эффективности рекламных инвестиций на основе data-решений. W-media platform
Обеспечение эффективности рекламных инвестиций на основе data-решений. W-media platform Композиционное построение вазы «Сапожок»
Композиционное построение вазы «Сапожок» Water problems of mother nature
Water problems of mother nature Ультразвук
Ультразвук Франшиза TVService
Франшиза TVService Прекращение ИВЛ
Прекращение ИВЛ Какому числу равен квадрат числа 11
Какому числу равен квадрат числа 11 Авторские открытки МГУ
Авторские открытки МГУ Агрессивность у детей дошкольного возраста
Агрессивность у детей дошкольного возраста