Содержание
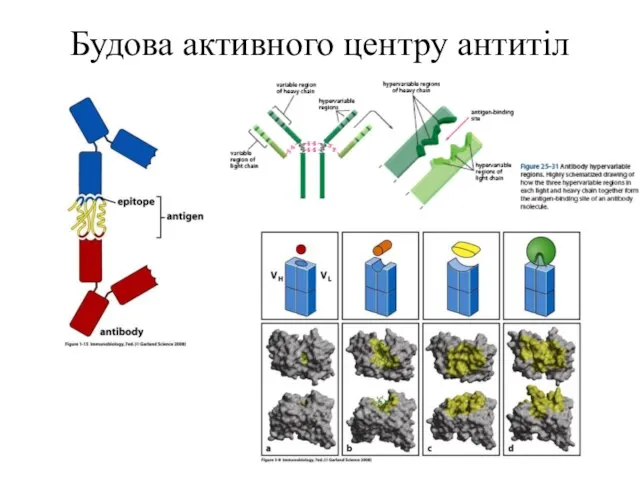
- 2. Будова активного центру антитіл
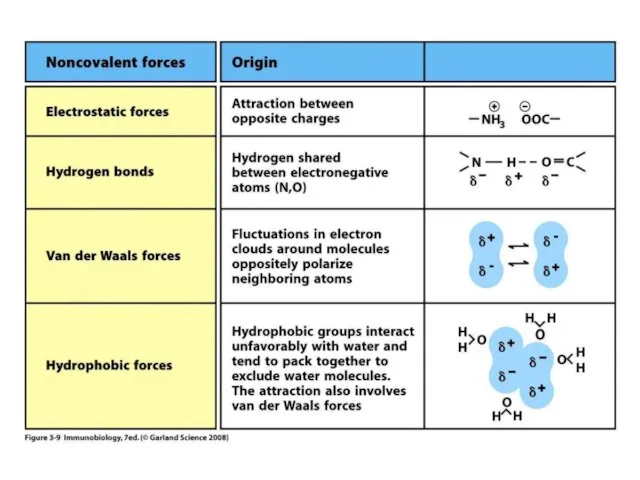
- 3. Нековалентні зв’язки між антитілом та антигеном
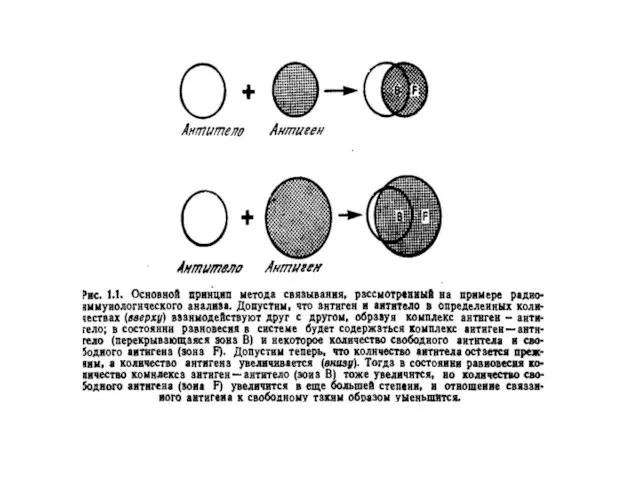
- 5. АФІННІСТЬ АНТИТІЛ Афінністю або спорідненістю антитіл до антигену називають результуючу силу їх взаємодій, яка є сумою
- 6. (1) хімічна реакція першого порядку [ АГ ] + [ АТ ] [АГАТ ] АГ –
- 7. Розрахунок афінності антитіл
- 8. Kd=1/ Ka - константа дисоціації; Ka>105M-1 - cпецифічне зв′язування; Ka>108M-1 -високоспецифічне зв′язування; Ka Ka- термодинамічний параметр:
- 9. (1) хімічна реакція першого порядку [ АГ ] + [ АТ ] [АГАТ ] АГ –
- 10. Кінетичні розрахунки Згідно з (1) та (2) і системою рівнянь матеріального балансу [АТ]з = [АТ] +[
- 11. При розрахунку Ка визначають таку концентрацію антигену [АГ]'з , при якій половина антитіл знаходиться у вигляді
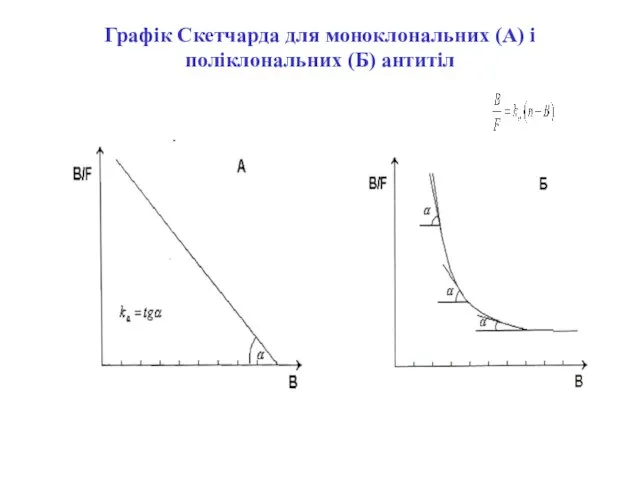
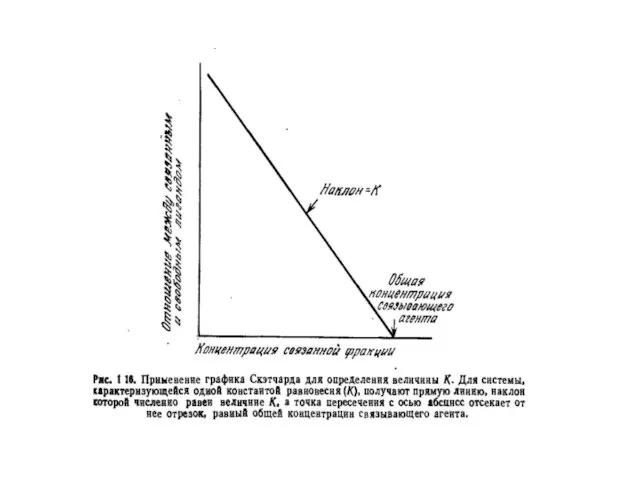
- 13. Рівняння Скетчарда: B - концентрація зв'язаного антигену; F - концентрація вільного антигену; n - кількість центрів
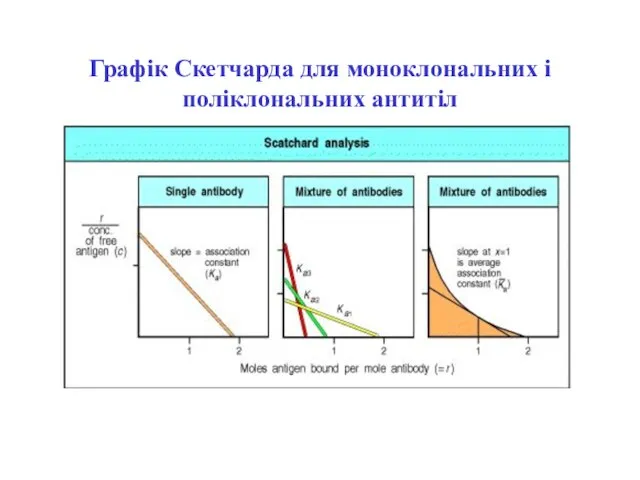
- 14. Графік Скетчарда для моноклональних (А) і поліклональних (Б) антитіл
- 15. Графік Скетчарда для моноклональних і поліклональних антитіл
- 17. МЕТОДИ ДОСЛІДЖЕННЯ ВЗАЄМОДІЇ АНТИГЕН-АНТИТІЛО. ІМУНОХІМІЧНИЙ АНАЛІЗ.
- 18. Методи імунохімічного аналізу Прямі (безпосередні) методи визначення реакції антиген-антитіло. Комплекси, що при цьому утворюються, ідентифікують візуально
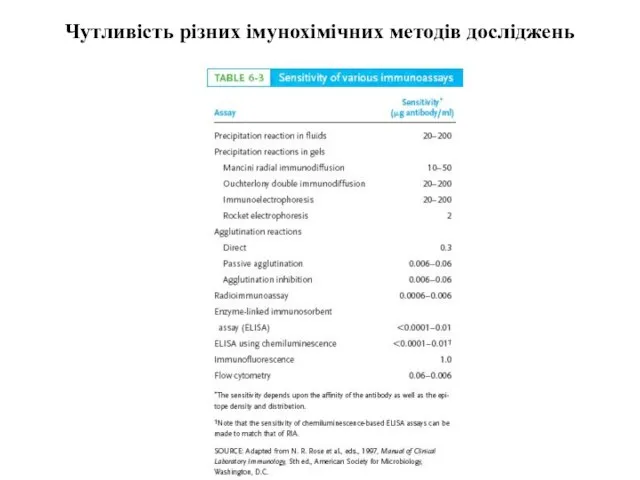
- 19. Чутливість різних імунохімічних методів досліджень
- 20. Експериментальні підходи, які використовуються в імунохімічних методах Методичні підходи, що засновані на зміні фізико-хімічних властивостей антигенів
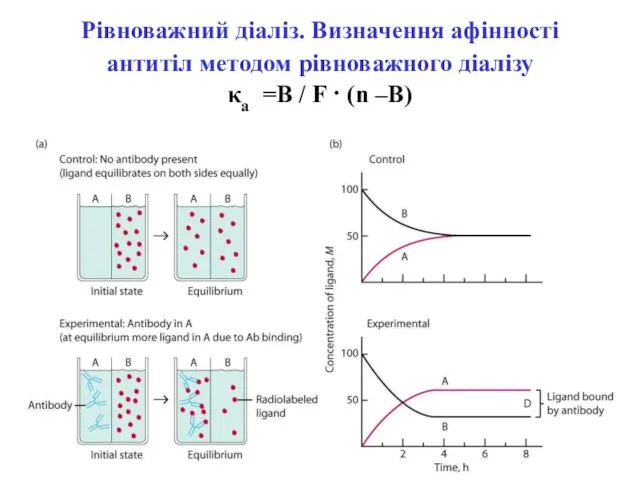
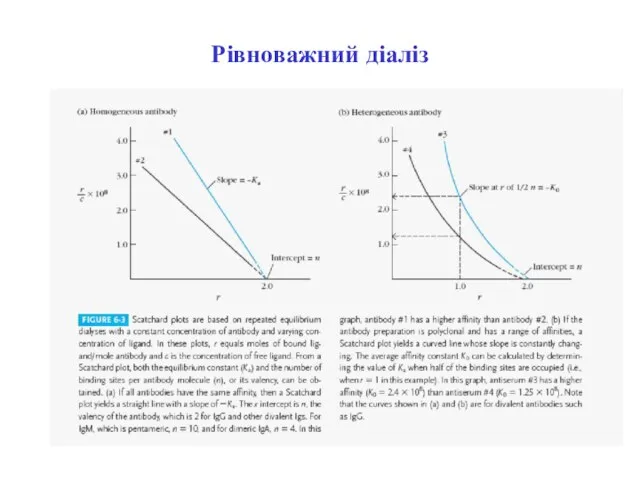
- 21. Рівноважний діаліз. Визначення афінності антитіл методом рівноважного діалізу κа =В / F · (n –B)
- 22. Рівноважний діаліз
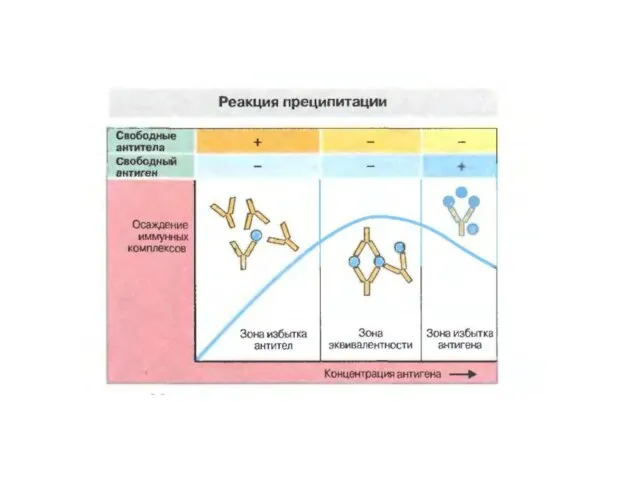
- 23. РЕАКЦІЇ ПРЕЦИПІТАЦІЇ
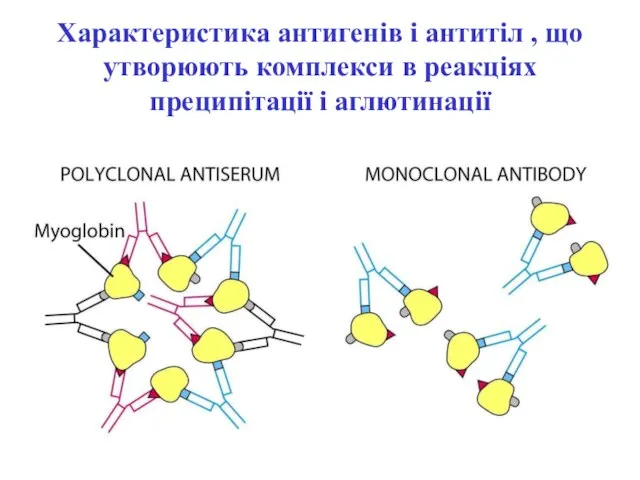
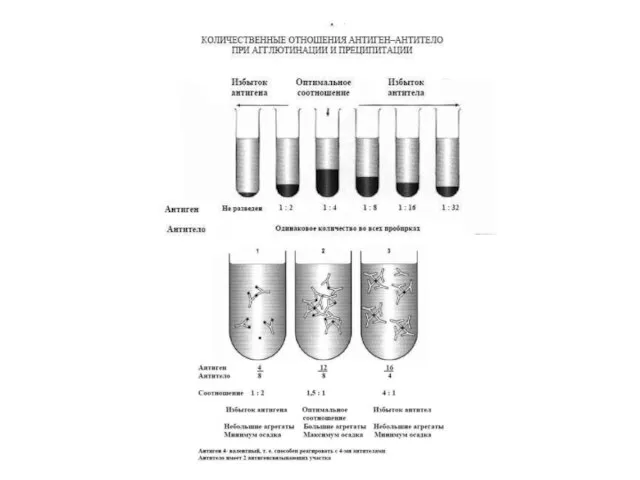
- 24. Характеристика антигенів і антитіл , що утворюють комплекси в реакціях преципітації і аглютинації
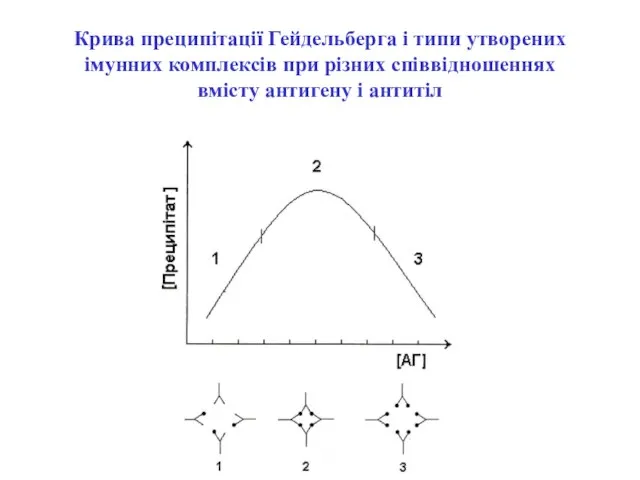
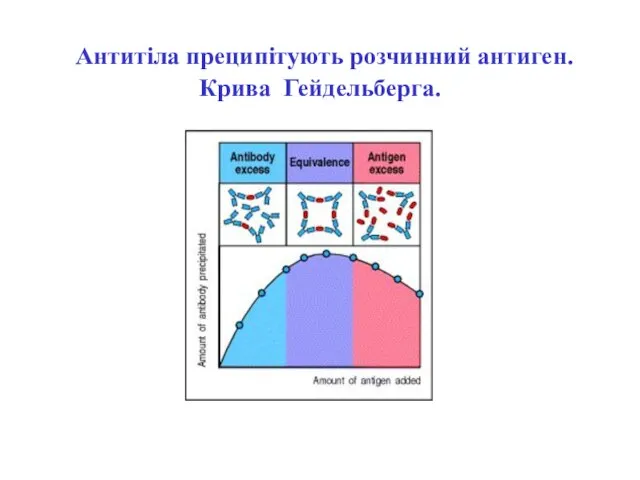
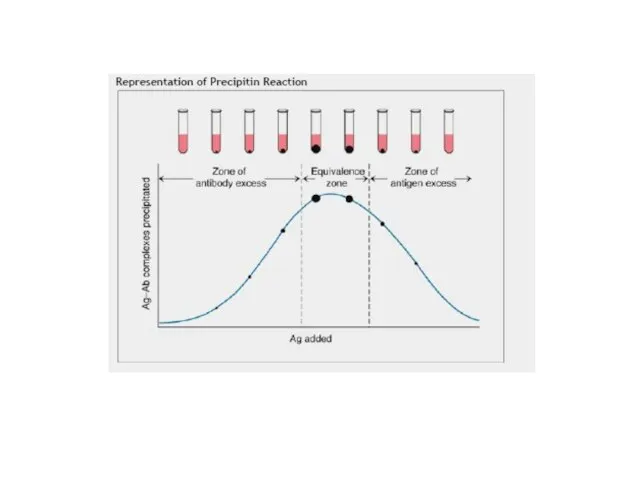
- 25. Крива преципітації Гейдельберга і типи утворених імунних комплексів при різних співвідношеннях вмісту антигену і антитіл
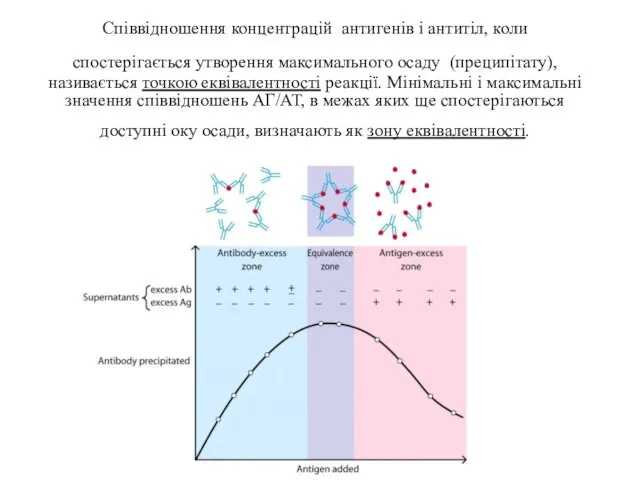
- 26. Співвідношення концентрацій антигенів і антитіл, коли спостерігається утворення максимального осаду (преципітату), називається точкою еквівалентності реакції. Мінімальні
- 28. Антитіла преципітують розчинний антиген. Крива Гейдельберга.
- 30. Реакції аглютинації – осадження антитілами корпускулярних антигенів (клітин, вірусних часточок і т.д), реакції преципітації- осадження молекул,
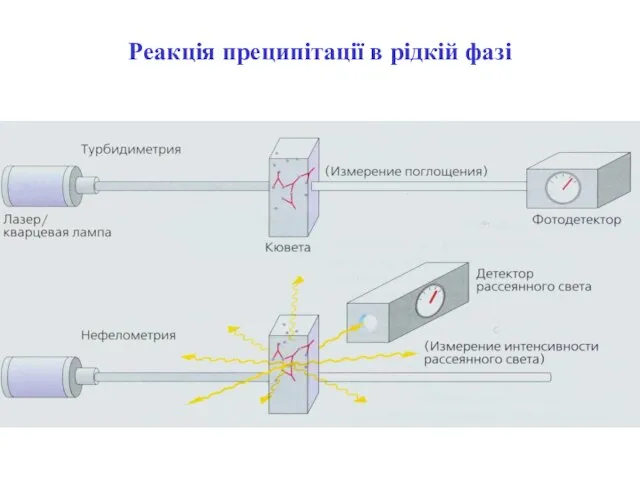
- 32. Реакція преципітації в рідкій фазі
- 33. Реакції преципітації в гелі
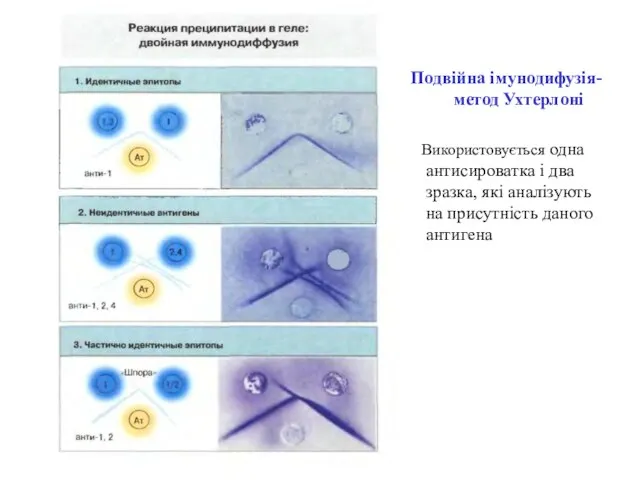
- 34. Подвійна імунодифузія- метод Ухтерлоні
- 35. Подвійна імунодифузія-метод Ухтерлоні Використовується одна антисироватка і два зразка, які аналізують на присутність даного антигена
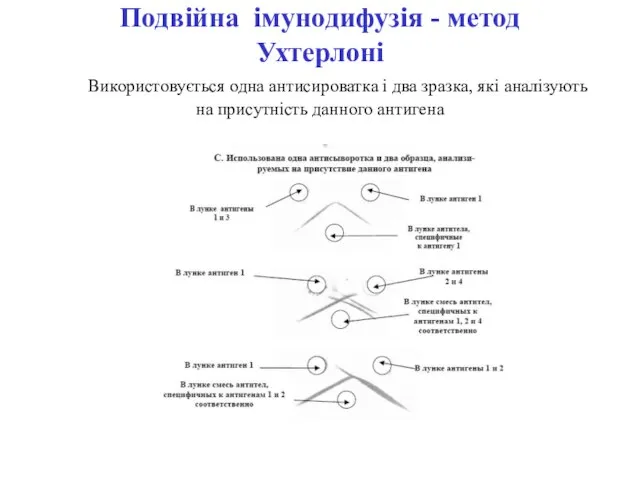
- 36. Подвійна імунодифузія - метод Ухтерлоні Використовується одна антисироватка і два зразка, які аналізують на присутність данного
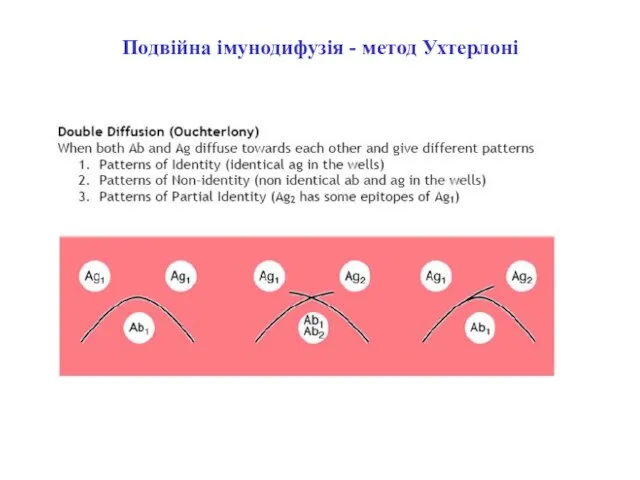
- 37. Подвійна імунодифузія - метод Ухтерлоні
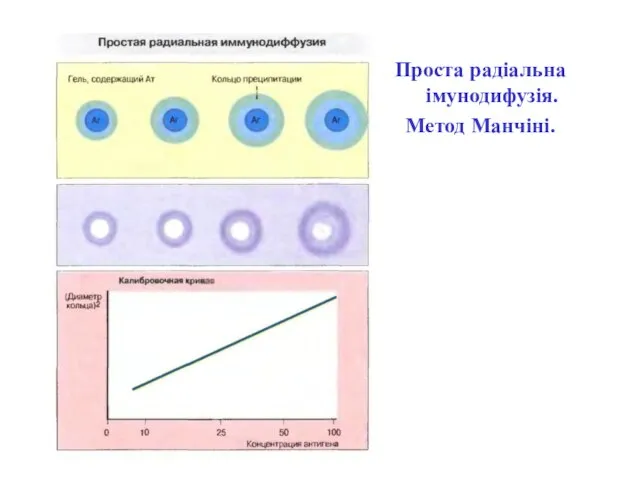
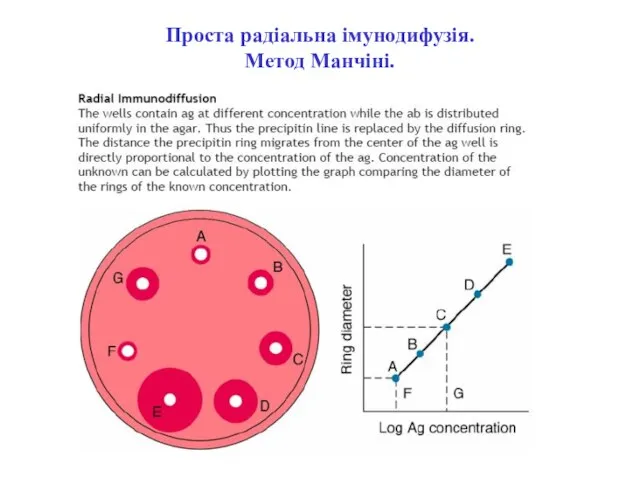
- 38. Проста радіальна імунодифузія. Метод Манчіні.
- 39. Проста радіальна імунодифузія. Метод Манчіні.
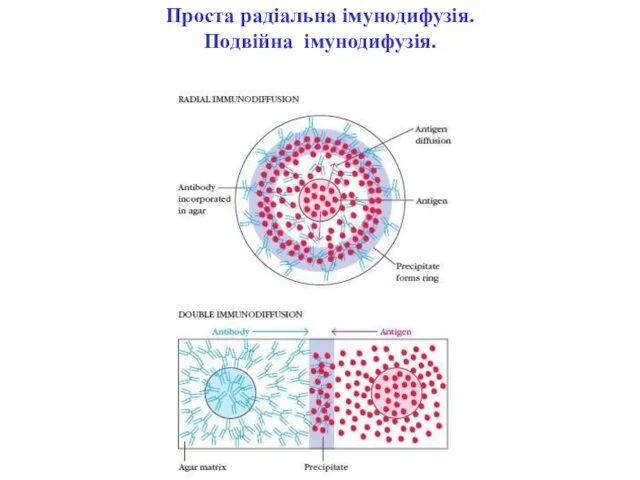
- 40. Проста радіальна імунодифузія. Подвійна імунодифузія.
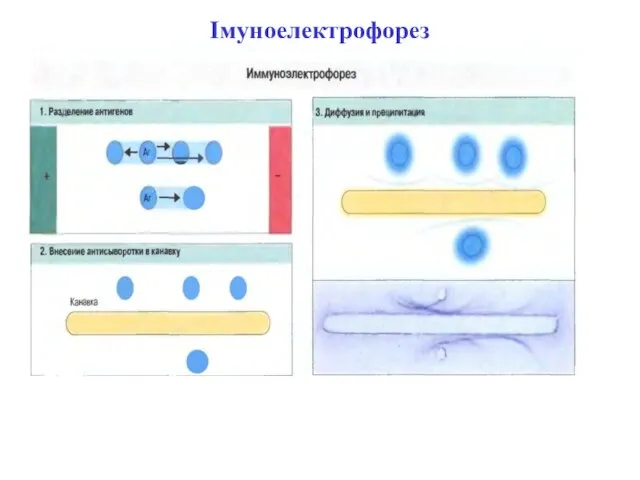
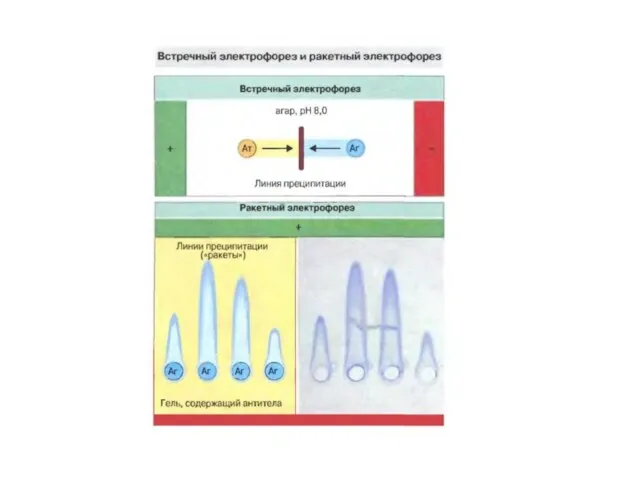
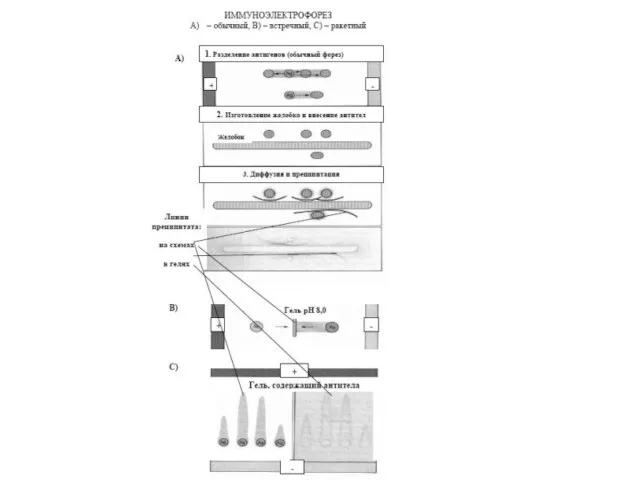
- 41. Імуноелектрофорез
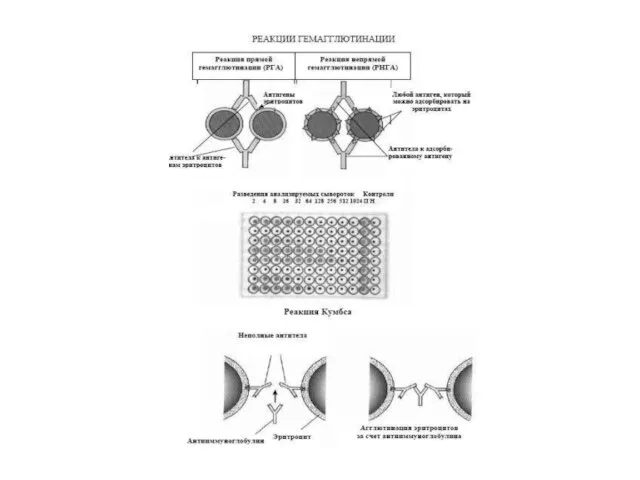
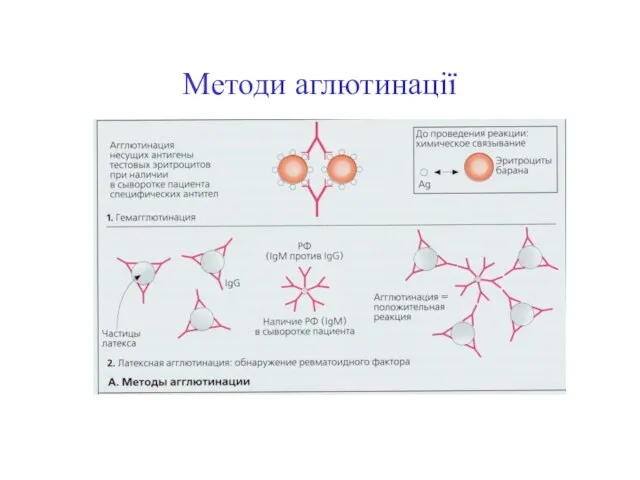
- 44. Реакції (гем)аглютинації Реакції аглютинації – осадження антитілами корпускулярних антигенів (клітин, вірусних часточок і т.д), реакції преципітації-
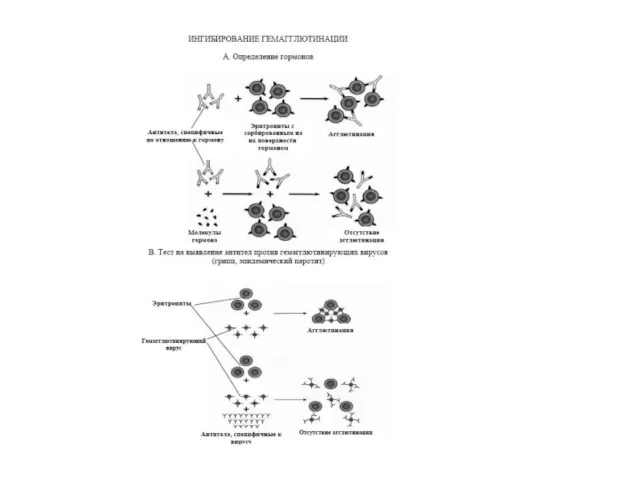
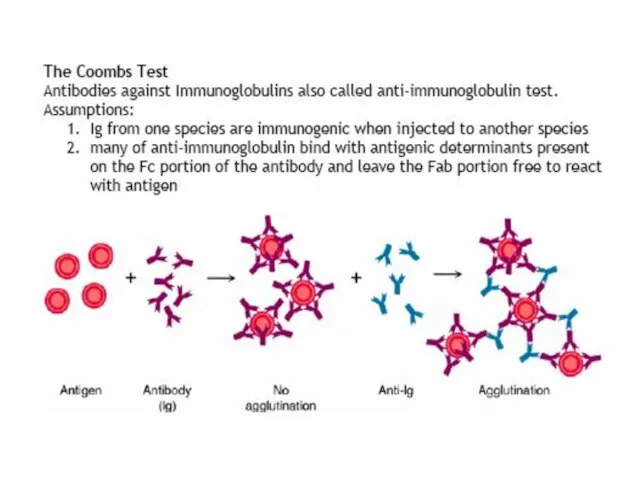
- 47. Методи аглютинації
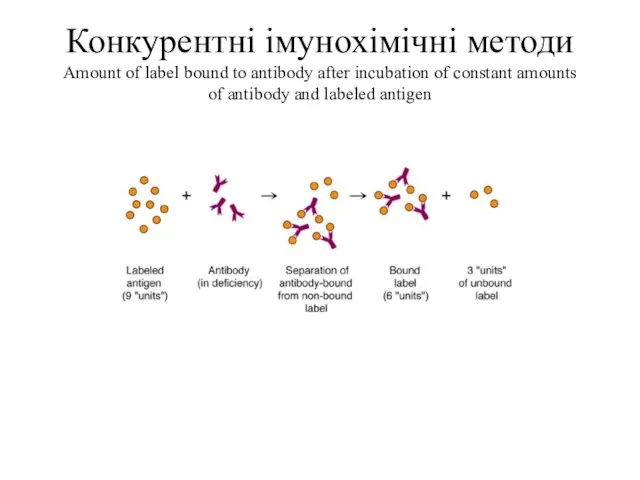
- 49. Конкурентні імунохімічні методи Amount of label bound to antibody after incubation of constant amounts of antibody
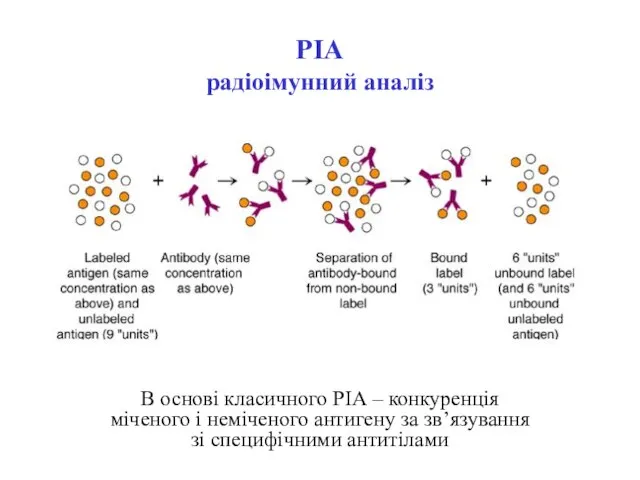
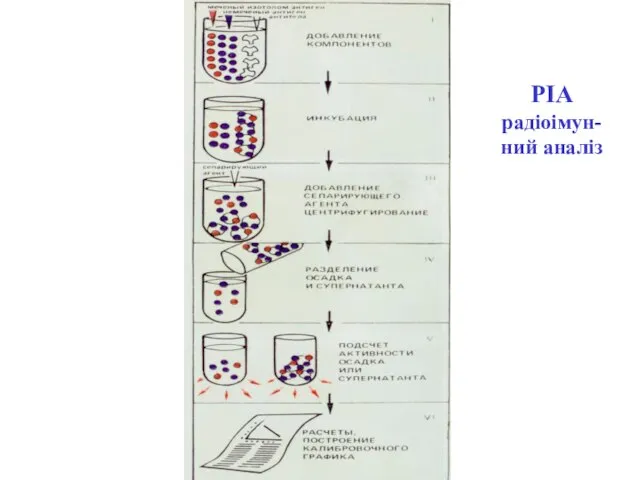
- 50. РІА радіоімунний аналіз В основі класичного РІА – конкуренція міченого і неміченого антигену за зв’язування зі
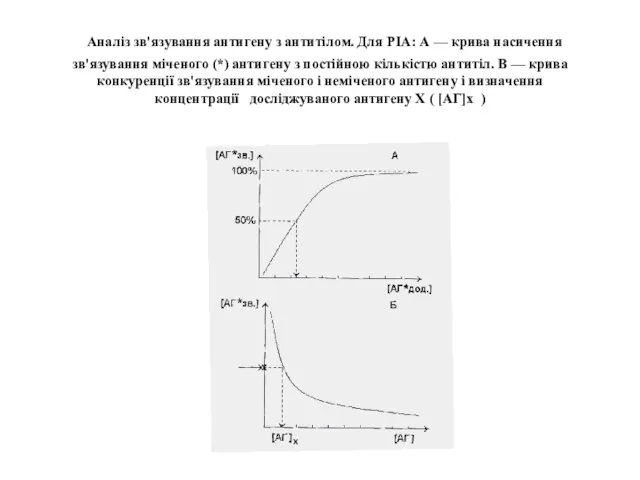
- 51. Аналіз зв'язування антигену з антитілом. Для РІА: А — крива насичення зв'язування міченого (*) антигену з
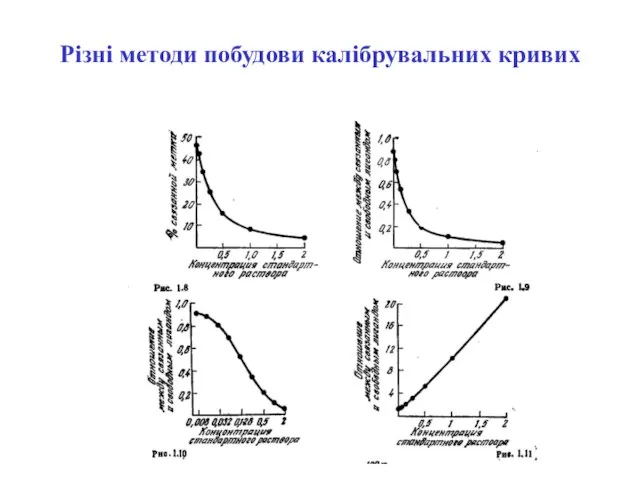
- 52. Різні методи побудови калібрувальних кривих
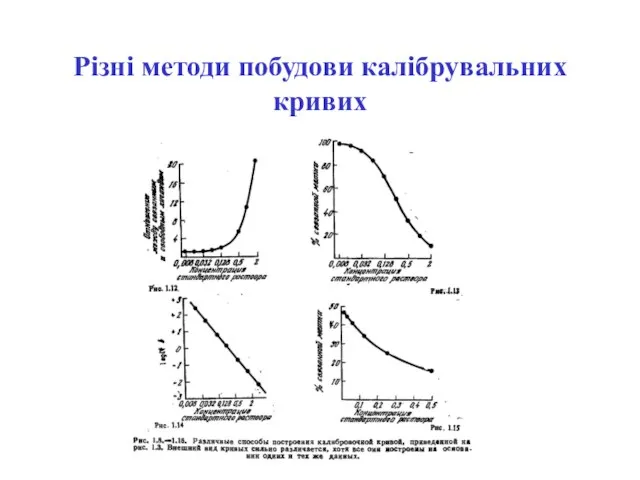
- 53. Різні методи побудови калібрувальних кривих
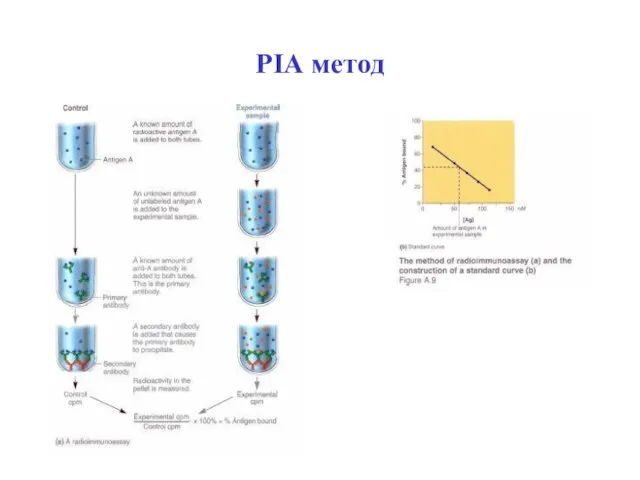
- 54. РІА радіоімун- ний аналіз
- 55. В - рівень зв’язаного в результаті реакції АГ-АТ міченого 125І-АГ; В0 - загальний рівень радіоактивно-міченого 125І-АГ,
- 56. РІА метод
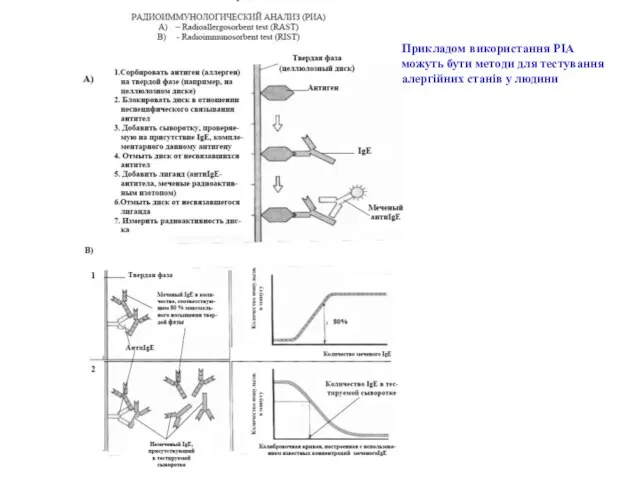
- 57. Прикладом використання РІА можуть бути методи для тестування алергійних станів у людини
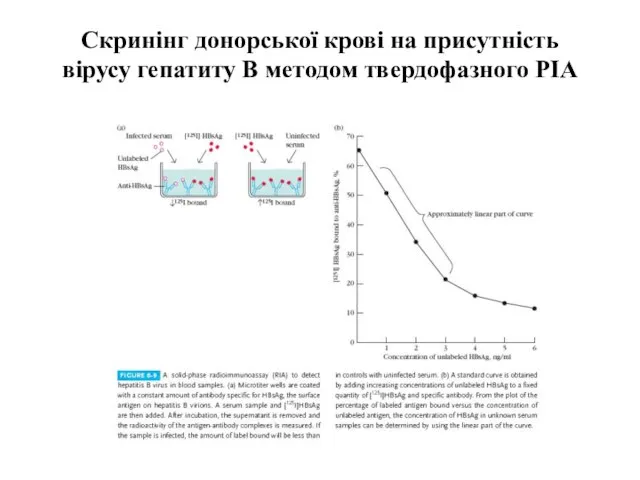
- 58. Cкринінг донорської крові на присутність вірусу гепатиту В методом твердофазного РІА
- 59. ІМУНОФЕРМЕНТНИЙ АНАЛІЗ
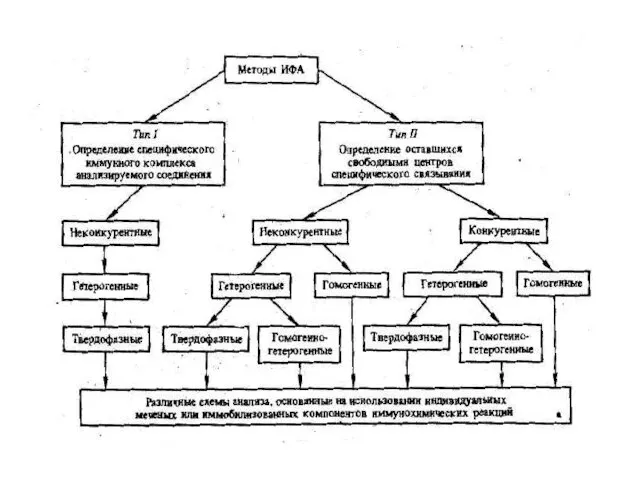
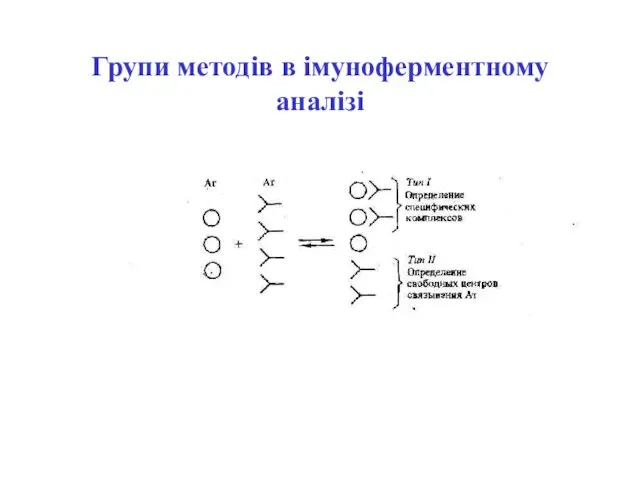
- 61. Групи методів в імуноферментному аналізі
- 62. КОНКУРЕНТНИЙ (а) ТА НЕКОНКУРЕНТНИЙ (б) ГЕТЕРОГЕННИЙ ІМУНОФЕРМЕНТНИЙ АНАЛІЗ
- 63. ОСОБЛИВОСТІ ІМУНОФЕРМЕНТНОГО АНАЛІЗУ Імуносорбенти Твердофазні носії Імобілізація антигенів чи антитіл на твердій фазі Ферменти і субстрати
- 64. ОСОБЛИВОСТІ ІМУНОФЕРМЕНТНОГО АНАЛІЗУ Ферменти і субстрати Пероксидаза хрону (ПХ)-Нorse radish peroxidase (HRP). Субстрати при фотометрії -
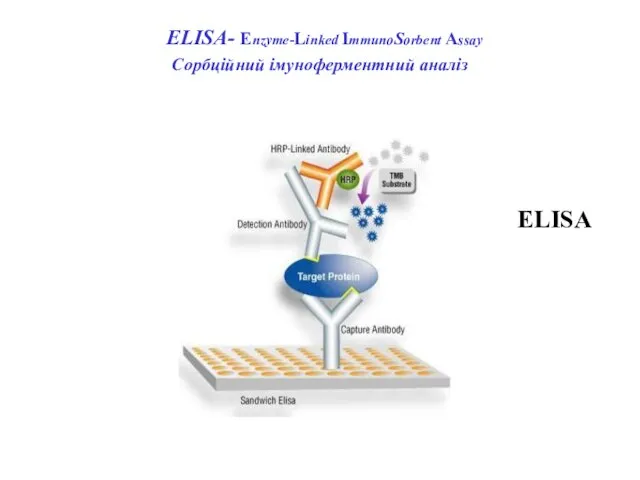
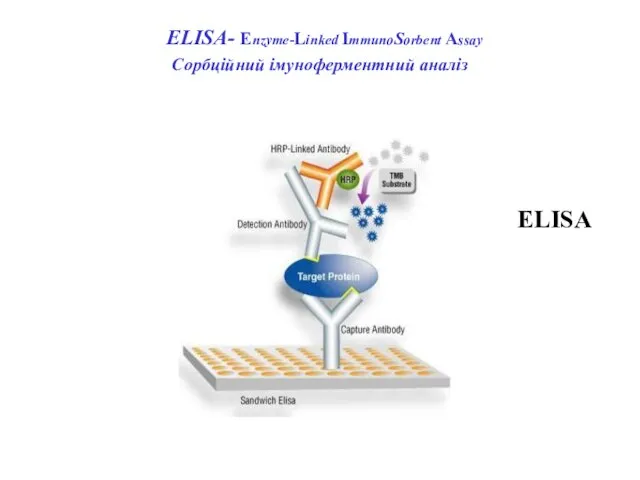
- 65. ELISА- Enzyme-Linked ImmunoSorbent Assay Сорбційний імуноферментний аналіз ELISA
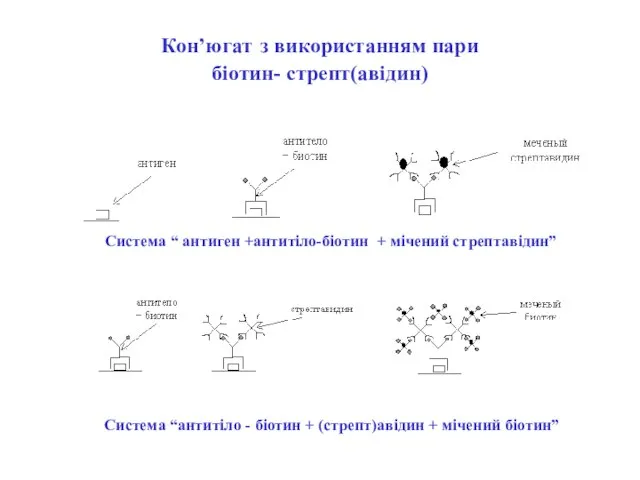
- 66. Кон’югат з використанням пари біотин- стрепт(авідин) Система “антитіло - біотин + (стрепт)авідин + мічений біотин” Система
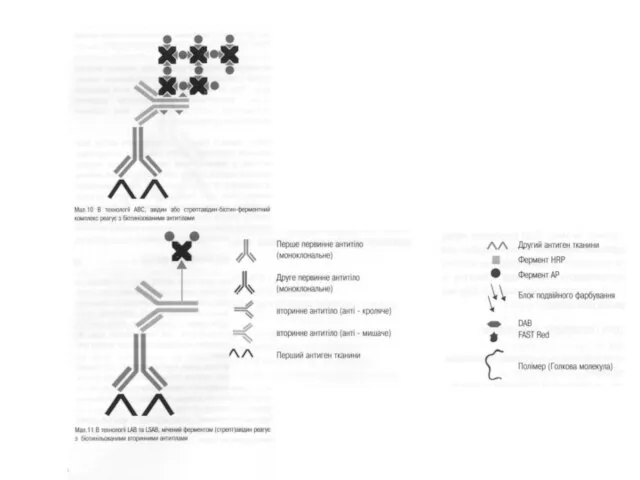
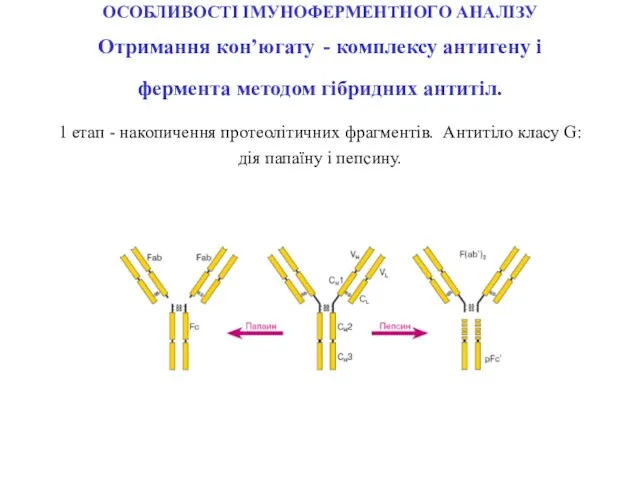
- 68. ОСОБЛИВОСТІ ІМУНОФЕРМЕНТНОГО АНАЛІЗУ Отримання кон’югату - комплексу антигену і фермента методом гібридних антитіл. 1 етап -
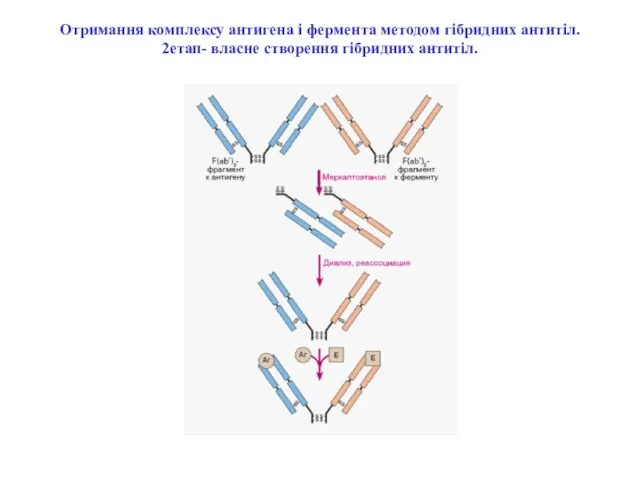
- 69. Отримання комплексу антигена і фермента методом гібридних антитіл. 2етап- власне створення гібридних антитіл.
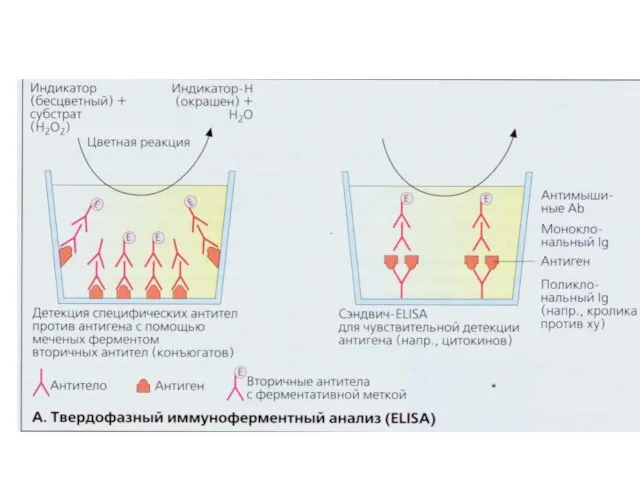
- 70. ELISА- Enzyme-Linked ImmunoSorbent Assay Сорбційний імуноферментний аналіз
- 71. ELISА- Enzyme-Linked ImmunoSorbent Assay Сорбційний імуноферментний аналіз ELISA
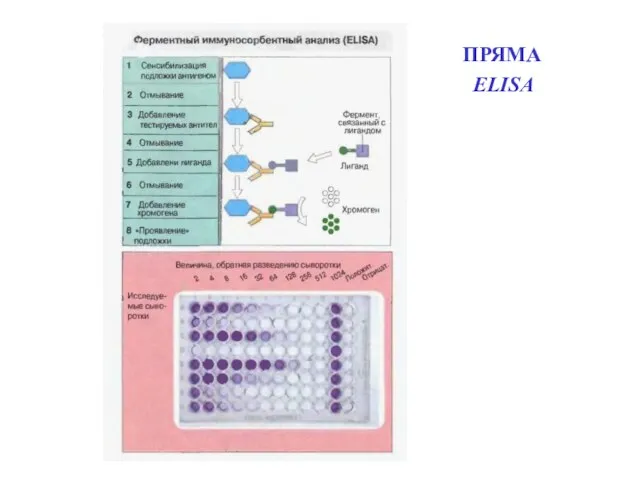
- 73. ПРЯМА ELISА
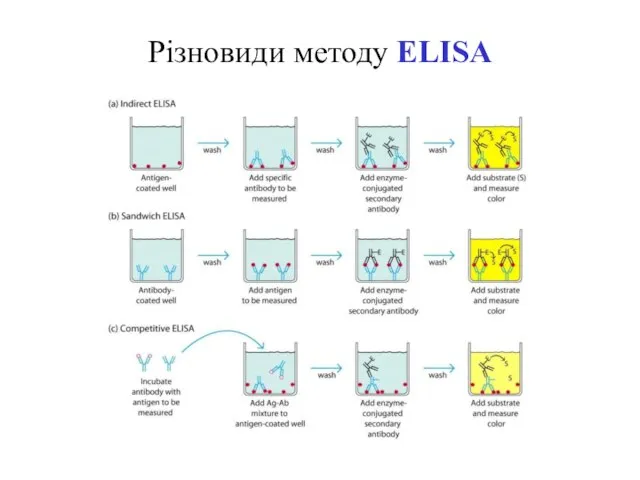
- 74. Різновиди методу ELISA
- 75. ELISА-Enzyme-Linked ImmunoSorbent Assay Сорбційний імуноферментний аналіз (1) непрямий метод What you need to do the assay
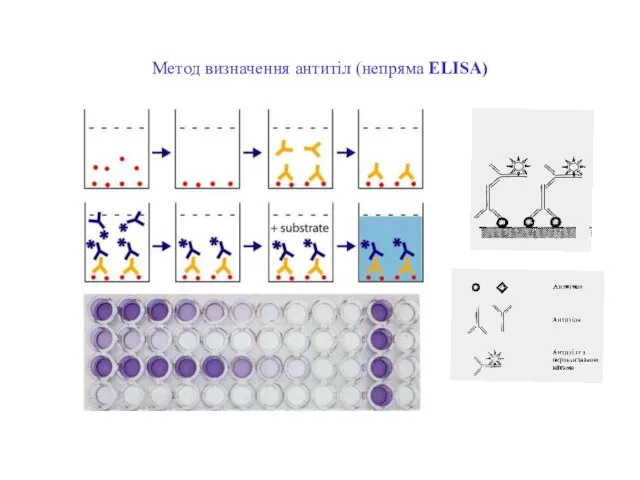
- 76. Метод визначення антитіл (непряма ELISA)
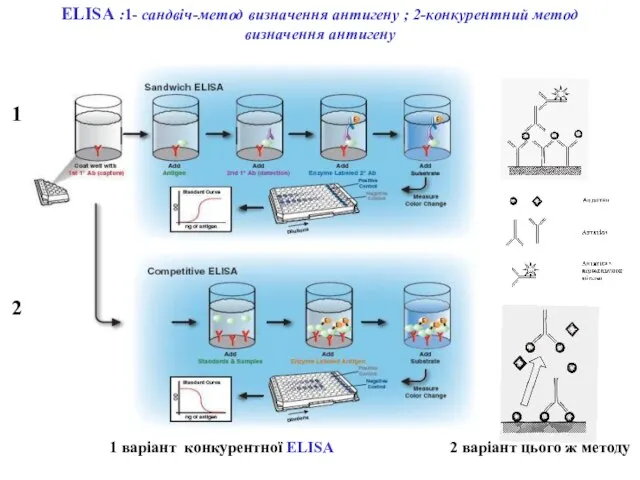
- 77. ELISA :1- сандвіч-метод визначення антигену ; 2-конкурентний метод визначення антигену 1 варіант конкурентної ELISA 2 варіант
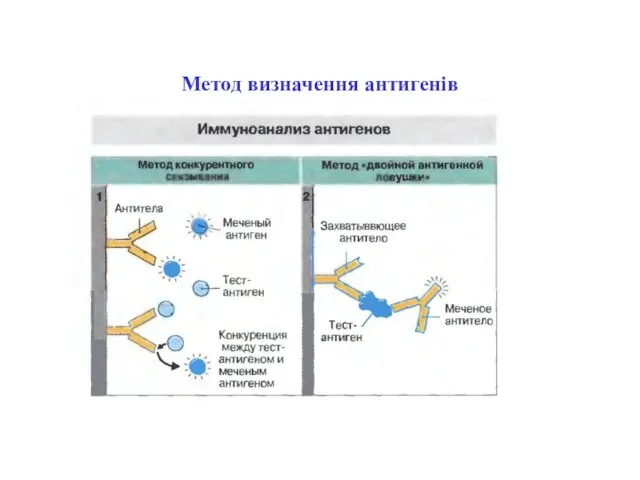
- 78. Метод визначення антигенів
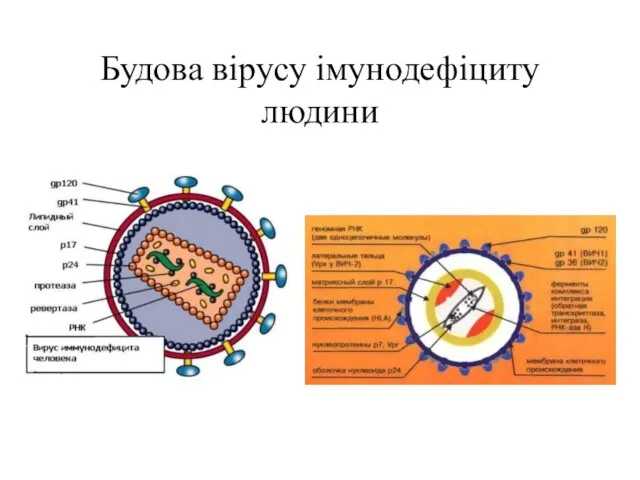
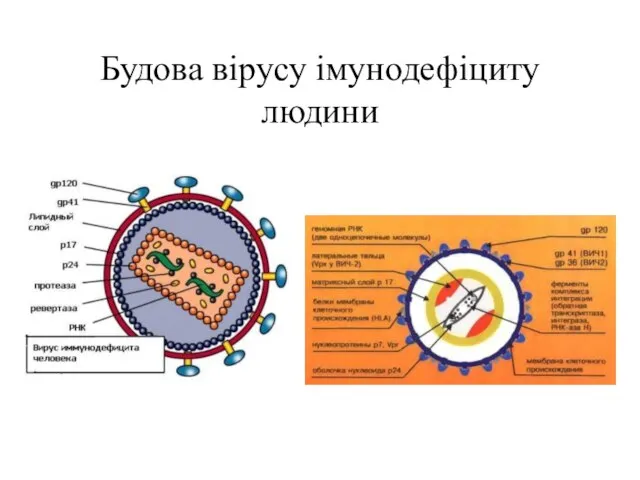
- 79. Будова вірусу імунодефіциту людини
- 80. Віріони ВІЛ мають вид сферичних часточок, діаметр яких складає приблизно 100—120 нм. Оболонка утворена подвійним шаром
- 81. ELISA Activity (n_animation.mov, p_animation 1.mov) An HIV ELISA, sometimes called an HIV enzyme immunoassay (EIA) is
- 82. The ELISA Method (n_animation.mov, p_animation 1.mov) Partially purified, inactivated HIV antigens pre-coated onto an ELISA plate
- 83. Positive ELISA Test Negative ELISA Test
- 84. Above is ELISA data from three patients. Numbers are expressed as optical density at 450 nm.
- 85. Перша російська тест-система для виявлення сумарних антитіл до ВІЛ-1,2 (1999)
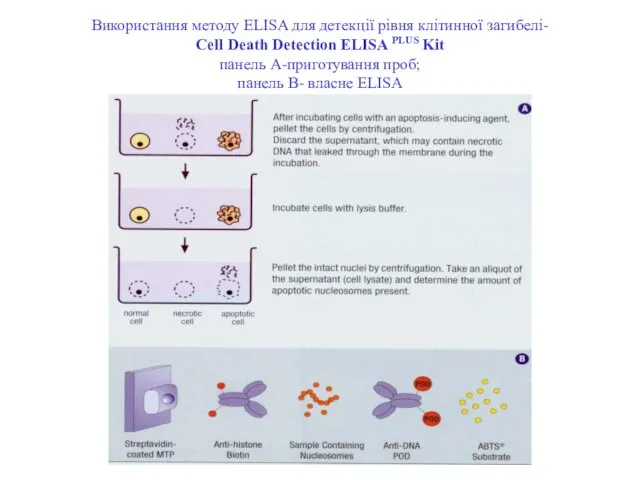
- 86. Використання методу ELISA для детекції рівня клітинної загибелі- Сell Death Detection ELISA PLUS Kit панель А-приготування
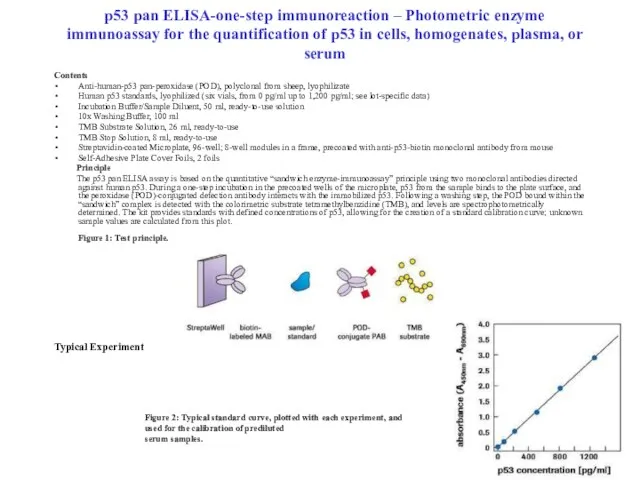
- 87. p53 pan ELISA-оne-step immunoreaction – Photometric enzyme immunoassay for the quantification of p53 in cells, homogenates,
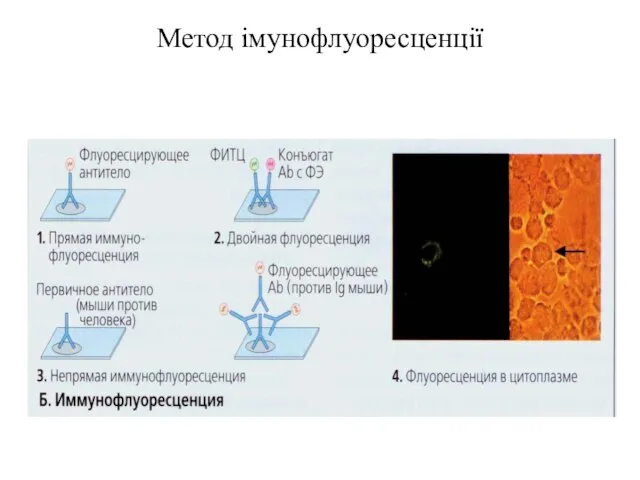
- 88. Метод імунофлуоресценції
- 89. Флуоресцентне випромінювання Деякі речовини здатні поглинати фотони певної енергії (довжини хвилі) при опроміненні світлом певної довжини
- 90. В 1944 р. Albert Coons показав, що антитіла можна мітити молекулами, які флуоресціюють. Коли молекула антитіла
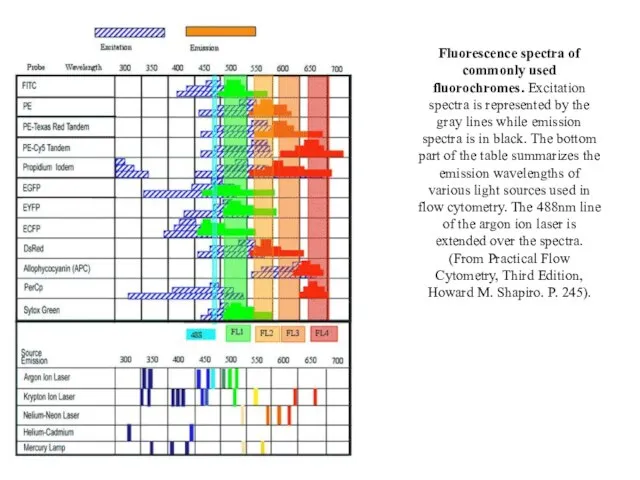
- 91. Fluorescence spectra of commonly used fluorochromes. Excitation spectra is represented by the gray lines while emission
- 92. Флуоресцеїн (Fluorescein )- органічний барвник, який широко використовують в імунофлуоресценції. Хвиля збудження в діапазоні синього світла
- 93. Метод імунофлуоресценції ФІТЦ- флуоресцеїн-ізотіоціанат- довжина хвилі збудження- 450-500 нм, випромінення (емісії)-500-550 нм
- 94. Метод імунофлуоресценції
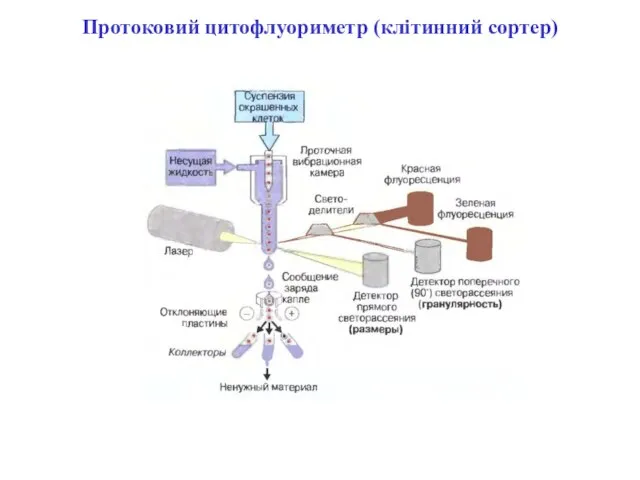
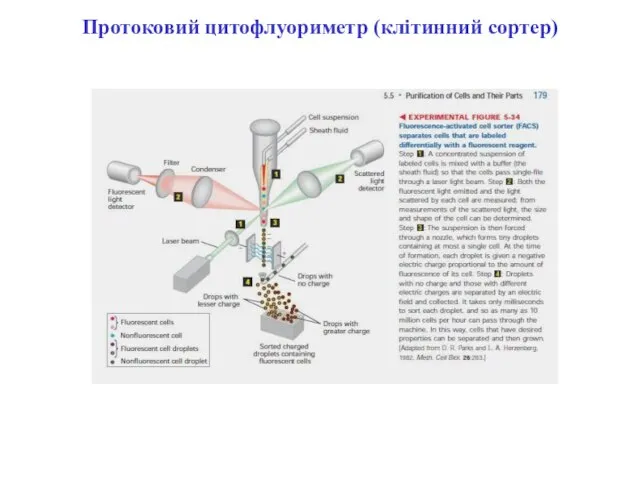
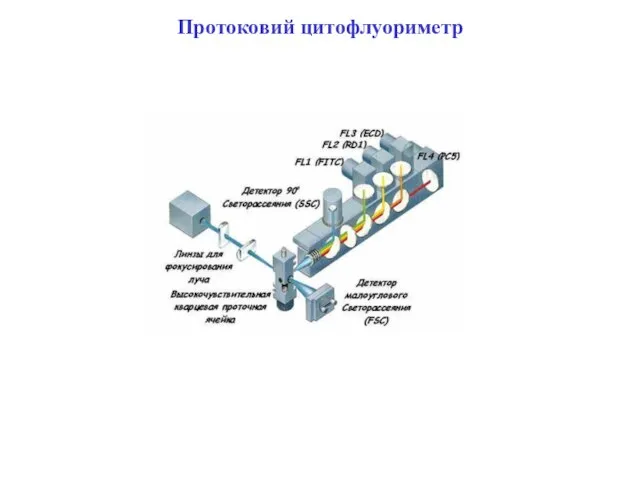
- 95. Протоковий цитофлуориметр (клітинний сортер)
- 96. Протоковий цитофлуориметр (клітинний сортер)
- 97. Протоковий цитофлуориметр
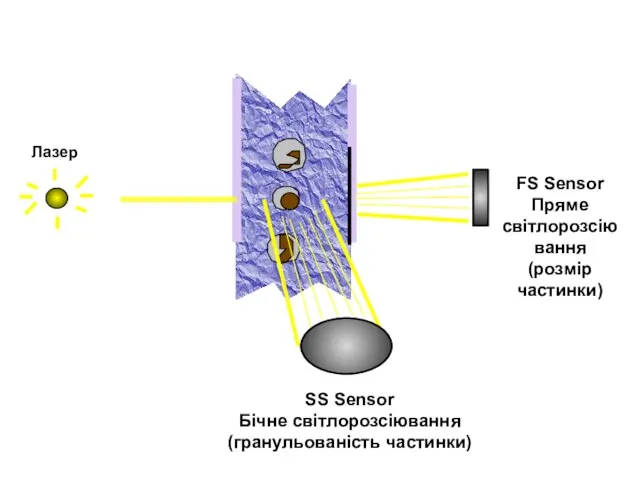
- 98. Світлорозсіювання Клітини, які проходять через лазерний промінь, розсіюють (відбивають) світло Тінь, яку створює клітина, називається прямим
- 100. Пряме світлорозсіювання По значенню сигналу прямого світлорозсівання можна оцінити розмір (тобто об'єм) клітини Великі клітини, наприклад,
- 101. Бічне світлорозсіювання Бічне світлорозсіювання, або ортогональне, є мірою неоднорідності внутрішньої структури клітини (наприклад, зернистості цитоплазми) Нейтрофіли
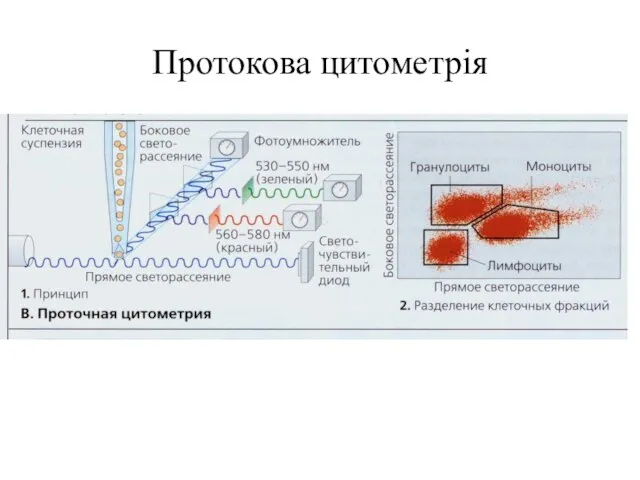
- 102. Протокова цитометрія
- 103. Флуоресценція при протоковій цито(флуоро) метрії та методи її реєстрації При протоковій цитофлуориметрії клітини мітять одним чи
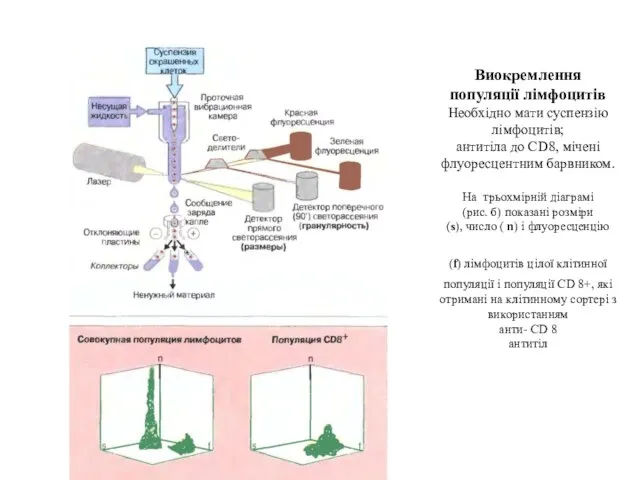
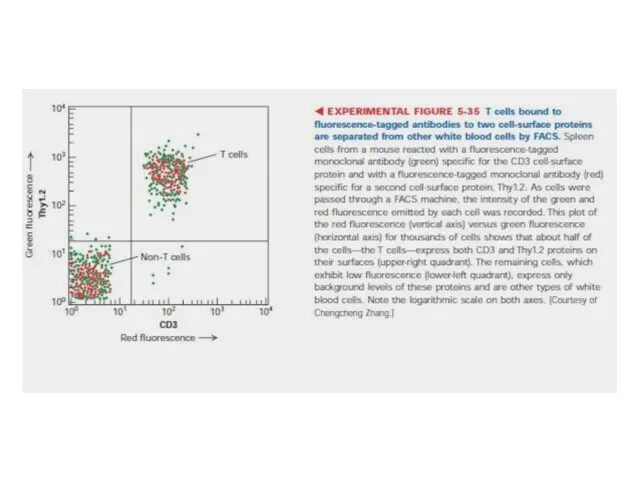
- 104. Виокремлення популяції лімфоцитів Необхідно мати суспензію лімфоцитів; антитіла до CD8, мічені флуоресцентним барвником. На трьохмірній діаграмі
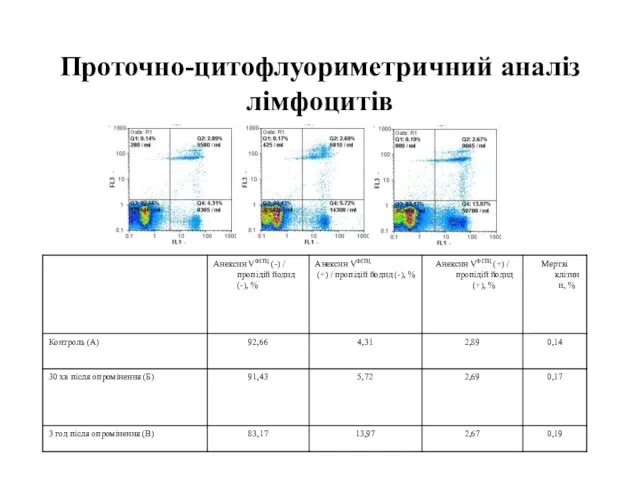
- 106. Проточно-цитофлуориметричний аналіз лімфоцитів
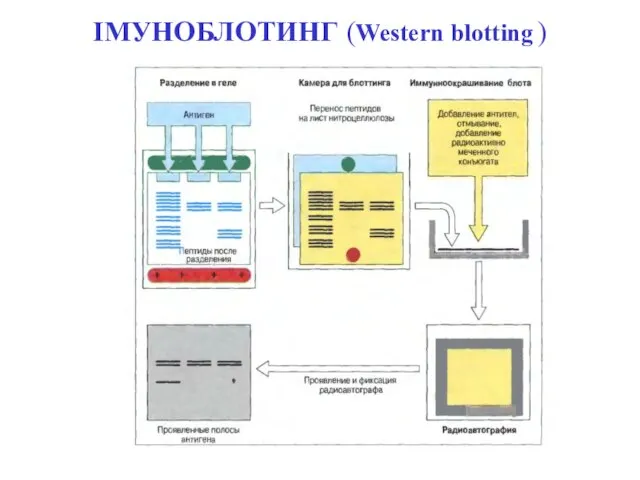
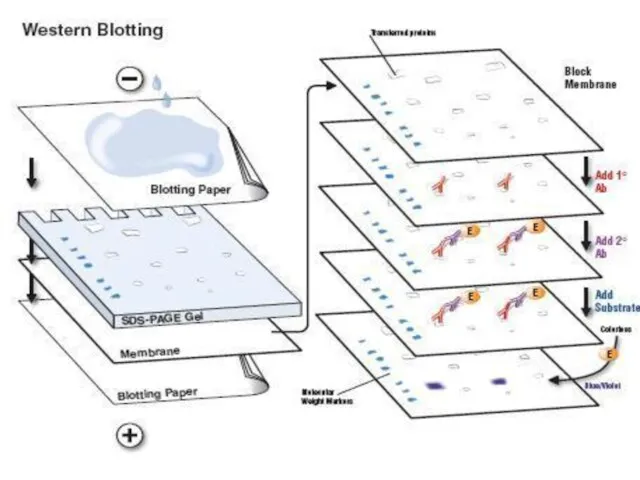
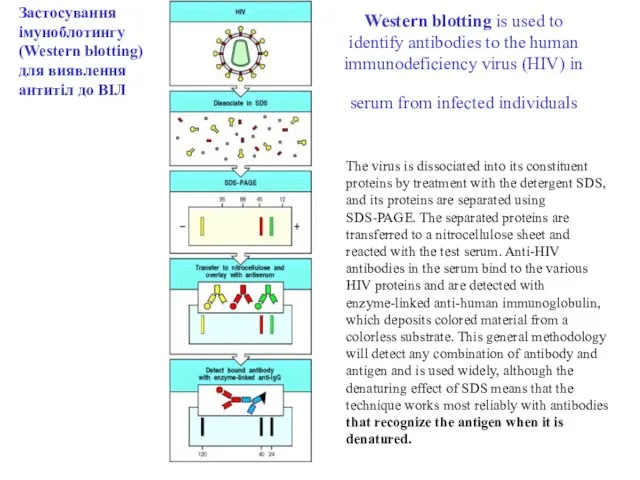
- 107. ІМУНОБЛОТИНГ (Western blotting )
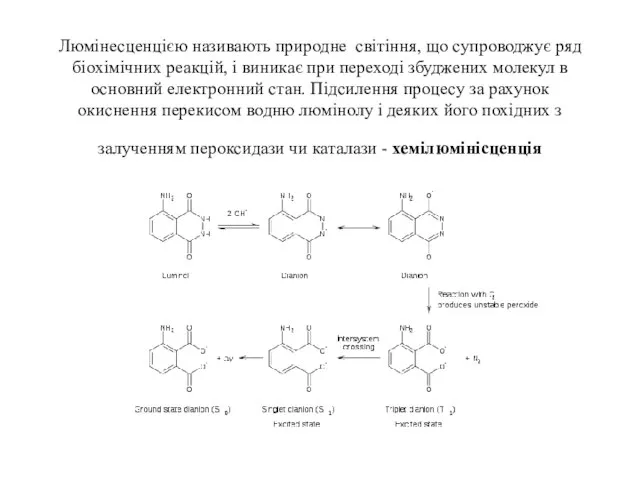
- 109. Люмінесценцією називають природне світіння, що супроводжує ряд біохімічних реакцій, і виникає при переході збуджених молекул в
- 110. Використання хемілюмінесцентних підходів в імуно - блот аналізі Насьогодні широко використовується метод посиленної хемілюмінесценції ECL- метод
- 111. Western blotting is used to identify antibodies to the human immunodeficiency virus (HIV) in serum from
- 112. Western blots of serum samples from two HIV-infected individuals and one control subject
- 113. Всемирная Организация Здравоохранения (ВОЗ, 1991) рекомендует следующую оценку результатов исследований, проведенных методом ИБ, а именно наличие
- 114. Будова вірусу імунодефіциту людини
- 115. Band pattern Interpretation Lane 1, HIV+ serum (positive control) Lane 2, HIV- serum (negative control) Lane
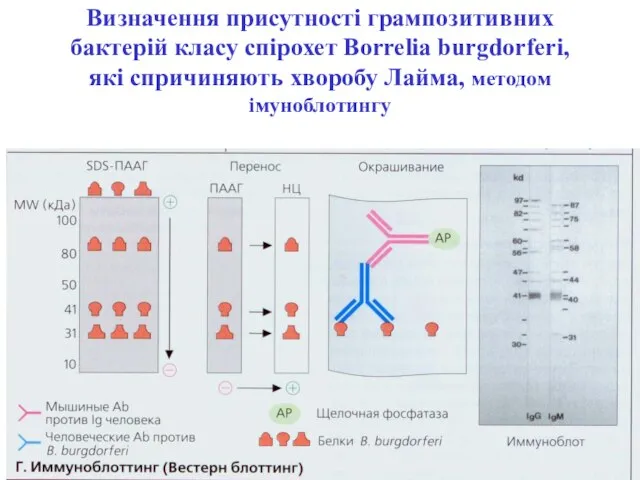
- 116. Визначення присутності грампозитивних бактерій класу спірохет Borrelia burgdorferi, які спричиняють хворобу Лайма, методом імуноблотингу
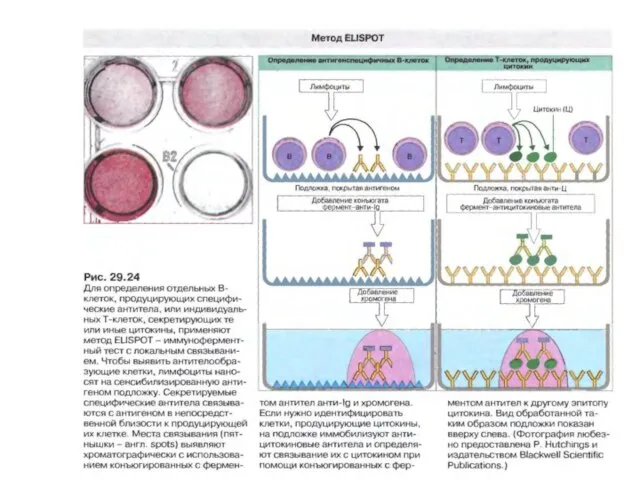
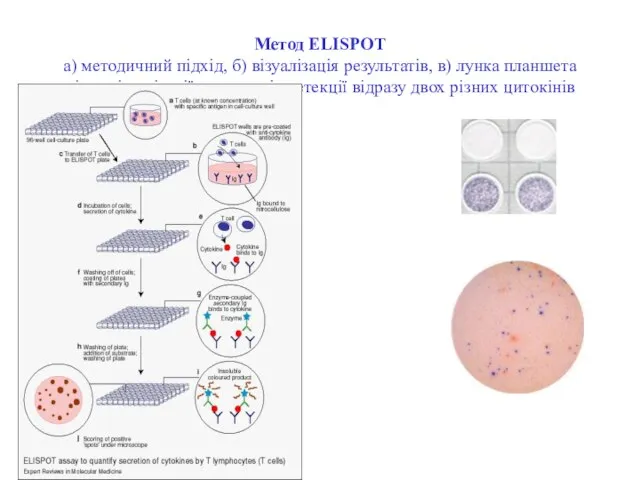
- 118. Метод ELISPOT а) методичний підхід, б) візуалізація результатів, в) лунка планшета після візуалізації результатів детекції відразу
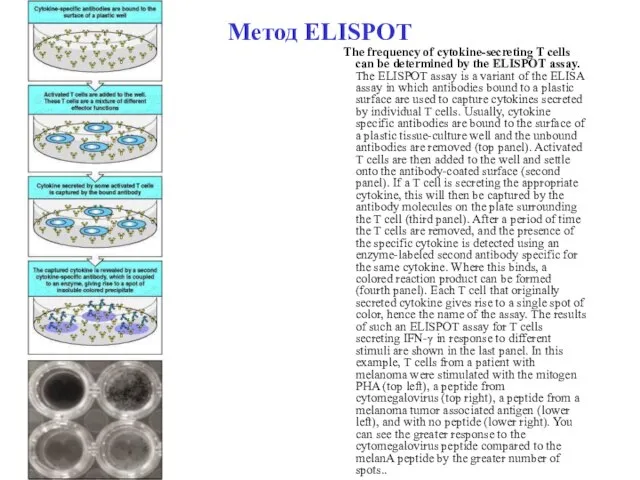
- 119. Метод ELISPOT The frequency of cytokine-secreting T cells can be determined by the ELISPOT assay. The
- 121. Скачать презентацию


![(1) хімічна реакція першого порядку [ АГ ] + [ АТ ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/383670/slide-5.jpg)


![(1) хімічна реакція першого порядку [ АГ ] + [ АТ ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/383670/slide-8.jpg)

![При розрахунку Ка визначають таку концентрацію антигену [АГ]'з , при якій половина](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/383670/slide-10.jpg)



































 HIPAK Kinetic 2400 AF / 2600 AF
HIPAK Kinetic 2400 AF / 2600 AF Прыжок в длину с места
Прыжок в длину с места МКОУ «Приреченская основная общеобразовательная школа Верхнемамонского муниципального района Воронежской области»ЛАГЕРЬ С
МКОУ «Приреченская основная общеобразовательная школа Верхнемамонского муниципального района Воронежской области»ЛАГЕРЬ С  Презентация без названия
Презентация без названия Disaster
Disaster Экзаменационный стресс
Экзаменационный стресс 1
1 Святой праведный старец Феодор Томский
Святой праведный старец Феодор Томский Современное потребление
Современное потребление  Изменение экономической конъюнктуры и эволюция маркетинговых концепций на примере ВТБ24
Изменение экономической конъюнктуры и эволюция маркетинговых концепций на примере ВТБ24 Характер философского знания и задачи философии
Характер философского знания и задачи философии Агентство Соединенных Штатов по Международному Развитию Винрок Интернэшнл
Агентство Соединенных Штатов по Международному Развитию Винрок Интернэшнл Источники права в Грузии
Источники права в Грузии Презентация кабинета химии
Презентация кабинета химии 5 ПСХЭ символы
5 ПСХЭ символы Ослабление влияния помех на аудиоаппаратуру сетевыми фильтрами
Ослабление влияния помех на аудиоаппаратуру сетевыми фильтрами Презентация на тему Отряд Вши
Презентация на тему Отряд Вши  Круглый стол «Социальная активность молодежи в реальном и виртуальном социальном пространстве».
Круглый стол «Социальная активность молодежи в реальном и виртуальном социальном пространстве». Эффект лотоса
Эффект лотоса Гибридизация
Гибридизация Паукообразные 2 класс
Паукообразные 2 класс Нагрузочное тестирование Описание услуг
Нагрузочное тестирование Описание услуг Проектная деятельность
Проектная деятельность Презентация на тему Буллинг
Презентация на тему Буллинг Happy Holidays
Happy Holidays Нейропсихология продаж
Нейропсихология продаж Презентация на тему Как жили на Руси
Презентация на тему Как жили на Руси Вирусы и антивирусы
Вирусы и антивирусы