Содержание
- 2. Теория химической связи Бертоле: в основе химической связи лежит чисто гравитационное притяжение атомов 1748-1822 Теория химической
- 3. Современная теория химической связи ( Г. Льюис, 1916) Возникновение химической связи обусловле-но стремлением атомов элементов к
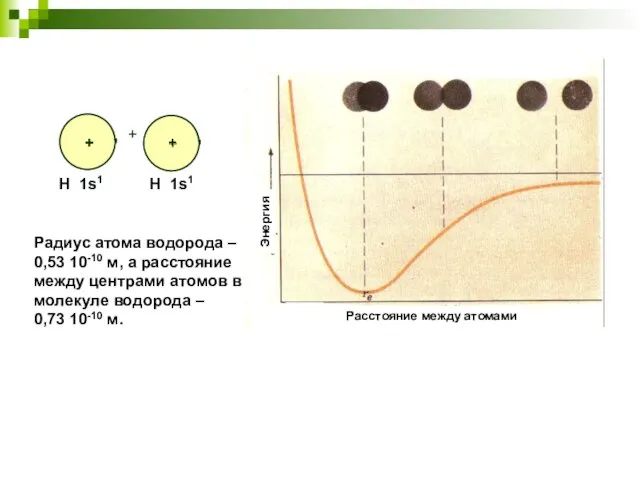
- 4. Радиус атома водорода – 0,53 10-10 м, а расстояние между центрами атомов в молекуле водорода –
- 5. Современная теория химической связи базируется на трех основных методах: метод валентных связей описывает химическую связь чисто
- 6. 4.2. Типы химических связей Тип химической связи определяется характером распре-деления делокализованной электронной плотности меж-ду центрами образующих
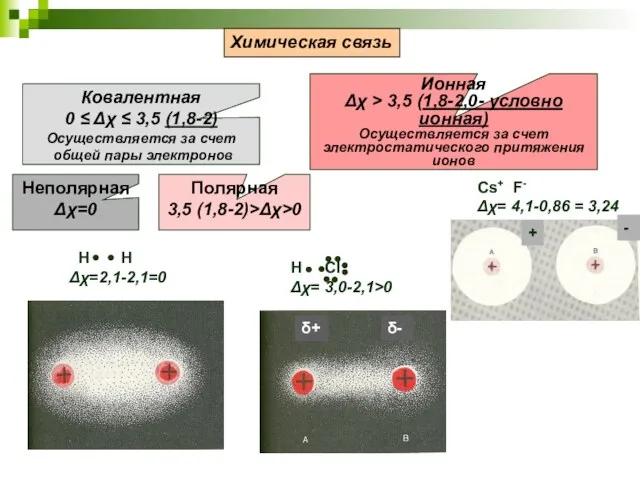
- 7. Cs+ F- Δχ= 4,1-0,86 = 3,24 Химическая связь Ковалентная 0 ≤ Δχ ≤ 3,5 (1,8-2) Осуществляется
- 8. Электроны, принимающие участие в образовании связи называются валентными. Na 1s22s22p63s1 Mg 1s22s22p6 3s2 O 1s22s22p4 As
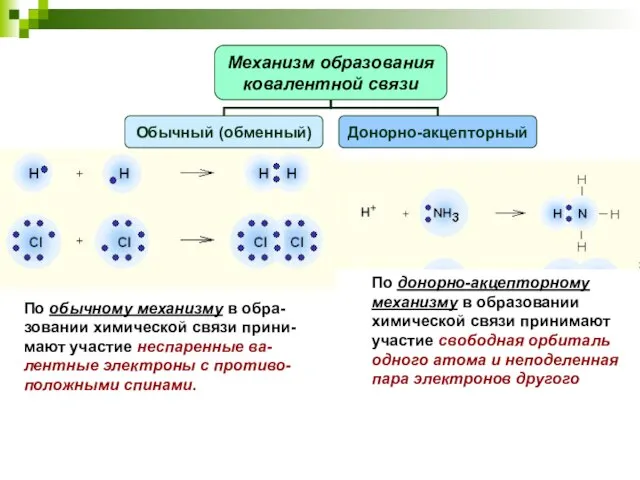
- 9. По обычному механизму в обра-зовании химической связи прини-мают участие неспаренные ва-лентные электроны с противо-положными спинами. По
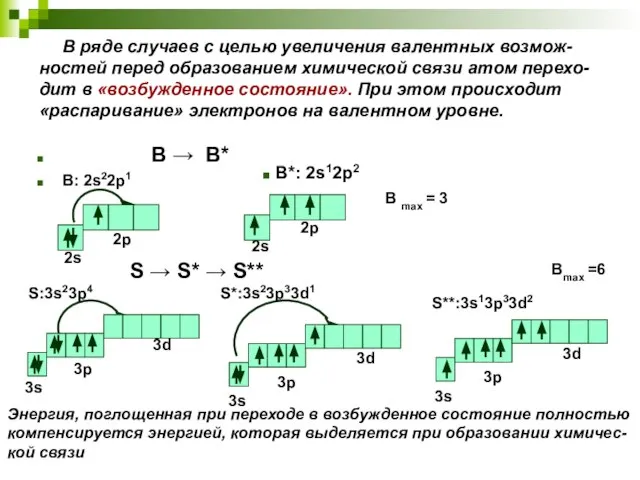
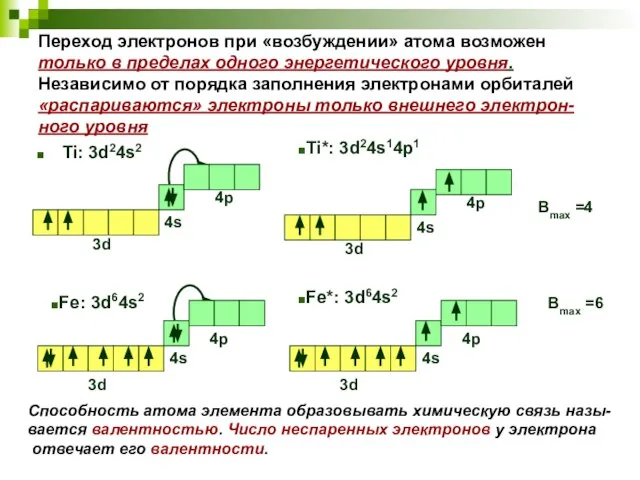
- 10. В ряде случаев с целью увеличения валентных возмож-ностей перед образованием химической связи атом перехо-дит в «возбужденное
- 11. Переход электронов при «возбуждении» атома возможен только в пределах одного энергетического уровня. Независимо от порядка заполнения
- 12. Степень окисления – это условный заряд, который приоб-рел бы атом, если бы валентная пара электронов полнос-тью
- 13. 4.4. Параметры и свойства ковалентной связи Основные параметры ковалентной связи: 1. Длина связи l – это
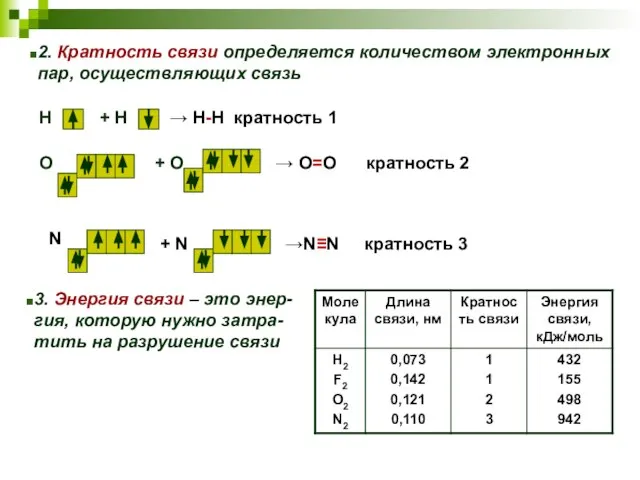
- 14. 2. Кратность связи определяется количеством электронных пар, осуществляющих связь 3. Энергия связи – это энер- гия,
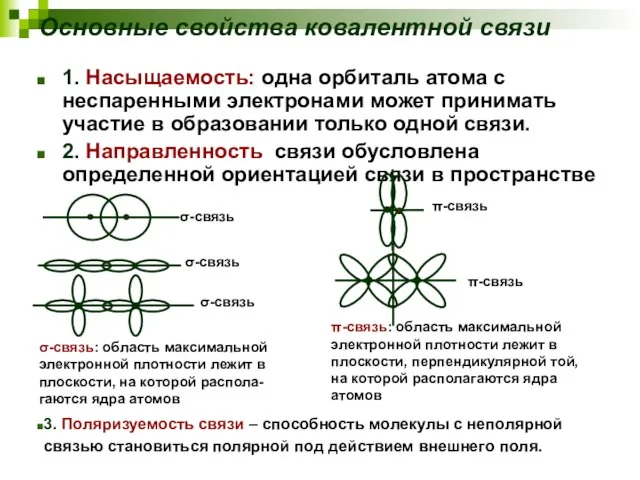
- 15. Основные свойства ковалентной связи 1. Насыщаемость: одна орбиталь атома с неспаренными электронами может принимать участие в
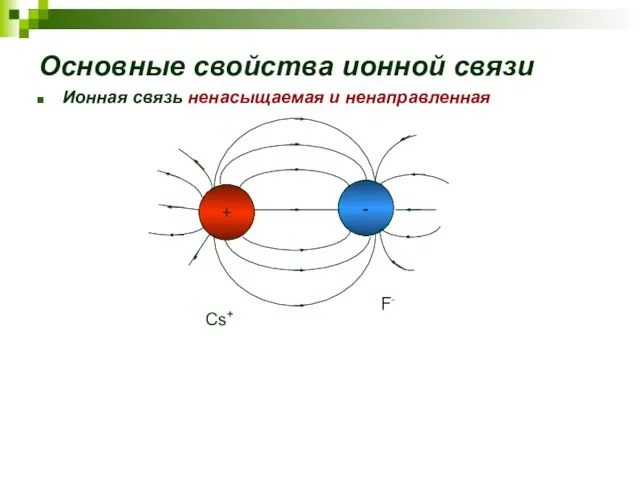
- 16. Основные свойства ионной связи Ионная связь ненасыщаемая и ненаправленная Cs+ F-
- 17. 4.5. Гибридизация орбиталей. Геометрическая форма молекул В молекуле все связи, независимо от того, каким электронами они
- 18. При гибридизации происходит перераспределение электронной плотности, которое требует затрат энергии. В результате гибридизации электронное облако вытягивается
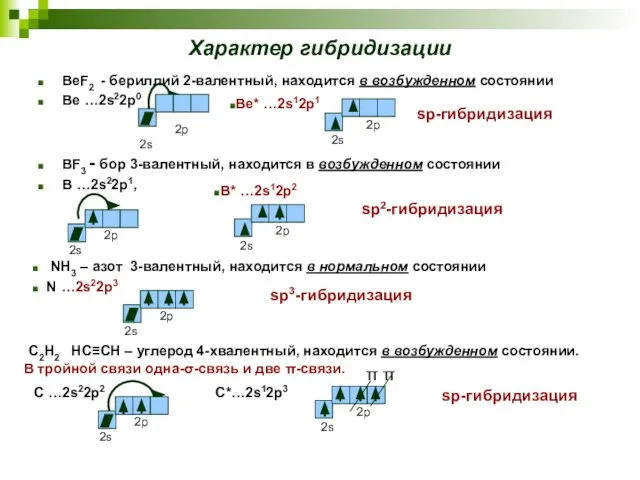
- 19. Характер гибридизации BeF2 - бериллий 2-валентный, находится в возбужденном состоянии Be …2s22p0 BF3 - бор 3-валентный,
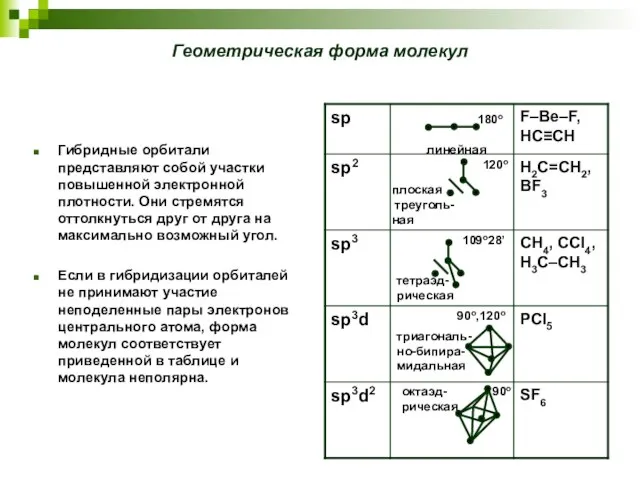
- 20. Геометрическая форма молекул Гибридные орбитали представляют собой участки повышенной электронной плотности. Они стремятся оттолкнуться друг от
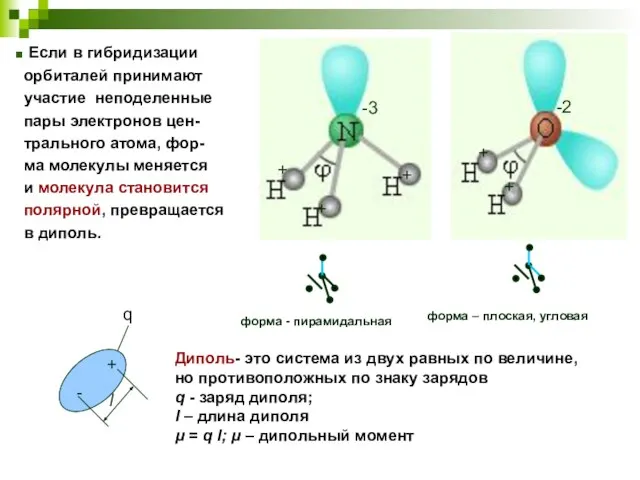
- 21. форма - пирамидальная форма – плоская, угловая Диполь- это система из двух равных по величине, но
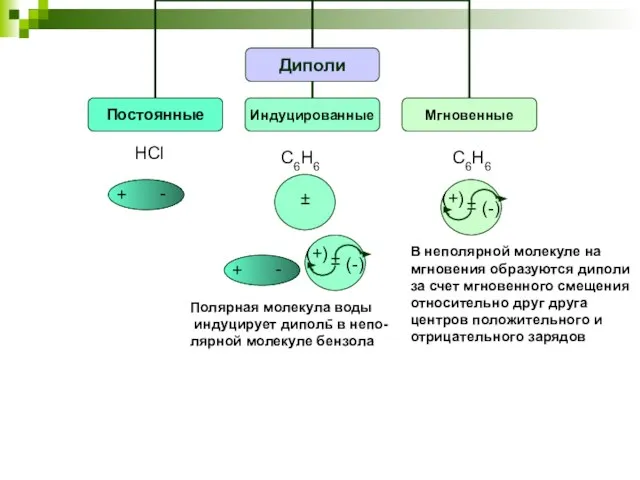
- 22. HCl C6H6 - Полярная молекула воды индуцирует диполь в непо- лярной молекуле бензола C6H6 В неполярной
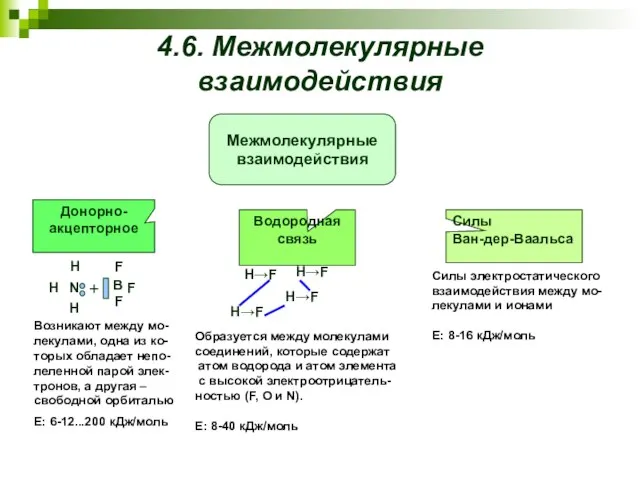
- 23. 4.6. Межмолекулярные взаимодействия Возникают между мо-лекулами, одна из ко-торых обладает непо-леленной парой элек-тронов, а другая –
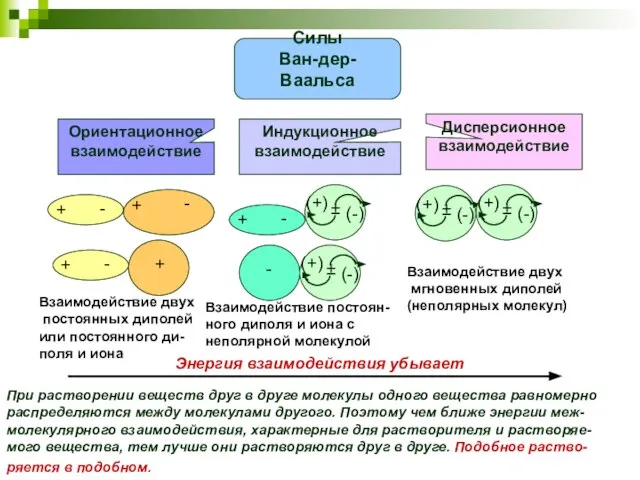
- 24. Взаимодействие двух постоянных диполей или постоянного ди- поля и иона Взаимодействие постоян- ного диполя и иона
- 25. Практическое использование вопросов, связанных с межмолекулярными взаимодействиями при добыче нефти и газа. 1. Осушка природного газа
- 27. Скачать презентацию










 Инфраструктурные инвестиции
Инфраструктурные инвестиции Културен туризъм: международен маркетинг Бележки към кръглата маса организирана от ПП ГЕРБ Асеновград, 23.06.09
Културен туризъм: международен маркетинг Бележки към кръглата маса организирана от ПП ГЕРБ Асеновград, 23.06.09 Pos материалы гербион
Pos материалы гербион Презентация на тему Неофициальные символы России
Презентация на тему Неофициальные символы России CPA launches FOD
CPA launches FOD Методы и приборы разрушающего контроля, применяемые при обследовании
Методы и приборы разрушающего контроля, применяемые при обследовании ЖИЗНЬ И БЫТ В СРЕДНЕВЕКОВОМ ЗАМКЕ
ЖИЗНЬ И БЫТ В СРЕДНЕВЕКОВОМ ЗАМКЕ Презентация компании MOST Marketing«Франчайзинговый пакет: как разработать,чтобы привлечь франчайзи»
Презентация компании MOST Marketing«Франчайзинговый пакет: как разработать,чтобы привлечь франчайзи» Колористика при окрашивании волос. Тест
Колористика при окрашивании волос. Тест Предложение по летнему корпоративному отдыху на стадионе «Труд» (пос. «Старая Купавна»)
Предложение по летнему корпоративному отдыху на стадионе «Труд» (пос. «Старая Купавна») Греческая вазопись
Греческая вазопись Холод в нефтянной промышленности
Холод в нефтянной промышленности Урок-путешествие по разделу «Были-небылицы». Оценка достижений
Урок-путешествие по разделу «Были-небылицы». Оценка достижений LobbyWorks
LobbyWorks Самоиндукция
Самоиндукция Correct сommunication. Правильное общение
Correct сommunication. Правильное общение Тема: «Положение человека в системе животного мира. Эволюция гоминид».
Тема: «Положение человека в системе животного мира. Эволюция гоминид». Презентация на тему Выживание в природных условиях после аварии
Презентация на тему Выживание в природных условиях после аварии  ангелы
ангелы Интеллектуально-познавательная игра
Интеллектуально-познавательная игра Анализ применимости ПИК «СтОФ» для массовой оценки стоимости движимого имущества Тевелева Оксана Валерьевна тел: (499) 724-15-14, 8(903)208-
Анализ применимости ПИК «СтОФ» для массовой оценки стоимости движимого имущества Тевелева Оксана Валерьевна тел: (499) 724-15-14, 8(903)208- Fruit and vegetables
Fruit and vegetables Ты подвиг совершил во имя жизни на земле
Ты подвиг совершил во имя жизни на земле Обязательства из односторонних сделок и из действий в чужом интересе. Обязательства из договоров, не подлежащие судебной защите
Обязательства из односторонних сделок и из действий в чужом интересе. Обязательства из договоров, не подлежащие судебной защите ТВ - тюнеры
ТВ - тюнеры Применение программного комплекса CorPos (FORCE Technology Norway AS) для диагностики и прогнозирования коррозии на внутренних стенках газопров
Применение программного комплекса CorPos (FORCE Technology Norway AS) для диагностики и прогнозирования коррозии на внутренних стенках газопров Евгений Замятин
Евгений Замятин Characteristic of grain mass
Characteristic of grain mass