Содержание
- 2. Биогенные элементы -элементы, необходимые организму для построения и жизнедеятельности клеток и органов
- 3. Классификация биогенных химических элементов
- 9. Классификация абиогенных химических элементов
- 13. Элементы в природе и организме Академик В. Вернадский писал: «Для понимания сложнейших жизненных процессов их надо
- 14. На основании анализа горных пород установлено, что в биосферу (лито-, гидро- и атмосферу) входят около 90
- 15. Структурные образования живой клетки включают в себя всего 6 биогенных элементов: С, Н, О, N, P,
- 16. По В. Вернадскому, средний химический состав человека включает примерно 80 элементов, из них макроэлементы: О, С,
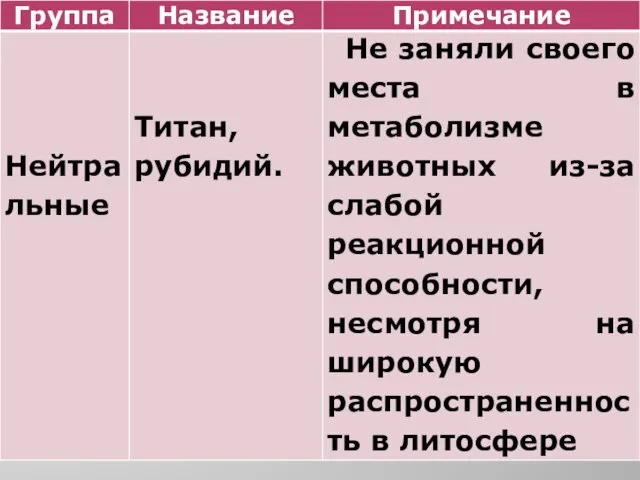
- 17. Больше всего в организме легких элементов. Возрастание атомной массы в ПСЭ увеличивает токсичность элементов и снижает
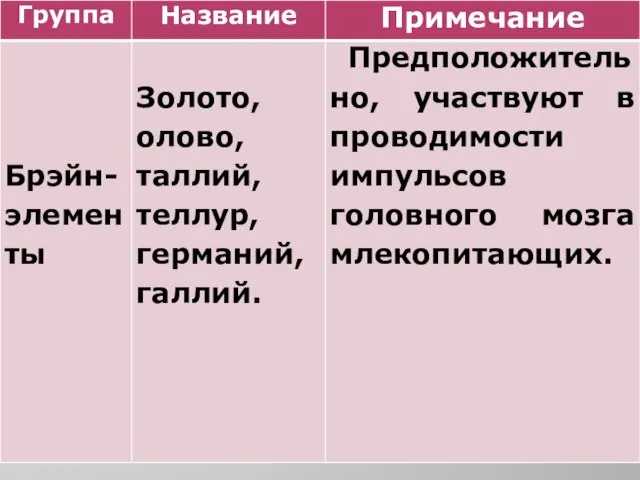
- 18. В. Ковальский создал раздел биологии- геохимическую экологию, изучающую взаимоотношения организма с окружающей средой. Геохимическая экология изучает
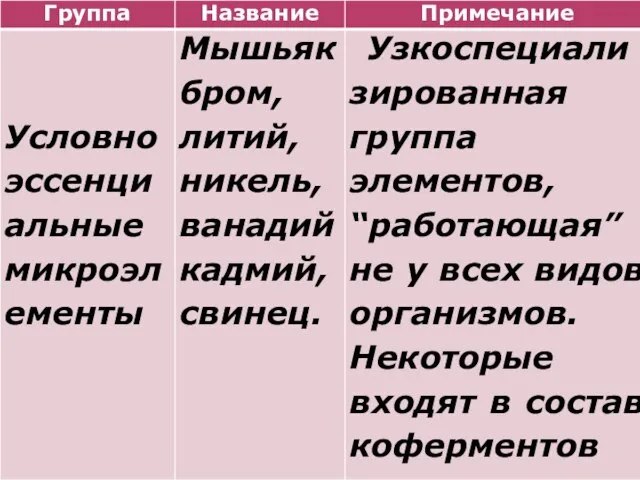
- 19. Однако часть организмов (5 – 20 %) в этих условиях заболевают. Например, жители горных районов часто
- 20. Отдельные элементы, которые характеризуются небольшим содержанием, концентрируются в определенных частях организма. Так, значительно содержание Сu -
- 21. Биологическая роль химических элементов в организме Биологическая роль элементов в организме человека чрезвычайно разнообразна. Главная функция
- 22. Микроэлементы, входят в состав ферментов, гормонов, витаминов, биологически активных веществ в качестве комплексообразователей (активаторов), участвуют в
- 23. Содержание некоторых элементов в организме человека меняется с возрастом. Так, содержание Cd в почках и Мо
- 24. Кроме шести основных макроэлементов (С, Н, О, N, P, S) из которых состоят углеводы, жиры, белки
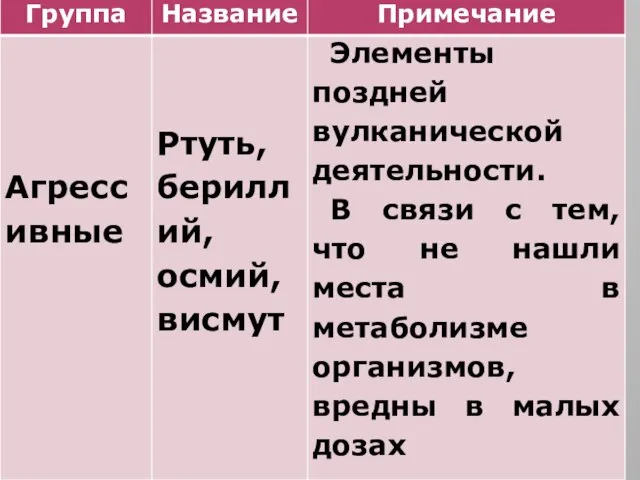
- 25. Недостаток и избыток элементов в организме одинаково вреден. Ряд элементов (Ag, Hg, Pb, Cd и др.)
- 26. s-элементы s-Элементы - это элементы, у атомов которых электронами заселяются s-подуровни внешнего уровня. Сокращенная электронная формула
- 27. Свойства s-элементов Легко отдают валентные s-электроны, проявляя сильные восстановительные свойства. Типичные металлы, обладают блеском, высокой электрической
- 28. Как правило, образуют соединения с ионным типом связи, исключение составляет водород, для которого наиболее характерна ковалентная
- 29. Водород в виде соединений (белки, жиры, углеводы и др.) входят в состав всех организмов. Он отвечает
- 30. Вода - составная часть организма. У взрослых содержание её в организме составляет 60%, у детей эта
- 31. Вода поддерживает состояние кислотно-основного равновесия, а также осмотическое, гемодинамическое и термическое равновесие в организме. Вода используется
- 32. Бериллий постоянно находится в растениях и организме животных. Он является ультрамикроэлементом, содержание в организме ~ 10-7
- 33. Кальций относится к макроэлементам, содержание в организме 1,4%. Основная масса находится в костной и зубной тканях.
- 34. Барий Ва - микроэлемент, содержание в организме 10-5 %. Концентрируется, в основном, в сетчатке глаза. Биологическая
- 35. р-элементы р-Элементы - это элементы, у атомов которых происходит заполнение электронами р - подуровня внешнего уровня.
- 36. Свойства р-элементов В группах радиусы атомов и однотипных ионов, в общем, увеличиваются. Энергия ионизации при переходе
- 37. Свойства р-элементов В периодах слева направо атомные и ионные радиусы р - элементов по мере увеличения
- 38. IIIА - группа Бор относится к примесным микроэлементам, его массовая доля в организме человека составляет 10-5
- 39. Избыток В вреден для организма человека. В угнетает ферменты амилазы, протеиназы, уменьшает активность адреналина. Является необходимым
- 40. Алюминий А1 относится к примесным элементам (10-5 %). А1 концентрируется главным образом в сыворотке крови, легких,
- 41. Галлий Ga — примесный микроэлемент. Биологическая роль не установлена. Таллий Тl — весьма токсичный элемент.
- 42. IVA группа Углерод С. По содержанию в организме человека (21,15%) С относится к макроэлементам. Он входит
- 43. Кремний Si. По содержанию в организме человека Si относится к примесным микроэлементам. Больше всего Si в
- 44. В стоматологической практике применяют карборунд SiC для шлифовки пломб и пластмассовых протезов. SiO2 входит в состав
- 45. Германий Ge относится к микроэлементам, содержание в организме человека — 10-5 — 10-6 %. Биологическая роль
- 46. Олово. Sn по содержанию в организме человека (10-4%) относятся к микроэлементам. Сведения о биологической роли противоречивы.
- 47. Свинец. Рb и его соединения, особенно органические, весьма токсичны, Соединения Рb влияют на синтез белка, энергетический
- 48. VA – группа Азот N по содержанию в организме человека (3,1%) относится к макроэлементам. Этот элемент
- 49. Фосфор Р содержится в организме человека 0,95%. Р относится к макроэлементам. Это органоген и играет исключительно
- 50. Мышьяк As по содержанию в организме человека составляет 10-6 % и относится к микроэлементам. Он концентрируется
- 51. Сурьма Sb и висмут Bi. По содержанию в организме Sb и Bi (10-5 %) относятся к
- 52. VIA-группа Кислород O. По содержанию в организме человека (62%) О относится к макроэлементам. Он незаменим и
- 53. Большинство окислительно-восстановительных реакций в организме протекает при участии О и его активных форм. Фагоцитарные (защитные) функции
- 54. Озон О3 как очень сильный окислитель используют для дезинфекции помещений, обеззараживания воздуха, очистки питьевой воды. Сера
- 55. Образующаяся в организме эндогенная H2SO4 участвует в обезвреживании ядовитых соединений - фенола, крезола, индола, вырабатываемых в
- 56. Селен Se. По содержанию в организме ( 10-5 – 10-7 %) Se относится к микроэлементам. Se
- 57. Теллур Te и полоний Po. Те обнаружен в живых организмах. Норма его содержания в тканях и
- 58. VIIA - группа По содержанию в организме человека С1 (0,15%) относится к макроэлементам, остальные элементы этой
- 59. Фтор F. Масса F в организме человека составляет около 7 мг (~10-5 %). Соединения фтора концентрируются
- 60. Фторид-ион легко замещает гидроксид-ион в гидроксиапатите, образуя защитный эмалиевый слой более твердого фторапатита: Са10(РО4)6(ОН)2 + 2F-
- 61. Кариес зубов начинается на поврежденном участке эмали с появлением пятна. Под действием кислот, вырабатываемых бактериями, происходит
- 62. Обогащение питьевой воды F, то есть фторирование воды с целью доведения содержания в ней F до
- 63. Применение NaF основано на образовании фторапатита: 2NaF + Ca10(PO4)6(OH)2 = 2NaOH + Са10 (РО4)6F2 . При
- 64. Хлор Cl. В организме человека содержится примерно 0,15%. Хлорид-ионы играют важную биологическую роль. Они активируют некоторые
- 65. Хлорид-ион имеет оптимальный радиус для проникновения через мембрану клеток. Именно этим объясняется его совместное участие с
- 66. Бром Br. Масса брома в организме человека составляет около 10-5 %. Он локализуется преимущественно в железах
- 67. При введении в организм бромид-ионов наиболее чувствительной оказывается центральная нервная система. Бромид-ионы накапливаются в различных отделах
- 68. Бромид-ионы могут замещать ионы Сl- и I- в организме. Примером такого взаимозамещения является замещение йода бромом
- 69. Бромид-ионы легко всасываются в желудочно-кишечном тракте. Токсичность бромид-ионов невысока. Однако вследствие медленного выведения из организма (30-60
- 70. Йод I относится к числу незаменимых биогенных элементов. Его соединения играют важную роль в процессах обмена
- 71. Пониженная активность щитовидной железы (гипотиреоз) может быть связана с уменьшением её способности накапливать йодид-ионы, а также
- 72. d-элементы d-Элементы - это элементы, у атомов которых происходит заселение электронами d-подуровня второго снаружи уровня. К
- 73. Свойства d-элементов В периодах с увеличением заряда ядра возрастание радиуса атомов происходит медленно, непропорционально числу электронов,
- 74. Свойства d-элементов В результате экранирования этим слоем с увеличением номера элемента атомный радиус, энергия ионизации, а,
- 75. Свойства d-элементов Все атомы d-блока, за исключением группы I Б и II Б, имеют незавершенный d-подуровень.
- 76. Свойства d-элементов В растворах d-элементы с высшей степенью окисления представлены анионами, как правило, кислородсодержащими. При этом
- 77. Свойства d-элементов В периоде с увеличением заряда ядра уменьшается устойчивость соединений с высшей степенью окисления элементов.
- 78. 1Б группа Медь Cu является необходимым элементом растительных и животных организмов. В организме человека содержится около
- 79. Серебро Ag — микроэлемент растительных и животных организмов. В организме человека содержится -7,3 ммоль Ag. Концентрируется
- 80. Бионеорганические комплексы Ag с белками — протеинаты, представляют собой коллоидные растворы. Коллоидные препараты Ag не вызывают
- 81. Из соединений Ag наиболее известны протаргол (белковый комплекс Ag) и колларгол (коллоидное Ag). В небольшом количестве
- 82. II Б группа Цинк Zn, кадмий Cd, ртуть Hg - микроэлементы живых организмов. Zn содержится в
- 83. Cd и Hg обнаруживаются в печени и почках как примесные микроэлементы. Cd в виде белкового комплекса
- 84. Хром Cr, молибден Mo, вольфрам W являются микроэлементами живых организмов. Хром относится к биогенным элементам, содержащимся
- 85. Вольфрам как микроэлемент мало изучен, и как все тяжелые металлы не играет большой роли в живых
- 86. VII Б группа Марганец Мn, технеций Те, рений Re - элементы - аналоги, образующие VII Б-группу.
- 87. Марганец - один из десяти металлов жизни, является важным биогенным элементом. В органах и тканях взрослого
- 88. VIII Б группа Группу VIII Б составляют девять d-элементов: Fе, Co, Ni, Ru, Rh, Pd, Os,
- 89. Семейство железа Fe, Co, Ni, хотя и отличаются числом внешних электронов, тем не менее имеют близкие
- 90. И только небольшое увеличение электроотрицательности свидетельствует о том, что от Fe к Ni имеет место уменьшение
- 91. Железа Fe в организме человека содержится ~5 г. Большая часть его сосредоточена в гемоглобине крови (~
- 92. Одним из наиболее важных внутрикомплексных соединений является гемоглобин. Сложный по составу белок, содержащий и небелковую группу
- 93. Кобальт Со в роли микроэлемента выполняет разнообразные функции. В организме он представлен в виде витамина В12.
- 94. Семейство платины К семейству Pt относят шесть d-элементов VIII Б -группы. В природе они рассеяны и
- 95. В ПСЭ платиновые металлы расположены в V и VI периодах. У всех платиновых металлов при заполнении
- 96. Платиновые металлы VI периода вследствие лантаноидного сжатия имеют практически одинаковые радиусы, которые очень мало отличаются от
- 97. Относительно небольшие радиусы атомов и большая стабильность d-подуровня определяют низкую химическую активность платиновых металлов. В электрохимическом
- 99. Скачать презентацию




























































































 Концепция многоуровневой системы образования в области традиционной народной культуры
Концепция многоуровневой системы образования в области традиционной народной культуры Словарь по Обществознанию
Словарь по Обществознанию Этапы работы над правилом- ступенька к грамотности
Этапы работы над правилом- ступенька к грамотности Сущность и принципы корпоративного управления
Сущность и принципы корпоративного управления Подстраховка и зоны компетенции. По материалам зарубежных публикаций: Flavio Berardi, Andrea Asta
Подстраховка и зоны компетенции. По материалам зарубежных публикаций: Flavio Berardi, Andrea Asta Звери зоопарка
Звери зоопарка Система регистрации журналов для библиотек ЦБС БЕН РАН
Система регистрации журналов для библиотек ЦБС БЕН РАН здоровье
здоровье МЕНЮ НА НЕДЕЛЮ 4
МЕНЮ НА НЕДЕЛЮ 4 Понятие и виды юридической ответственности
Понятие и виды юридической ответственности Общая психология. Тест по темам: воображение, мышление, речь, внимание
Общая психология. Тест по темам: воображение, мышление, речь, внимание Муса Джалиль
Муса Джалиль Синтетические моющие средства
Синтетические моющие средства Аудитория Уанетамарт 2009 г.
Аудитория Уанетамарт 2009 г. Отрасли права. Онлайн-школа Sattarovfamily
Отрасли права. Онлайн-школа Sattarovfamily АЛЛИЛУЙЯ Я знаю теперь ту струну и смычок, Что играл Давид, и его слушал Бог. Плевать тебе на музыку любую. И все одно, Хоть в дверь, хо
АЛЛИЛУЙЯ Я знаю теперь ту струну и смычок, Что играл Давид, и его слушал Бог. Плевать тебе на музыку любую. И все одно, Хоть в дверь, хо Нарушение технологии строительства гимназии с точки зрения физики и экономики: проблемы и решения
Нарушение технологии строительства гимназии с точки зрения физики и экономики: проблемы и решения Otchetnaya_prezentatsia_po_proizvodstvennoy_tekhnologicheskoy_proektno-tekhnologicheskoy
Otchetnaya_prezentatsia_po_proizvodstvennoy_tekhnologicheskoy_proektno-tekhnologicheskoy Литургия верных
Литургия верных Уральское таможенное управление_
Уральское таможенное управление_ Роль родителей в нравственном воспитании своих детей
Роль родителей в нравственном воспитании своих детей Государства Востока: традиционное общество в эпоху раннего Нового времени
Государства Востока: традиционное общество в эпоху раннего Нового времени Спортивно-игровой комплекс
Спортивно-игровой комплекс Учимся быть пешеходами
Учимся быть пешеходами Закрепление изученных орфограмм
Закрепление изученных орфограмм SnappFood. Effective communication
SnappFood. Effective communication Презентация на тему Welcome to London
Презентация на тему Welcome to London Система французских бесшовных натяжных потолков “ALYOS” www.alyos.ru www.lider-potolok.ru
Система французских бесшовных натяжных потолков “ALYOS” www.alyos.ru www.lider-potolok.ru