Слайд 2Основные минералы
боксит
Al2O3·H2O
каолинит
Al2O3·2SiO2·2H2O
алунит
(Na,K)2SO4·Al2(SO4)3·4Al(OH)3
корунд
Al2O3

Слайд 3Получение
электролитическое восстановление

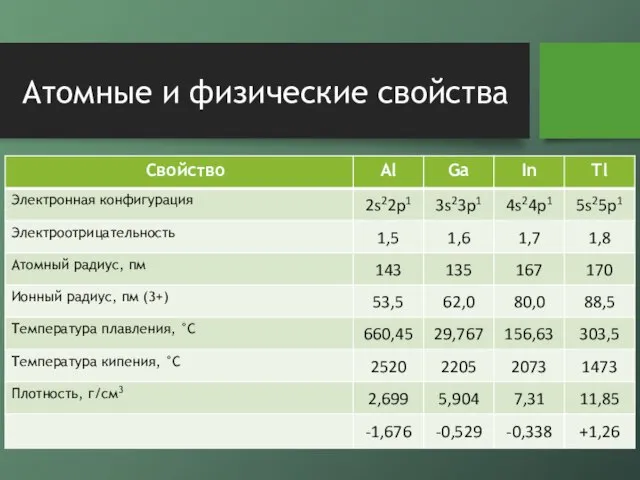
Слайд 4Атомные и физические свойства
Слайд 5Алюминий
устойчив к коррозии благодаря образованию прочной тонкой оксидной пленки
после удаления пленки медленно

реагирует с водой
растворяется в разбавленных растворах минеральных кислот, но пассивируется концентрированной HNO3
растворяется в растворах и расплавах щелочей
высокочистый алюминий совершенно пассивен к действию кислот
Слайд 6Оксиды и гидроксид алюминия
α-форма (корунд) – очень твердое и нереакционноспособное вещество, при

нагревании до 2000°С переходит в реакционноспособную γ-форму
Слайд 7Оксиды и гидроксид алюминия
имелись сведения о получении β-формы, но на самом деле

она представляет собой Na2O·6Al2O3
гидроксид (α-форму, байерит) получают пропусканием CO2 через щелочной раствор алюмината на холоду
γ-форма (гиббсит) получается при выдерживании α-формы в водном растворе алюмината при 80°С
при нагревании (1800°С) оксида алюминия (III) с кремнием образуется газообразный Al2O
Слайд 8Алюминаты
β-алюминат натрия (NaAl11O17) является твердым электролитом, обладая высокой ионной проводимостью
другие алюминаты (например,

NaAlO2) используют при очистке воды, производстве бумаги, цеолитов, керамики и катализаторов для нефтеперерабатывающей промышленности
Слайд 9Галогениды алюминия
моногалогениды получаются при реакции тригалогенидов с алюминием при 1000°С в виде

двухатомных короткоживущих структур
тригалогениды получают галогенированием металла или при взаимодействии гидрогалогенидов с оксидом или гидрокисдом алюминия
Слайд 10Галогениды алюминия
безводные галогениды нельзя получить дегидратацией солей из-за присутствия устойчивых катионов [Al(OH2)6]3+
хлорид

алюминия димерен в газовой фазе, бромид и иодид димерны даже в твердом состоянии
тригалогениды являются сильными кислотами Льюиса
это свойство позволяет получать аддукты различного состава, например, Cl3Al·OEt2, Br6Al2·C6H6 и др.
Слайд 11Галогениды алюминия
в реакции хлорида N-бутилпиридиния с AlCl3 при 25°С образуется электропроводящая жидкость
такие
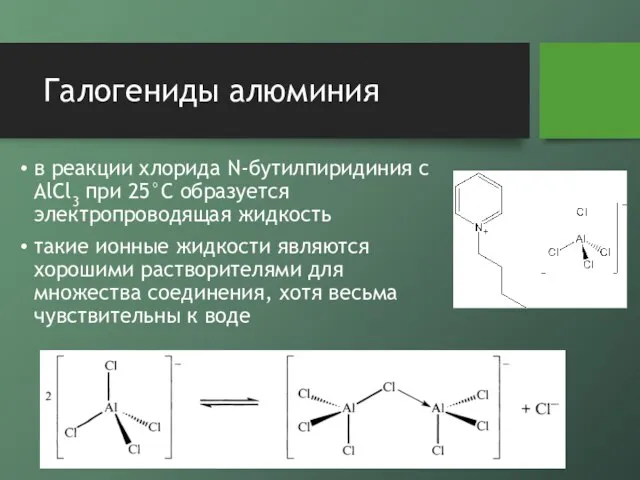
ионные жидкости являются хорошими растворителями для множества соединения, хотя весьма чувствительны к воде
Слайд 12Галлий, индий, таллий
мягкие серебристые, сравнительно реакционноспособные металлы, легко растворяющиеся в кислотах (кроме

таллия)
жидкий галлий хорошо смачивает стекло (образуя отличную зеркальную поверхность), фарфор и большинство других поверхностей (кроме кварца, графита и тефлона)
индий и таллий не растворяются в растворах щелочей в отличие от галлия
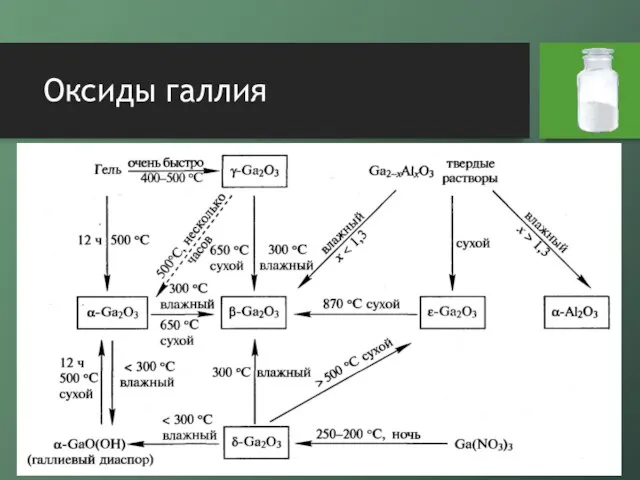
Слайд 14Оксиды галлия
оксид галлия (I) относительно стабилен, представляет собой темно-коричневый диамагнитный порошок
он

получается при нагревании оксида галлия (III) с галлием при 700°С, при реакции галлия с углекислым газом или диоксидом кремния
выше 800°С диспропорционирует
проявляет сильные восстановительные совйстваа
Слайд 15Гидроксид галлия, галлаты
по свойствам очень похож на гидроксид алюминия
при нагревании оксида галлия

с оксидами металлов образуются галлаты разного состава MIGaO2, MIIGa2O4, MIIIGaO3
Слайд 16Галогениды галлия (III)
фторид получают из других галогенидов или разложением (NH4)3[GaF6] или [GaF3(NH3)3]
![Галогениды галлия (III) фторид получают из других галогенидов или разложением (NH4)3[GaF6] или](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/366784/slide-15.jpg)
в отсутствие влаги
по свойствам очень похож на фторид алюминия
хлорид и бромид обычно получают прямым синтезом при горении металла в галогене
иодид галлия получают кипячением галлия в растворе иода в сероуглероде
Слайд 17Галогениды галлия (III)
бесцветные кристаллические гигроскопичные вещества
в твердом и жидком состояниях димерны
кислоты Льюиса,

образуют аддукты с электронодонорными молекулами (ТГФ, эфиры и т. д.)
Слайд 18Галогениды галлия (I) и (II)
известны все 4 галогенида GaX
образуются при термическом разложении

тригалогенидов
при нагревании тригалоенидов с галлием образуются более стабильные частицы “GaX2”
дигалогениды растворимы в бензоле, взаимодействуют с донорными лигандами, образуя соединения со связью Ga(II)—Ga(II)
в водных растворах являются хорошими восстановителями по отношению, например, к [I3]-, Br2, [Fe(CN)6]3-, [Fe(bpy)3]3+
Слайд 19Оксиды индия
существует 2 оксида индия
трехвалентный оксид получается при сгорании индия на воздухе

(фиол. пламя) или при разложении солей и гидроксида
при температуре выше 1200°С диссоциирует с образованием черного In2O
In2O можно получить при восстановлении In2O3 водородом при 400°С
In2O3 (желтый) проявляет слабо амфотерные свойства в отличие от основного In2O
Слайд 20Гидроксид индия
получается в виде желеобразного осадка из растворов солей In3+
плохо растворяется в

воде и аммиаке, но хорошо в кислотах и щелочах (образуя тетра- и октаэдрические комплексы)
Слайд 21Галогениды индия (III)
легко получаются при растворении металла в кислотах
безводные фторид и хлорид

(б/цв.) получают пропуская галоген над смесью оксида с углем
бромид и иодид (желтые) получают прямым синтезом
все галогениды очень гигроскопичны
кислоты Льюиса, образуют аддукты, например, InCl3(ТГФ)2
[NEt4]2[InCl5]
Слайд 22Соединения индия (I) и (II)
In+ можно получить при реакции амальгамы индия с

трифлатом серебра в сухом ацетонитриле без доступа кислорода при комнатной температуре
при нагревании тригалогенидов с металлом образуются аналогичные галлию соединения
двухвалентные соединения обычно димерны
Слайд 23Оксиды и гидроксиды таллия
известно 2 оксида Tl2O (черный) и Tl2O3 (темно-коричневый)
Tl2O образуется

при разложении гидроксида или карбоната таллия (I)
Tl2O гигроскопичен и хорошо растворяется в воде, образуя гидроксид (желтый)
при нагревании оксида на воздухе образуется Tl2O3
также получается при окислении Tl+ пероксидом водорода или хлором
Tl2O3 нерастворим в воде, но растворим в кислотах
Слайд 24Оксиды и гидроксиды таллия
оксид таллия (III) проявляет окислительные свойства
гидроксид таллия (III) получается

в виде гидрата оксида при окислении Tl+ в щелочной среде
при нагревании оксида таллия (III) с оксидами или карбонатами ЩМ в токе кислорода получаются таллаты
Слайд 25Галогениды таллия (I)
известны все 4 галогенида
похожи на галогениды серебра (восприимчивы к свету)
при

добавлении небольших количеств галогенидов таллия к растворам галогенидов ЩМ наблюдается голубая люминесценция
связь в галогенидах имеет ионный характер, что сказывается на их растворимости в воде
соединение TlI3 — иодид таллия (I)
Слайд 26Галогениды таллия (III)
известны 3 нестабильных галогенида
Tl3+ сильно гидролизуется
трифторид получают фторированием Tl2O3 фтором,

трифторидом брома или тетрафторидом серы при 300°С
трихлорид и трибромид получают окислением моногалогенидов соответствующим галогеном
из водных растворов кристаллизуются тетрагидраты
безводные галогениды не получают термической дегидратацией
Слайд 27Токсичность соединений таллия
замещает калий в биохимических процессах
летальная доза лежит в пределах 10-50

мг/кг
НО таллий – кумулятивный яд
через 1-5 дней появляется повышенная секреция, парастезия конечностей, выпадение волос, неконтролируемые мышечные движения, судороги, бред, кома
лучший антидот KFeIII[FeII(CN)6]













![Галогениды галлия (III) фторид получают из других галогенидов или разложением (NH4)3[GaF6] или](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/366784/slide-15.jpg)














 Опасные места
Опасные места 20140317_merzlikinaip_doc
20140317_merzlikinaip_doc ВИЧ и СПИД
ВИЧ и СПИД Анатомия
Анатомия Электронный документооборот как инструмент борьбы с бюрократией
Электронный документооборот как инструмент борьбы с бюрократией Винсент Виллем ван Гог
Винсент Виллем ван Гог Как выполнить выгрузкуотчетности в электронном виде из программ системы 1С:Предприятие
Как выполнить выгрузкуотчетности в электронном виде из программ системы 1С:Предприятие Преобразования фигур в пространстве
Преобразования фигур в пространстве Предельные одноосновные карбоновые кислоты. Сложные эфиры
Предельные одноосновные карбоновые кислоты. Сложные эфиры Дизайн. Коллаборация. Цифровые технологии. Кейс №3 Перерождение одного изделия в другое
Дизайн. Коллаборация. Цифровые технологии. Кейс №3 Перерождение одного изделия в другое Презентация на тему ДЕЙСТВИЕ ТАБАКА НА ОРГАНИЗМ ЧЕЛОВЕКА
Презентация на тему ДЕЙСТВИЕ ТАБАКА НА ОРГАНИЗМ ЧЕЛОВЕКА  Where is the dog?
Where is the dog? . 1)Прочитать числа: 509, 6001, 90050, 7000850127, 620022. Назвать в каждом из чисел цифру в разряде десятков, сотен. Какие из чисел меньше 1000? 2)Найти
. 1)Прочитать числа: 509, 6001, 90050, 7000850127, 620022. Назвать в каждом из чисел цифру в разряде десятков, сотен. Какие из чисел меньше 1000? 2)Найти ООО ГарантСтройХаус
ООО ГарантСтройХаус Пончики Пончкофф (фотографии)
Пончики Пончкофф (фотографии) Определение культуры. Типы культур
Определение культуры. Типы культур Искусства бумагокручения
Искусства бумагокручения Технологический процесс ручной дуговой сварки листовых конструкций из стали (ст-3пс)
Технологический процесс ручной дуговой сварки листовых конструкций из стали (ст-3пс) МЫ СКОРО УЙДЁМ СО ШКОЛЬНОГО ДВОРА…
МЫ СКОРО УЙДЁМ СО ШКОЛЬНОГО ДВОРА… Эффективные приёмы запоминания учебного материала
Эффективные приёмы запоминания учебного материала Административно-правовой статус
Административно-правовой статус Развитие личности младшего школьника средствами учебного диалога
Развитие личности младшего школьника средствами учебного диалога БЭК-ОФИС СОЗДАНИЕ, РАЗВИТИЕ, АВТОМАТИЗАЦИЯ
БЭК-ОФИС СОЗДАНИЕ, РАЗВИТИЕ, АВТОМАТИЗАЦИЯ Внеурочная работа по математике
Внеурочная работа по математике Слайды
Слайды ГОГОЛЬ: знакомый и незнакомый
ГОГОЛЬ: знакомый и незнакомый The Cable News Network
The Cable News Network Сила. Основы методики ее воспитания
Сила. Основы методики ее воспитания