Содержание
- 2. Основная цель изучения химии окружающей среды - продемонстрировать различные масштабы, скорости и типы природных химических процессов,
- 3. Геохимическая история планеты Земля относится к так называемой группе каменных планет солнечной системы и состоит из
- 4. В соответствии с концепцией О.Ю. Шмидта более 5 млрд. лет назад в результате «Большого взрыва» из
- 5. Затем наступил период охлаждения планеты. Температура на поверхности Земли снизилась до 100° C. Началась конденсация водяного
- 6. Химический состав геосфер и распространенность химических элементов в окружающей среде Химический состав атмосферы (без паров воды
- 7. Химический состав геосфер и распространенность химических элементов в окружающей среде Химический состав океанической воды, масс. %.
- 8. Среднее содержание химических элементов в земной коре было впервые вычислено в 1889 г. американским ученым Ф.У.
- 9. Теории возникновения жизни Креационисты утверждают, что жизнь создана высшей силой, Творцом. Сторонники теории самозарождения (витализма) утверждали,
- 10. Возраст Земли составляет 5–7 млрд. лет. Все планеты проходят стадию раскаленного тела, температура на поверхности Земли
- 11. Химический состав живого вещества В живых организмах обнаружены почти все элементы периодической системы, но кларки большинства
- 12. Структура и состав атмосферы Атмосфера - газовая оболочка Земли, которая является надежным экраном защищающим жизнь от
- 13. Структура и состав атмосферы Верхняя граница тропосферы изменяется в течение года: летом она выше, зимой ниже.
- 14. Структура и состав атмосферы В тропопаузе температура достигает -55...-60° С, затем в стратосфере наблюдается рост температуры
- 15. Кислород - самый распространенный на Земле химический элемент, его кларк равен 47. Еще выше концентрация кислорода
- 16. Круговорот кислорода
- 17. Озон Озон - аллотропная форма кислорода. Содержание озона в атмосфере достигает 3,3∙109 т. Если весь озон
- 18. Разрушение озонового слоя Существенным антропогенным фактором воздействия на озоновый цикл является поступление в атмосферу галогенуглеродов. Это,
- 19. Разрушение озонового слоя Поставщиками оксидов азота в атмосферу являются, кроме азотперерабатывающих предприятий, процессы разложения минеральных удобрений
- 20. Пары воды Одним из важнейших компонентов атмосферы является водяной пар. В результате его конденсации образуются облака,
- 21. Азот и его соединения В атмосфере присутствуют различные соединения азота. Прежде всего, это оксиды: N2O, NO,
- 22. Круговорот азота
- 23. Сера и ее соединения В земной коре сера распространена в основном в виде сульфидов металлов и
- 24. Биохимический цикл серы I – минерализации органической серы живыми организмами до H2S; II – десульфофикация
- 25. Биохимический цикл серы
- 26. Углерод и его соединения Содержание углерода в атмосфере Земли составляет 0,046% в форме двуокиси углерода и
- 27. Биохимический цикл углерода
- 28. Образование аэрозолей Различиют два основных типа аэрозолей по способу их образования: конденсационные и диспергационные. Этим типам
- 30. Радиоактивные аэрозоли Опасным фактором антропогенного характера, который способствует ухудшению качества атмосферы, является загрязнение радиоактивной пылью. Так,
- 31. Образование сульфатных и нитратных аэрозолей Образующийся диоксид серы подвергается дальнейшему окислению и превращению в триоксид серы.
- 32. Образование нитратных аэрозолей Обычно соединения азота окисляются до NO2, а конечным продуктом являемся газообразная азотная кислота.
- 33. Органические аэрозоли Из всех органических компонентов склонность к образованию аэрозолей наиболее присуща терпеновым углеводородам, которые выделяются
- 34. Трансформации аэрозольных частиц Аэрозоли существуют в атмосфере от нескольких часов до нескольких дней (в стратосфере до
- 35. Смоги, классификация и аналитический состав Одновременное присутствие тумана (англ. fog) и дыма (англ. smoke) привело к
- 36. Лондонский смог (1952 г.) висел над городом несколько дней, он содержал, по подсчетам специалистов, несколько сот
- 37. Окислительный характер смогу придают, в основном, озон и пероксиацетилнитрат. Накопление озона в атмосфере зависит в частности
- 38. Оксиданты смога При образовании фотохимического смога важное значение имеет реакционная способность органических соединений. Считают, что олефины
- 39. Сравнение смогов Лос-Анжелеса и Лондона (по Raiswell et al. 1980)
- 40. Кислотные осадки представляют собой различные виды атмосферных осадков (дождь, снег, туман, роса) с кислотностью выше нормы.
- 41. Частично диоксид серы в результате фотохимического окисления превращается в триоксид серы (серный ангидрид) SО3: 2 SO2
- 42. Вода как химическое соединение Молекула воды состоит из одного атома кислорода и двух атомов водорода, расположенных
- 43. Одним из аномальных свойств воды является меньшая плотность твердой фазы (льда) по сравнению с жидкой. Плотность
- 44. Одним из аномальных свойств воды является меньшая плотность твердой фазы (льда) по сравнению с жидкой. Плотность
- 45. На содержание в воде растворенного кислорода влияют две группы противоположно направленных процессов: одни увеличивают концентрацию кислорода,
- 46. Вода − очень слабый электролит, диссоциирующий на катион водорода и анион гидроксила по уравнению Н2О ↔
- 47. В естественных условиях вода не встречается в чистом виде. Природные воды представляют собой сложные системы, содержащие
- 48. Ионы в водных растворах гидратированы, они образуют аквакомплексы, например, типа [Сu(Н2О)3ОН] В морской воде примерно третья
- 49. Основные компоненты природных вод В океанической воде обнаружены практически все химические элементы, однако содержание их различно.
- 50. Металлы и их соединения в воде Наиболее распространенные металлы, такие, как натрий, калий, кальций, относятся к
- 51. Металлы и их соединения в воде В водных растворах ионы всех металлов подвергаются гидратации, результатом которой
- 52. Важнейшие анионы природных вод Наиболее распространены в воде хлорид-ионы (Сl–). Их содержание изменяется в очень широких
- 53. Биогенные вещества Содержание нитратов в чистых водоемах оценивается сотыми и десятыми долями миллиграммов на литр. Аммонийные
- 54. Органические вещества Органические вещества природных вод представляют собой довольно широкую гамму соединений. Основную часть представляют гумусовые
- 55. Классификация вод по химическому составу В основе одного из наиболее распространенных способов классификации лежит величина минерализации
- 56. Классификация вод по химическому составу иная классификация, основанная на делении вод по преобладанию определенных ионов и
- 57. Карбонатные системы природных водоемов В природных водах неорганические соединения углерода находятся в виде солей угольной кислоты.
- 58. Карбонатные системы природных водоемов При нормальных условиях рН природных вод составляет 7,0...8,5. Для этой области рН
- 59. Буферные свойства карбонатной системы Кислые и щелочные стоки, попадающие в водоем, могут быть нейтрализованы карбонатной системой.
- 60. Техногенные процессы закисления водоемов При поступлении в водоем кислых осадков или стоков возможно значительное изменение состояния
- 61. Жесткость воды Жесткостью воды называется свойство воды, обусловленное содержанием в ней ионов кальция и магния. Общая
- 62. Эвтрофикация водных объектов Эвтрофикация (eutrophication) – избыточное поступление в водоёмы органических и минеральных веществ, преимущественно азота,
- 63. Источники загрязнения и экологические последствия загрязнения мирового океана Загрязнение океана связано главным образом с поступлением огромного
- 64. Строение и элементный состав литосферы Считают, что Земля образовалась из протопланетного облака и первоначально была холодной.
- 65. Строение и элементный состав литосферы Планета Земля состоит из трех основных оболочек: коры, мантии и центрального
- 66. Схема внутреннего строения Земли
- 67. Ядро Земли состоит из сплава железа с более легким элементом, которым может быть кремний, кислород или
- 68. Ядро и литосфера Внутренняя часть Земли называется ядром. Его повышенную плотность (от 10–12 до 20 т/м3)
- 69. Верхняя часть литосферы – земная кора на 90 % состоит из 8 химических элементов: кислорода, кремния,
- 70. Наземная среда обитания расположена на континентальной коре, громадном резервуаре магматических и метаморфических пород. Этими породами (
- 71. Средний минеральный состав земной коры, %
- 72. Глинистые минералы представлены небольшими чешуйками размером Глинистые минералы – это слоистые силикаты, построенные из слоев атомов
- 73. Простейшим расположением тетраэдрических и октаэдрических сеток являются слои 1 : 1 (один к одному), показанные на
- 74. Другим важным структурным расположением является структура 2 : 1 (два к одному), сложенная октаэдрической сеткой Структура
- 75. Поглотительные способности почв Поглотительной способностью почв называется свойство ее компонентов (твердой, жидкой, газообразной и биологической фазы)
- 76. Физическая поглотительная способность Физическая поглотительная способность связана с изменением концентрации молекул на поверхности раздела фазы и
- 77. Обменная поглотительная способность Физико-химическая или обменная поглотительная способность − способность почвы поглощать и обменивать ионы, находящиеся
- 78. Катионнообменная способность Катионнообменную способность почв относят к числу фундаментальных свойств почвы. Было показано, что в межпакетных
- 79. Круговорот фосфора Химическое поглощение (фиксация) фосфора обусловливает слабую подвижность его в почве и снижает доступность растениям
- 80. Биологическая поглотительная способность почв Биологическая поглотительная способность почв обусловлена способностью живых почвообитающих организмов (корни растений, микроорганизмы)
- 81. Круговорот фосфора (Грин, Стаут, Тейлор, 1996)
- 82. Круговорот фосфора Данный круговорот проще круговорота азота, поскольку фосфор встречается лишь в немногих химических формах. Важный
- 83. Круговорот фосфора При внесении в почву химических фосфорных удобрений происходит химическое связывание фосфора. В кислых почвах
- 84. Тенденции круговорота фосфора 1. Мобилизация фосфора из агроруд и шлаков, производство и применение фосфорных удобрений. 2.
- 86. Скачать презентацию
Слайд 2 Основная цель изучения химии окружающей среды - продемонстрировать различные масштабы, скорости
Основная цель изучения химии окружающей среды - продемонстрировать различные масштабы, скорости

Основное значение этого предмета состоит в понимании того, как протекают природные геохимические процессы и как они действовали в различных периодах существования нашей планеты, чтобы количественно учесть последствия антропогенного вмешательства человека в химические процессы в биосфере.
Слайд 3Геохимическая
история планеты
Земля относится к так называемой группе каменных планет солнечной системы
Геохимическая
история планеты
Земля относится к так называемой группе каменных планет солнечной системы

Земля третья планета солнечной системы, её расположение таково, что на поверхность попадают умеренно теплые солнечные лучи. В этих условиях происходило охлаждение земной атмосферы, из водяных паров образовалась водная оболочка земли. В воде под живительными лучами Солнца возникла жизнь, которая в дальнейшем способствовала обогащению атмосферы кислородом.
С расцветом жизни возник человек, а вместе с ним «ноосфера» - область активной деятельности человека (по В.И. Вернадскому), которая представляет в наше время важную геологическую силу.
Слайд 4 В соответствии с концепцией О.Ю. Шмидта более 5 млрд. лет назад
В соответствии с концепцией О.Ю. Шмидта более 5 млрд. лет назад

Первоначально Земля была холодной, но благодаря распаду радиоактивных элементов она разогрелась, температура в ее недрах достигла выше 1000° C. В результате твердые породы начали плавиться и распределяться определенным образом: в центре – самые тяжелые. А на поверхности - самые легкие. Под влиянием высокой температуры вещества вступали в химические реакции.
Атмосфера Земли в то время была бескислородной. В ее состав входили азот, водяной пар, углекислый газ, сероводород, аммиак, метан и др. Свободный кислород, который выделялся из мантии, быстро расходовался на процессы окисления.
Слайд 5 Затем наступил период охлаждения планеты. Температура на поверхности Земли снизилась до
Затем наступил период охлаждения планеты. Температура на поверхности Земли снизилась до

Эту концепцию развили или углубили в своих работах в 1924 году А.И. Опарин, в 1929 году английский биолог Дж. Холдейн и в 1947 году английский физик Джон Бернал. Процесс формирования первых органических соединений на Земле называют химической эволюцией.
Слайд 6Химический состав геосфер и распространенность химических элементов в окружающей среде
Химический
Химический состав геосфер и распространенность химических элементов в окружающей среде
Химический
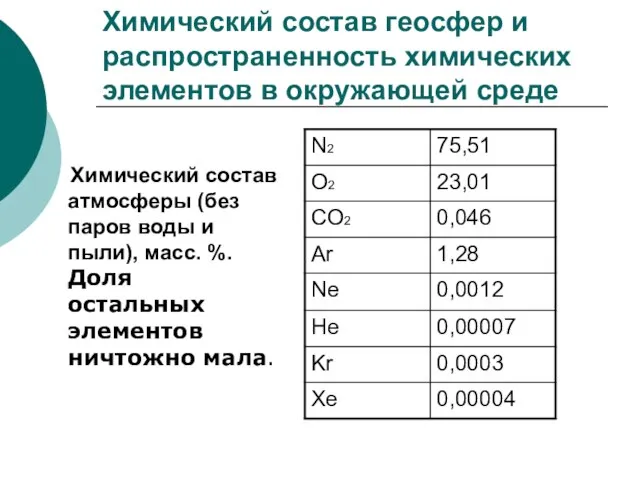
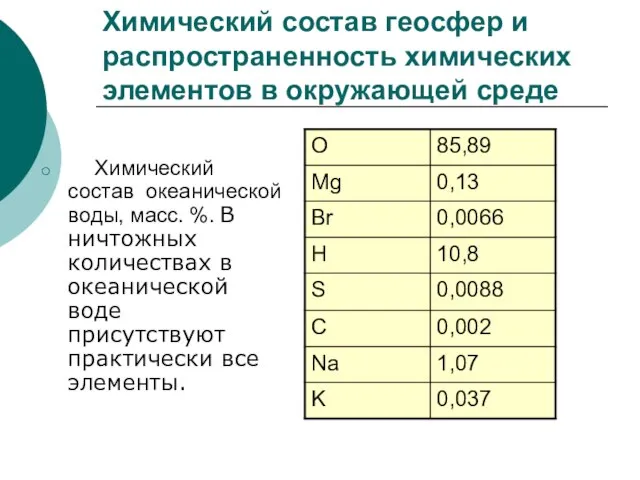
Слайд 7Химический состав геосфер и распространенность химических элементов в окружающей среде
Химический
Химический состав геосфер и распространенность химических элементов в окружающей среде
Химический
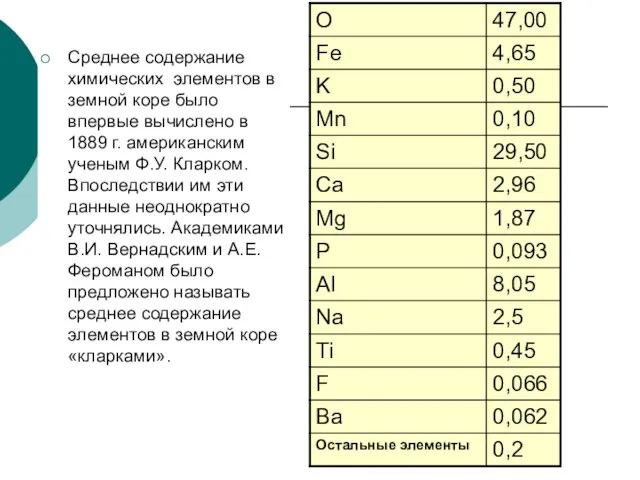
Слайд 8Среднее содержание химических элементов в земной коре было впервые вычислено в 1889
Среднее содержание химических элементов в земной коре было впервые вычислено в 1889
Слайд 9Теории возникновения жизни
Креационисты утверждают, что жизнь создана высшей силой, Творцом.
Сторонники
Теории возникновения жизни
Креационисты утверждают, что жизнь создана высшей силой, Творцом.
Сторонники

Теория биохимической эволюции показывает возможный путь зарождения жизни на Земле естественным путем, когда химическая эволюция создает предпосылки для появления живых организмов при наличии определенных условий.
Теория панспермии заключается в следующем: существуют зародыши жизни, рассеянные по всей Вселенной и они способны заселить любую планету, если условия на ней окажутся
пригодными для развития жизни.
Теория направленной панспермии. В 1973 г. английский физик Ф. Крик и американский биохимик Л. Оргел, выдвинули предположение, что происхождение жизни на Земле – следствие целенаправленной деятельности внеземной цивилизации, существовавшей задолго до образования нашей планеты и с помощью космического аппарата пославшей на Землю "семена" жизни. По их мнению, один из аргументов в пользу космического происхождения земной жизни – наличие во всех ее формах редких для Земли металлов.
Слайд 10Возраст Земли составляет 5–7 млрд. лет. Все планеты проходят стадию раскаленного тела,
Возраст Земли составляет 5–7 млрд. лет. Все планеты проходят стадию раскаленного тела,

Очень продуктивной оказалась гипотеза советского академика А.И.Опарина, предполагающая возможность зарождения жизни на Земле. В 1924 г. А.И.Опарин предположил, что появлению живых организмов предшествует абиогенное образование в атмосфере и океане органических соединений за счет энергии мощных грозовых разрядов, жесткого ультрафиолетового и радиоактивного излучения. Затем образуются биополимеры, которые концентрируются в коацерватах. В коацерватах идет эволюция органических молекул, появляются молекулы, придающие устойчивость коацерватам и способные к самовоспроизведению.
Теории возникновения жизни
Слайд 11Химический состав живого вещества
В живых организмах обнаружены почти все элементы периодической
Химический состав живого вещества
В живых организмах обнаружены почти все элементы периодической

Живое существо богато водой, некоторые животные (медузы и др.) содержат почти 100% воды, млекопитающие имеют более 60% воды. Остальные элементы присутствуют в очень незначительных количествах.
Живым веществом за всю геологическую историю по сути были существенно изменены геохимические процессы верхней части земной коры, тропосферы, гидросферы, создана единая динамическая саморегулирующая система – биосфера, а по В.И. Вернадскому в наше время - «ноосфера».
Слайд 12Структура и состав атмосферы
Атмосфера - газовая оболочка Земли, которая является надежным
Структура и состав атмосферы
Атмосфера - газовая оболочка Земли, которая является надежным
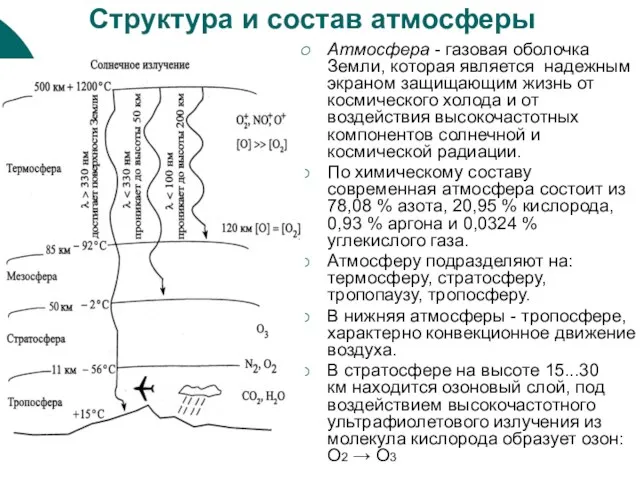
По химическому составу современная атмосфера состоит из 78,08 % азота, 20,95 % кислорода, 0,93 % аргона и 0,0324 % углекислого газа.
Атмосферу подразделяют на: термосферу, стратосферу, тропопаузу, тропосферу.
В нижняя атмосферы - тропосфере, характерно конвекционное движение воздуха.
В стратосфере на высоте 15...30 км находится озоновый слой, под воздействием высокочастотного ультрафиолетового излучения из молекула кислорода образует озон: О2 → О3
Слайд 13Структура и состав атмосферы
Верхняя граница тропосферы изменяется в течение года: летом
Структура и состав атмосферы
Верхняя граница тропосферы изменяется в течение года: летом

Именно в тропосфере образуются облака и здесь сосредоточен основная масса водяного пара. Масса самой тропосферы составляет приблизительно 80 % массы всей атмосферы. Температура в тропосфере убывает с высотой (на 0,6 °С на каждые 100 м) и в верхней границе тропосферы достигает -50...-70 °С.
Между тропосферой и стратосферой существует слой в 1...2 км (тропопауза), где господствуют очень сильные воздушные потоки воздуха, перемещающиеся со скоростью 150...300 км/ч.
Температура воздуха в нижних слоях тропосферы является показателем погоды (кратковременных метеорологических условий местности) и климата (устойчивых годовых циклов погодных условий).
Важную роль в формировании погоды и климата играют термодинамически активные примеси (ТАП) - переменные составные части атмосферы, способные сильно влиять на состояние воздуха и распределение в атмосфере тепла.
Важнейшей ТАП является водяной пар, что обусловлено особыми свойствами воды, прежде всего высокой теплоемкостью, большой энергией парообразования и конденсации.
Слайд 14Структура и состав атмосферы
В тропопаузе температура достигает -55...-60° С, затем
Структура и состав атмосферы
В тропопаузе температура достигает -55...-60° С, затем

Выше расположена мезосфера, верхняя граница которой достигает 80...85 км над уровнем моря и где наблюдается снижение температуры с высотой до -90°С.
В стратосфере и более высоких слоях под воздействием солнечной радиации молекулы газов диссоциируют на атомы (выше 80 км диссоциируют Н2 и СО2 , выше 150 км – О2 , выше 300 км – N2). На высоте 100...400 км в ионосфере происходит также ионизация газов, на высоте 320 км концентрация заряженных частиц (О2+, О2-, N2+) составляет ~ 1/300 от концентрации нейтральных частиц. В верхних слоях атмосферы присутствуют свободные радикалы – ОН-, НО2– и др.
Слайд 15 Кислород - самый распространенный на Земле химический элемент, его кларк равен
Кислород - самый распространенный на Земле химический элемент, его кларк равен

1) Фотосинтез;
2) разложение воды под действием ультрафиолетового излучения по схеме: 2 H2O + hv →2 H2 + O2
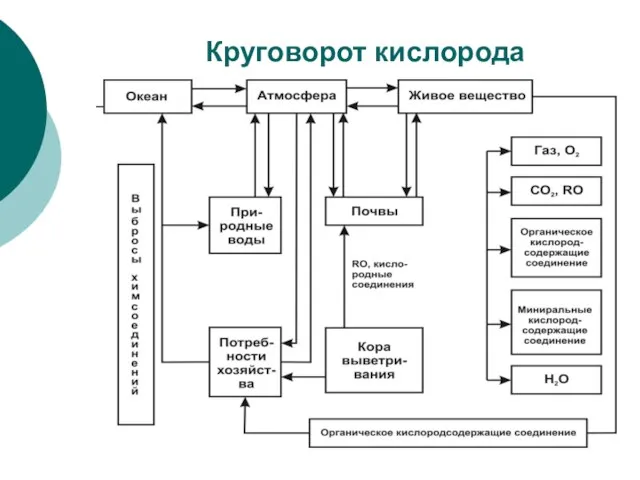
Слайд 16 Круговорот кислорода
Круговорот кислорода
Слайд 17Озон
Озон - аллотропная форма кислорода. Содержание озона в атмосфере достигает
Озон
Озон - аллотропная форма кислорода. Содержание озона в атмосфере достигает

Кроме того, озоновый слой поддерживает определенный микроклимат планеты, образуя инверсионный слой, препятствующий рассеиванию в космос тепловой энергии поверхности планеты.
Слайд 18Разрушение озонового слоя
Существенным антропогенным фактором воздействия на озоновый цикл является поступление
Разрушение озонового слоя
Существенным антропогенным фактором воздействия на озоновый цикл является поступление

CFCl3 + hv → ∙CFCl2 + Cl∙ или CFCl3 + hv→ ∙C∙FCl + 2Cl∙
аналогично идут реакции с дифтордихлорметаном:
CF2Cl2 + hv → ∙CF2Cl + Cl∙; CF2Cl2 + hv → ∙C∙F2 + 2Cl∙
Полученные радикалы хлора участвуют по приведенной выше реакции в хлорном цикле разрушения озона.
Слайд 19Разрушение озонового слоя
Поставщиками оксидов азота в атмосферу являются, кроме азотперерабатывающих предприятий,
Разрушение озонового слоя
Поставщиками оксидов азота в атмосферу являются, кроме азотперерабатывающих предприятий,

По оценке ряда авторов поступление фторхлоруглеродов в атмосферу достигает 80% от общей антропогенной эмиссии хлорсодержа-щих. Однако имеют значение и другие соединений. Например, CCl4 также может просачиваться в стратосферу и подвергаться фотолизу при действии кванта энергии с длиной волны < 250 нм.
CCl4 + hv → ∙CCl3 + Cl∙
Слайд 20Пары воды
Одним из важнейших компонентов атмосферы является водяной пар. В результате его
Пары воды
Одним из важнейших компонентов атмосферы является водяной пар. В результате его

Поскольку на Земле достаточно источников образования водяного пара, на малых высотах концентрация его высока. Но содержание пара быстро убывает с высотой и в стратосфере остается постоянным по высоте, в пределах 2...4 мг/кг воздуха. Водяной пар легко диссоциирует под действием солнечного излучения:
H2O + hv → H∙ + HO∙
Эта реакция характерна для высот более 70 км, куда проникает излучение с данной длиной волны.
В стратосфере основной реакцией является взаимодействие с кислородом:
H2O + O(′D)→ 2HO∙
Слайд 21Азот и его соединения
В атмосфере присутствуют различные соединения азота. Прежде
Азот и его соединения
В атмосфере присутствуют различные соединения азота. Прежде

Нитритный азот, производимый почвообитающими и водными микроорганизмами, поглощается растениями и восстанавливается (при участии НАДФ•Н2 и НАД•Н2) в их листьях до аммония, который трансформируется в азот аминов и затем белков.
Белки и другие формы органического азота, содержащиеся в биомассе, непрерывно поступают в среду в виде детрита, выделений и трупов. Подвергаясь воздействию редуцентов (бактерий, актиномицетов и грибов), они используются ими для собственных нужд и при этом восстанавливаются до аммиака.
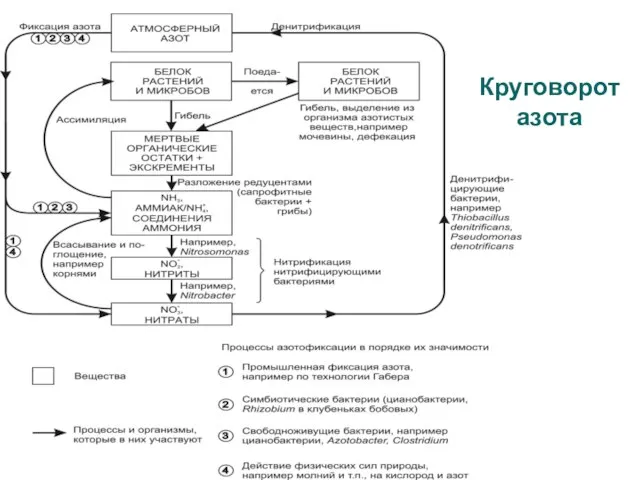
Слайд 22Круговорот азота
Круговорот азота
Слайд 23Сера и ее соединения
В земной коре сера распространена в основном в
Сера и ее соединения
В земной коре сера распространена в основном в

В почве сера содержится, в основном, в виде органических соединений восстановленной серы и в виде H2S в почвенных газах.
Пути поступления соединений серы в атмосферу различны. Эти соединения довольно многочисленны и разнообразны, однако основными являются сероводород и диоксид серы в газовой фазе, в меньшей степени триоксид серы, в также сульфаты в виде аэрозолей. Известно и существование в атмосфере других соединений серы, но в меньших количествах, по-видимому, в результате их быстрых превращений: это оксиды серы SO, S2O, (SO)2, (SO3)n и др., а также органические соединения: метилмеркаптан (CH3SH), этилмеркаптан (CH3CH2SH), сульфиды типа R-S-R, дисульфиды (R-S-S-R) и др.
Более 50% соединений серы, поступающих в атмосферу, имеют биогенное происхождение, антропогенное –12%.
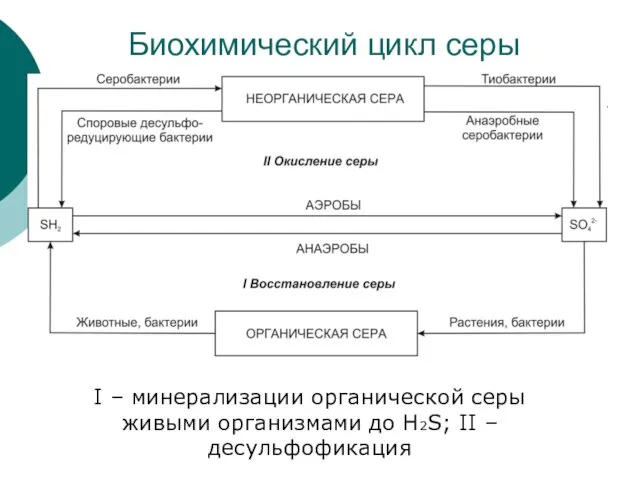
Слайд 24Биохимический цикл серы
I – минерализации органической серы живыми организмами до H2S;
Биохимический цикл серы
I – минерализации органической серы живыми организмами до H2S;
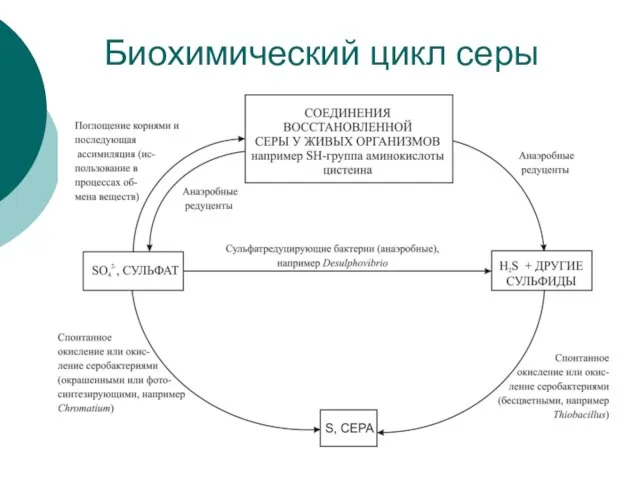
Слайд 25Биохимический цикл серы
Биохимический цикл серы
Слайд 26Углерод и его соединения
Содержание углерода в атмосфере Земли составляет 0,046% в
Углерод и его соединения
Содержание углерода в атмосфере Земли составляет 0,046% в

В природе углерод существует в основном в двух формах: в виде отложений известняков биогенного происхождения и в виде углекислого газа. Несмотря на то что концентрация СО2 в атмосфере невелика (0,03–0,04%), именно за счет него производится первичное органическое вещество, необходимое для биосферы.
Хранители углерода – живая биомасса, гумус, известковые осадочные породы и каустобиолиты. Цикл оборота углерода гомосферы охватывает 300-400 лет. Этот элемент часто выходит из круговорота на длительный срок в виде карбонатов, торфов, сапропелей, углей, гумуса.
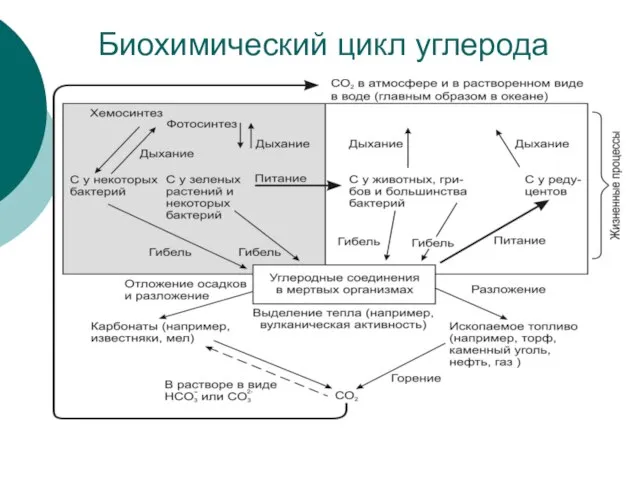
Слайд 27Биохимический цикл углерода
Биохимический цикл углерода
Слайд 28Образование аэрозолей
Различиют два основных типа аэрозолей по способу их образования: конденсационные
Образование аэрозолей
Различиют два основных типа аэрозолей по способу их образования: конденсационные

В результате конденсации паров воды, например, при адиабатном расширении газа, образуются кучевые облака, при смещении паров воды с холодным воздухом - туман. К образованию аэрозолей приводят различные химические реакции в атмосфере: горение фосфора на воздухе приводит к образованию мельчайших частиц P2O5, при взаимодействии газообразных аммиака и хлористого водорода в атмосфере появляются частицы хлористого аммония и т.д.
Слайд 30Радиоактивные аэрозоли
Опасным фактором антропогенного характера, который способствует ухудшению качества атмосферы, является
Радиоактивные аэрозоли
Опасным фактором антропогенного характера, который способствует ухудшению качества атмосферы, является

Во время ядерных взрывов радионуклиды находятся в газообразном состоянии и по мере понижения температуры конденсируются в аэрозольное облако. Наиболее крупные частицы (диаметром более 40 мкм) выпадают из атмосферы и оседают на земной поверхности. Мелкие частицы (диаметром от 1 до 20 мкм) попадают не только в верхние слои тропосферы, но и в стратосферу, обусловливая так называемое глобальное загрязнение, сопровождающееся выпадением радионуклидов в пределах обоих полушарий.
Слайд 31Образование сульфатных и нитратных аэрозолей
Образующийся диоксид серы подвергается дальнейшему окислению и превращению
Образование сульфатных и нитратных аэрозолей
Образующийся диоксид серы подвергается дальнейшему окислению и превращению

2 SO2 + О2 + hν → 2 SO3
Летом примерно 55–70% переходит в SO3, зимой эта величина достигает лишь 30–35%. Исследования, проведенные над океанами, показали, что количество сульфатных форм в дневное время на 50% выше, чем в ночное. Все это подтверждает фотохимический процесс происхождения сульфатных частиц.
Образовавшийся триоксид достаточно быстро превращается в серную кислоту в результате взаимодействия с парами воды. При взаимодействии с различными веществами серная кислота дает твердые частицы – сульфаты. Например, при взаимодействии с аммиаком образуются частицы сульфата аммония:
NH3 + H2SO4 ∙ nH2O → NH4HSO4 ∙ nH2O
NH3 + NH4HSO4 ∙ nH2O → (NH4)2SO4 ∙ nH2O
Образовавшиеся мельчайшие кристаллы сульфата аммония являются зародышами для дальнейшей кристаллизации сульфатов.
Слайд 32Образование нитратных аэрозолей
Обычно соединения азота окисляются до NO2, а конечным продуктом являемся
Образование нитратных аэрозолей
Обычно соединения азота окисляются до NO2, а конечным продуктом являемся
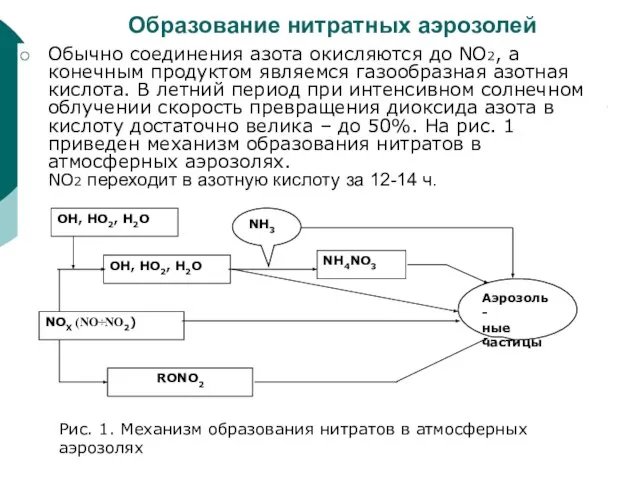
Рис. 1. Механизм образования нитратов в атмосферных аэрозолях
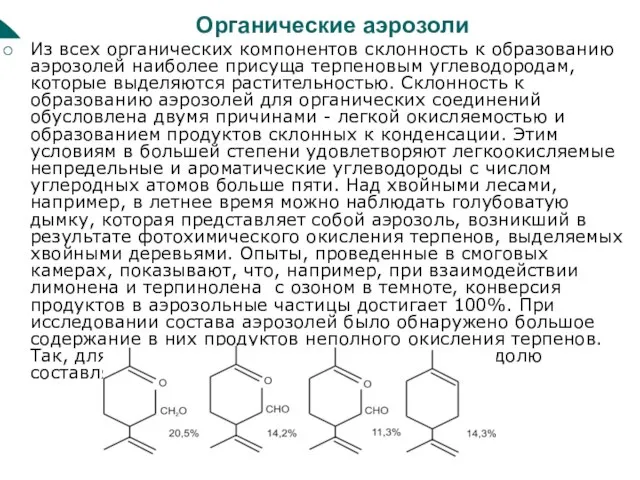
Слайд 33Органические аэрозоли
Из всех органических компонентов склонность к образованию аэрозолей наиболее присуща терпеновым
Органические аэрозоли
Из всех органических компонентов склонность к образованию аэрозолей наиболее присуща терпеновым
Слайд 34Трансформации аэрозольных частиц
Аэрозоли существуют в атмосфере от нескольких часов до нескольких
Трансформации аэрозольных частиц
Аэрозоли существуют в атмосфере от нескольких часов до нескольких

В перенасыщенной атмосфере аэрозоли могут выполнять роль центров конденсации, на которых осаждается все большее количество вещества. Частицы растут и, достигнув определенного размера, оседают к поверхности Земли.
При испарении часть вещества аэрозольной капли переходит в газовую фазу и может участвовать в дальнейших газофазных реакциях или снова конденсироваться в другие аэрозоли, В результате процессов испарения аэрозольные частицы уменьшаются до определенных размеров до тех пор6 пока не установится равновесие между процессами испарения и конденсации.
Слайд 35Смоги, классификация и аналитический состав
Одновременное присутствие тумана (англ. fog) и дыма
Смоги, классификация и аналитический состав
Одновременное присутствие тумана (англ. fog) и дыма

Смоги являются причиной обострения заболеваний органов дыхания и кровообращения. В 1948 г. смог окутал г. Донора (штат Пенсильвания, США). Из атмосферы, спустя некоторое время, начала выпадать сажа, покрывшая дома, мостовые. В течение нескольких дней видимость была очень плохой. У жителей появились такие болезненные симптомы, как удушье, насморк, кашель, резь в глазах, тошнота.
Причиной образования смога была температурная инверсия, в результате которой образовавшиеся аэрозоли не диффундировали в верхние слои атмосферы, а концентрировались у поверхности Земли.
Слайд 36Лондонский смог (1952 г.) висел над городом несколько дней, он содержал, по
Лондонский смог (1952 г.) висел над городом несколько дней, он содержал, по

Особый тип загрязнения городской атмосферы, впервые отмеченный в Лос-Анжелесе в 1944 г., получил название «фотохимического смога». Сначала полагали, что он сходен с загрязнением воздуха, наблюдаемым в других местах, но традиционные методы борьбы с дымом не привели ни к какому улучшению. В 1950-х стало ясно, что это загрязнение другого рода, и эксперты были поставлены в тупик. Смог был вызван реакциями автомобильных выхлопов при солнечном свете. Фотохимический смог представляет собой «сухой туман» с влажностью около 70%, визуально проявляется в виде желто-зеленой или сизой дымки, а не сплошного тумана. При смоге появляется неприятный запах, резко ухудшается видимость. Наблюдается сильное раздражение слизистых оболочек дыхательных путей и глаз.
Смоги, классификация и аналитический состав
Слайд 37Окислительный характер смогу придают, в основном, озон и пероксиацетилнитрат. Накопление озона в
Окислительный характер смогу придают, в основном, озон и пероксиацетилнитрат. Накопление озона в

NO2 → NO + O (3P) λ < 400 нм
O (3P) + O2 + M → O3 + M
O3 + NO → NO2 + O2
Скорость разрушения озона при взаимодействии с О (3Р) и НО• незначительна, поэтому последняя реакция может в какой-то мере служить определяющей содержание О3. Из уравнения видно, что концентрация озона будет возрастать при увеличении скорости превращения NО в NО2 другими путями. Этот процесс имеет место в атмосфере городов, содержащей органические вещества. Как уже было показано ранее, превращение органики идет по схеме:
RH + OH• → R• + H2O
R• + O2 → ROO•
ROO• + NO → RO• + NO2
При наличии определенных концентраций алканов процессы перехода NO в NO2 ускоряются, что приводит, в свою очередь, к повышению концентрации озона.
Химический состав смога
Слайд 38Оксиданты смога
При образовании фотохимического смога важное значение имеет реакционная способность органических
Оксиданты смога
При образовании фотохимического смога важное значение имеет реакционная способность органических

Органические соединения в результате последовательных реакций превращаются в оксиданты. Одним из оксидантов смога является пероксиацетилнитрат (ПАН). Его формула имеет вид:
CH3 – C – O – O – NO2
׀׀
O
Это вещество оказывает сильное раздражающее действие на глаза, повреждает растительность. Другим раздражающим веществом, идентифицированным из состава атмосферы в смоговых условиях, является пероксибензоилнитрат (ПБН), имеющий структуру
C6H5 – C – O – O – NO2
׀׀
O
ПБН обладает в 100 раз более сильным раздражающим действием на глаза, чем ПАН.
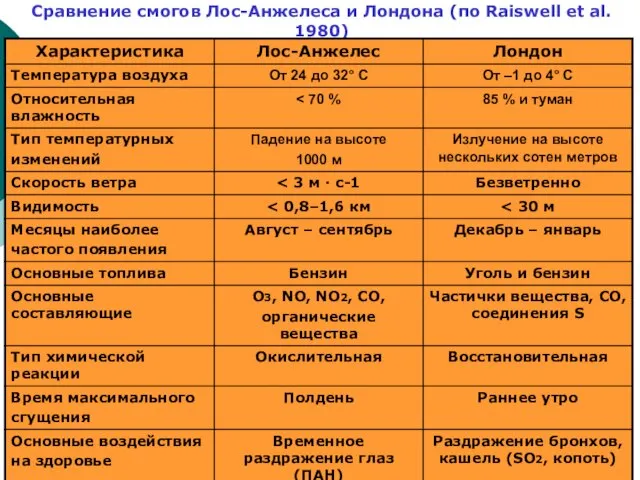
Слайд 39Сравнение смогов Лос-Анжелеса и Лондона (по Raiswell et al. 1980)
Сравнение смогов Лос-Анжелеса и Лондона (по Raiswell et al. 1980)
Слайд 40 Кислотные осадки представляют собой различные виды атмосферных осадков (дождь, снег, туман,
Кислотные осадки представляют собой различные виды атмосферных осадков (дождь, снег, туман,
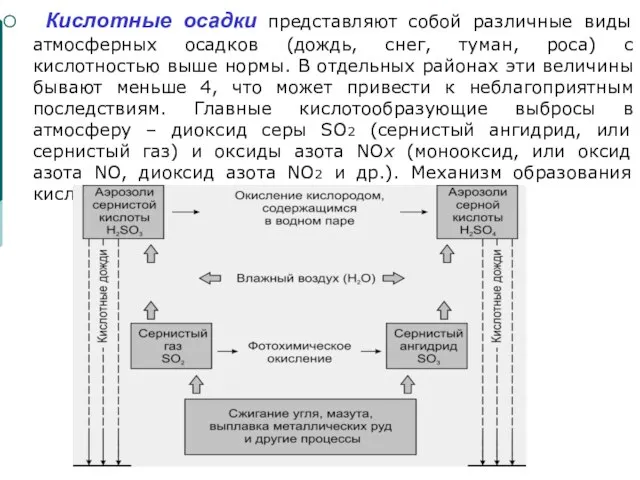
Слайд 41Частично диоксид серы в результате фотохимического окисления превращается в триоксид серы (серный
Частично диоксид серы в результате фотохимического окисления превращается в триоксид серы (серный

2 SO2 + O2 → 2 SO3,
который реагирует с водяным паром атмосферы, образуя аэрозоли серной кислоты:
SO3 + Н2O → Н2SO4.
Основная часть выбрасываемого диоксида серы во влажном воздухе образует кислотный полигидрат SО2∙nH2O, который часто называют сернистой кислотой и изображают условной формулой Н2SО3:
SO2 + H2O → H2SO3.
Сернистая кислота во влажном воздухе постепенно окисляется до серной:
2 Н2SО3 + О2 → 2 Н2SO4.
Аэрозоли серной и сернистой кислот приводят к конденсации водяного пара атмосферы и становятся причиной кислотных осадков (дожди, туманы, снег). При сжигании топлива образуются твердые микрочастицы сульфатов металлов (в основном при сжигании угля), легко растворимые в воде, которые осаждаются на почву и растения, делая кислотными росы.
Химические реакции, приводящие к кислотным осадкам
Слайд 42Вода как химическое соединение
Молекула воды состоит из одного атома кислорода и двух
Вода как химическое соединение
Молекула воды состоит из одного атома кислорода и двух
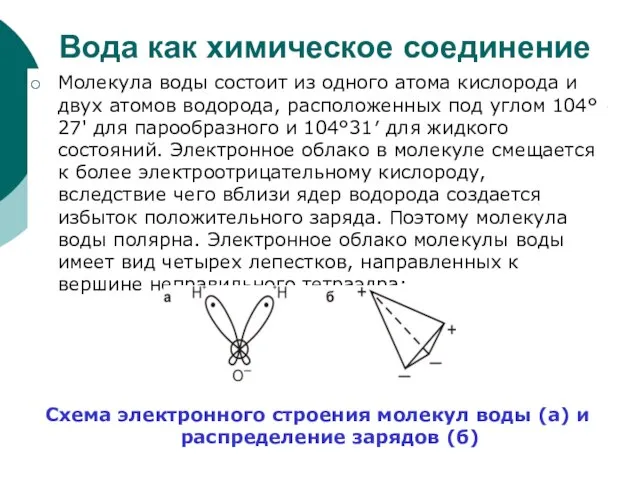
Схема электронного строения молекул воды (а) и распределение зарядов (б)
Слайд 43Одним из аномальных свойств воды является меньшая плотность твердой фазы (льда) по
Одним из аномальных свойств воды является меньшая плотность твердой фазы (льда) по

Для воды присущ и ряд температурных аномалий. При 30…35°С вода имеет наименьшую теплоемкость, а в интервале от 0 до 35°С наблюдается наиболее резкое падение электронной поляризуемости воды под действием внешнего поля. С этой аномалией связывают биологическую активность воды по отношению к организмам, имеющим оптимум температуры, близкий 37°С.
Аномальным является и такое свойство воды, как снижение температуры замерзания с повышением давления. Для других веществ эта зависимость имеет обратный характер.
Аномальные свойства воды
Слайд 44Одним из аномальных свойств воды является меньшая плотность твердой фазы (льда) по
Одним из аномальных свойств воды является меньшая плотность твердой фазы (льда) по

Для воды присущ и ряд температурных аномалий. При 30…35°С вода имеет наименьшую теплоемкость, а в интервале от 0 до 35°С наблюдается наиболее резкое падение электронной поляризуемости воды под действием внешнего поля. С этой аномалией связывают биологическую активность воды по отношению к организмам, имеющим оптимум температуры, близкий 37°С.
Аномальным является и такое свойство воды, как снижение температуры замерзания с повышением давления. Для других веществ эта зависимость имеет обратный характер.
Аномальные свойства воды
Слайд 45На содержание в воде растворенного кислорода влияют две группы противоположно направленных процессов:
На содержание в воде растворенного кислорода влияют две группы противоположно направленных процессов:

процесс абсорбции кислорода из атмосферы;
выделение кислорода водной растительностью в процессе фотосинтеза;
поступление в водоемы с дождевыми и снеговыми водами, которые обычно пересыщены кислородом.
Абсорбция кислорода из атмосферы происходит на поверхности водного объекта. Скорость этого процесса повышается с понижением температуры, с повышением давления и понижением минерализации.
В поверхностных водах содержание растворенного кислорода варьирует в широких пределах – от 0 до 14 мг/дм3 – и подвержено сезонным и суточным колебаниям. Суточные колебания зависят от интенсивности процессов его продуцирования и потребления и могут достигать 2,5 мг/дм3 растворенного кислорода.
Растворенный кислород
Слайд 46 Вода − очень слабый электролит, диссоциирующий на катион водорода и анион
Вода − очень слабый электролит, диссоциирующий на катион водорода и анион

Н2О ↔ Н+ ОН–.
Равновесие это определяется законом действия масс:
Эта константа диссоциации воды определена опытным путем и при 25° С равна 1,86·10–16. Так как степень диссоциации воды очень мала, то концентрация недиссоциирующих молекул воды принимается постоянной, и, объединив [Н2О] с константой диссоциации, представим наше соотношение в следующем виде:
[H+] [OH–] = [H20] = Кв
где Кв − ионное произведение воды.
При постоянной температуре ионное произведение воды является величиной постоянной.
рН водных растворов
Слайд 47В естественных условиях вода не встречается в чистом виде. Природные воды представляют
В естественных условиях вода не встречается в чистом виде. Природные воды представляют

Формирование химического состава природных вод начинается еще в атмосфере, т.к. мельчайшие капли дождя содержат растворенные газы, мельчайшие частицы солей, молекулы кислот. Но значительно обогащается вода различными химическими соединениями после ее выпадения на земную поверхность.
При взаимодействии с горными породами протекают химические реакции – гидролиз, окислительно-восстановительные, ионообменные реакции, карбонизация, выщелачивание и др. Например, карбонатные породы разрушаются под действием угольной кислоты, всегда присутствующей в природных водах, которая переводит труднорастворимые карбонаты в растворимые гидрокарбонаты:
СаСО3 + Н2О + СО2 → Ca(HCО3)2
Условия формирования химического состава природных вод
Слайд 48Ионы в водных растворах гидратированы, они образуют аквакомплексы, например, типа [Сu(Н2О)3ОН] В
Ионы в водных растворах гидратированы, они образуют аквакомплексы, например, типа [Сu(Н2О)3ОН] В
![Ионы в водных растворах гидратированы, они образуют аквакомплексы, например, типа [Сu(Н2О)3ОН] В](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372966/slide-47.jpg)
Ряд минералов окисляется во влажной среде под действием кислорода. Например, пирит может окисляться по схеме
2 FeS2 + 2 H2O + 7 O2 ↔ 2 FeSO4 + 2 H2SO4
4 FeSO4 + 2 H2SO4 + O2 ↔ 2 Fe2(SO4)3 + 2H2O
Далее идет гидролиз соли железа (III):
Fe2(SO4)3 + 2 H2O ↔ 2 Fe(ОН)SO4 + H2SO4.
В результате растворения пирита может образоваться кислая среда с рН < 3. Этим объясняется высокая кислотность рудничных вод.
Такие воды способны растворять различные минералы: апатит, карбонаты, сульфиды, алюмосиликаты, бокситы и др. Нефелин под действием воды и диоксида углерода разлагается по схеме
2 NaAlSiO4 + nH2O + CO2 → Na2CO3 + Al2O3∙2SiO2∙nH2O.
Образующийся карбонат натрия подщелачивает воду. Щелочные растворы могут растворять амфотерные оксиды (Al2O3, ВеО) силикаты. В формировании состава природных вод важная роль принадлежит процессам ионного обмена с алюмосиликатами почв, в результате которого почва обогащается калием, а вода натрием.
Условия формирования химического состава природных вод
Слайд 49Основные компоненты природных вод
В океанической воде обнаружены практически все химические элементы,
Основные компоненты природных вод
В океанической воде обнаружены практически все химические элементы,

Среди катионов преобладают в порядке убывания следующие:
Na+ > Mg2+ > Ca2+ > K+ > др.,
среди анионов:
Cl– > SO42– > HCO3– > Br– > F–
Океан представляет собой, в основном, раствор NaCl. Для речных вод наибольшее распространение имеют катионы Ca2+ > Na+ > Mg2+ > K+ и анионы HCO3– > SO42–> Cl–. В дождевой воде катионы Na+ > Ca2+> Mg2+ > K+. Среди анионов заметно содержание SO42–.
Слайд 50Металлы и их соединения в воде
Наиболее распространенные металлы, такие, как натрий,
Металлы и их соединения в воде
Наиболее распространенные металлы, такие, как натрий,

Из щелочных металлов в водах в наибольших количествах содержатся ионы натрия, в значительно меньших − ионы калия, а остальные металлы в еще меньших количествах. Источником поступления натрия в воды является вымывание залежей натриевых солей (в основном хлорида натрия), имеющихся среди различных пород. Другим источником служат продукты выветривания коренных пород.
Из щелочноземельных металлов наибольшее распространение получили кальций и магний. Основным источником Са2+ в природных водах являются известняки. Другим значительным источником кальция служат процессы растворения гипса. Под воздействием углекислого газа и воды карбонаты кальция превращаются в хорошо растворимые гидрокарбонаты кальция:
СаСО3+ СО2 + Н2О → Са2+ + НСО3-
Ионы магния поступают в воду при растворении доломитов (СаСО3∙MgСО3).
Слайд 51Металлы и их соединения в воде
В водных растворах ионы всех металлов
Металлы и их соединения в воде
В водных растворах ионы всех металлов

В воде, как правило, имеются и другие лиганды, например Cl– , SО42–. органические молекулы и т.д. В водных системах обычно существует конкуренция между различными ионами, реагирующими с ионами металла. Ионы таких металлов, как Mg2+, Ca2+, Zn2+ будут образовывать преимущественно ассоциаты с Cl–, а Pb2+ и Cu2+ с ОН–. При наличии в воде достаточного количества органических соединений преимущественно образуются комплексные соединения с лигандами, занимающими более 1 координационного места.
В реальных условиях встречаются различные комбинации металлов, и в зависимости от этого суммарный эффект токсичности может быть различным. При совместном присутствии действие металлов может быть либо аддитивным, либо токсичность может оказаться больше суммарной (синергизм), либо меньше суммарного действия ионов (антагонизм). Например, смесь цинка и меди в 5 раз более токсична, чем можно было бы ожидать, суммируя действия каждого в отдельности. Цинк и кадмий действуют аддитивно.
→
Слайд 52Важнейшие анионы природных вод
Наиболее распространены в воде хлорид-ионы (Сl–). Их содержание
Важнейшие анионы природных вод
Наиболее распространены в воде хлорид-ионы (Сl–). Их содержание

В сильно минерализованных водах сульфатов обычно меньше, чем хлорид-ионов. Но в пресных водах содержание сульфат-ионов обычно больше, чем хлорид-ионов. Концентрация SO42– зависит от содержания таких ионов, как Cа2+, Ва2+, с которыми образует труднорастворимый осадок. Поступают сульфат-ионы в результате растворения осадочных пород. Могут накапливаться в результате окисления самородной серы в результате реакций:
2S + 3 O2 + 2 H2O ↔ 2 Н2SO4
СаСО3 + Н2SO4 = СаSO4 + СО2 + Н2О
Карбонат- и гидрокарбонат-ионы образуют карбонатную систему природных вод. Источниками образования ионов СО32- и НСО3– служат процессы растворения известняков, доломитов
СаСО3 + СО2 + Н2О → Са(НСО3)2
MgСО3 + СО2 + Н2О → Mg(НСО3)2
При высоких значениях рН гидрокарбонаты переходят в карбонаты, при низких значениях идет обратная реакция.
Слайд 53Биогенные вещества
Содержание нитратов в чистых водоемах оценивается сотыми и десятыми долями
Биогенные вещества
Содержание нитратов в чистых водоемах оценивается сотыми и десятыми долями

Миграции фосфора проще, чем азота, они ограничены лишь землей и водой. Трансформация фосфора в водной среде, как и азота, определяется в основном микроорганизмами. Неорганический фосфор преобразуется прежде всего в АТФ и АДФ, затем участвует в дальнейшем преобразовании органического вещества в биоте. В конце жизненного цикла фосфор в виде неорганического фосфата возвращается в систему. В зависимости от рН естественные формы фосфата могут существовать в разных видах:
Н3РО4 → Н+ + Н2РО4– → 2Н+ + НРО42– → 3Н+ + РО43–
Кремний также является важным биогенным элементом. Многие водные растения, например, диатомовые водоросли, строят из соединений кремния свой скелет.
Слайд 54Органические вещества
Органические вещества природных вод представляют собой довольно широкую гамму соединений.
Органические вещества
Органические вещества природных вод представляют собой довольно широкую гамму соединений.

Количество органических веществ в воде характеризуется величиной окисляемости, т.е. количеством кислорода, расходуемого на окисление примесей сильными окислителями (KMnО4, H2Cr2О7). В чистых водах окисляемость составляет от 1 до 4 мг/л О2. Окисляемость свыше 10 мг/л O2 свидетельствует о загрязнении водоема сточными водами.
Химический состав органических веществ весьма сложен и зависит от происхождения. Большая часть органического вещества находится в коллоидном состоянии, часть – во взвешенном, часть – в истинном растворе.
Источником поступления органических веществ являются процессы разложения отмерших организмов в результате деятельности микроорганизмов, смыв с почв продуктов гумификации, сточные и промышленные воды.
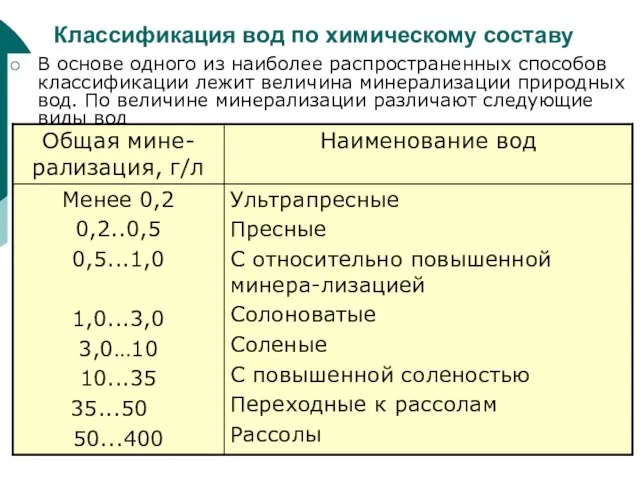
Слайд 55Классификация вод по химическому составу
В основе одного из наиболее распространенных способов классификации
Классификация вод по химическому составу
В основе одного из наиболее распространенных способов классификации
Слайд 56Классификация вод по химическому составу
иная классификация, основанная на делении вод по преобладанию
Классификация вод по химическому составу
иная классификация, основанная на делении вод по преобладанию

Класс гидрокарбонатных и карбонатных вод объединяет пресные и ультрапресные воды рек, озер, значительное количество подземных вод.
Класс хлоридных вод объединяет воды морей, лиманов и подземные солончаковые воды. Сульфатные воды по распространению занимают промежуточное положение.
Каждый класс делится на три группы по преобладающему катиону (кальциевая, магниевая, натриевая). Каждая группа делится на типы в соответствии с количеством ионов. Так в первом типе концентрация бикарбонат-ионов больше, чем суммарная концентрация ионов -Mg2+ и Са2+. Второй тип характеризуется следующим распределением ионов: HCО3– + SO42– > Са2+ + Mg2+ > HCО3– (это большинство подземных вод, реки и озера малой и средней минерализации). Третий тип вод можно обозначить так: Cl– > Nа+; Са2+ + Mg2+ > HCО3– + SO42– (это обычно сильно минерализованные воды океанов, лиманов). Четвертый тип характерен отсутствием бикарбонатов: это кислые воды и содержатся только в сульфатных и хлоридных классах.
Слайд 57Карбонатные системы природных водоемов
В природных водах неорганические соединения углерода находятся в
Карбонатные системы природных водоемов
В природных водах неорганические соединения углерода находятся в

Образующаяся угольная кислота диссоциирует в воде по первой ступени. H2CО3 ↔ H+ + HCО3–
Основная карбонатная система природных вод представляет собой следующую систему: H2О + СО2 ↔ H2CО3 ↔ H+ +НCО3–
Основная карбонатная система обладает буферными свойствами и обеспечивает относительное постоянство рН природных вод.
Из уравнения констант диссоциаций угольной кислота следует, что рН вод зависит от соотношения различных форм угольной кислоты. При низких значениях рН (< 4,2) в воде присутствуют только практически свободная углекислота. При рН = 4,2...8,3 в воде находятся в равновесии свободная угольная кислота и гидрокарбонаты. При рН ≈ 8,3...8,4 в воде находятся практически только гидрокарбонаты, а при рН = 8,4 в воде появляются карбонаты и становятся преобладающей формой ионов при рН = 12.
Слайд 58Карбонатные системы природных водоемов
При нормальных условиях рН природных вод составляет 7,0...8,5.
Карбонатные системы природных водоемов
При нормальных условиях рН природных вод составляет 7,0...8,5.
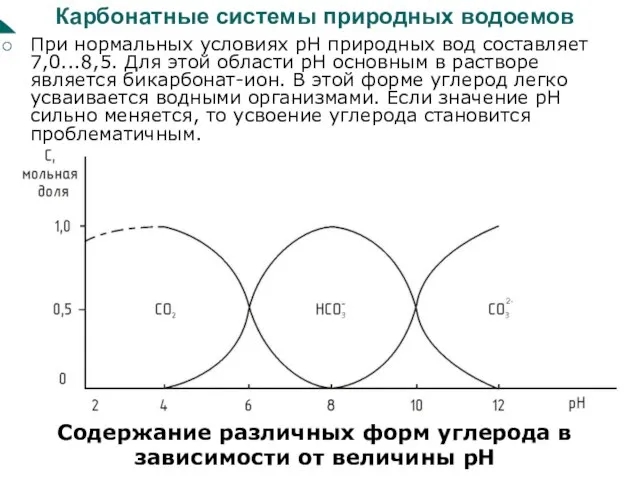
Содержание различных форм углерода в зависимости от величины рН
Слайд 59Буферные свойства карбонатной системы
Кислые и щелочные стоки, попадающие в водоем, могут
Буферные свойства карбонатной системы
Кислые и щелочные стоки, попадающие в водоем, могут

Так, при попадании в водоем щелочных стоков группы OН– будут связываться по схеме Н+ + ОН– → Н2О
Щелочные группы будут связываться тем незначительным количеством ионов Н+, образующихся при диссоциации угольной кислоты. Расход ионов Н+ компенсируется дополнительной диссоциацией угольной кислоты и дополнительным растворением угольного газа в воде. При закислении водоемов буферность карбонатной системы может быть представлена следующей схемой: H+ + НCО3– → Н2О + СО2, т.е. будет происходить связывание протонов и нейтрализация кислых стоков. Расход бикарбонат-ионов будет компенсироваться переходом карбонат-ионов в бикарбонат-ионы.
При высоких значениях рН водоемов (рН > 8,5) буферность водоемов определяется второй буферной системой:
НCО3– ↔ Н+ + СО3–. В этом случае возможны реакции
НCО3– + ОН– → Н2О + СО3 2–
СО3 2– + Н+ ↔ НСО3–
Слайд 60Техногенные процессы закисления водоемов
При поступлении в водоем кислых осадков или стоков
Техногенные процессы закисления водоемов
При поступлении в водоем кислых осадков или стоков

Слайд 61Жесткость воды
Жесткостью воды называется свойство воды, обусловленное содержанием в ней ионов
Жесткость воды
Жесткостью воды называется свойство воды, обусловленное содержанием в ней ионов

Среди природных вод наиболее мягкими являются дождевые воды, жесткость которых составляет примерно 70–100 ммоль/м3. Жесткость подземных вод меняется в широких пределах – от 0,7 моль/м3 (грунтовые воды Карелии) до 18–20 моль/м3 (грунтовые воды Донбасса) – и зависит от состава контактирующих с ними горных пород.
Под карбонатной жесткостью понимается количество ионов кальция и магния, связанных с карбонат- и гидрокарбонат-ионами. Некарбонатная жесткость воды определяется как разность значений общей и карбонатной жесткости. Она обусловлена присутствием кальциевых и магниевых солей сильных кислот (серной, азотной, соляной) и при кипячении не устраняется (постоянная жесткость).
Слайд 62Эвтрофикация водных объектов
Эвтрофикация (eutrophication) – избыточное поступление в водоёмы органических и
Эвтрофикация водных объектов
Эвтрофикация (eutrophication) – избыточное поступление в водоёмы органических и

● уменьшение концентрации растворенного кислорода в воде;
● увеличение содержания биогенных компонентов;
● увеличение содержания взвешенных частиц (особенно органического происхождения);
● последовательная смена популяций водорослей с преобладанием сине-зеленых и зеленых;
● возрастание мутности воды (уменьшение проникновения света);
● значительное увеличение биомассы фитопланктона (при одновременном уменьшении разнообразия видов) и т.д.
Все это приводит к ухудшению кислородного режима (вплоть до заморов), к накоплению в водной среде токсичных органических соединений, что вызывает появление в морях красных приливов.
Слайд 63Источники загрязнения и экологические
последствия загрязнения мирового океана
Загрязнение океана связано главным образом
Источники загрязнения и экологические
последствия загрязнения мирового океана
Загрязнение океана связано главным образом

Основным компонентом нефти являются углеводороды, которые представлены алканами, циклопарафинами, ароматическими, алкенами. Попадая в море, нефть сначала растекается т. виде пленки. При этом происходит испарение с поверхности летучих фракций (до 50%) и растворение в воде (~5%). Наибольшей растворимостью обладают токсичные ароматические углеводороды.
Очень серьезными загрязнителями являются пестициды. В настоящее время накопление пестицидов в воде в ряде районов достигает критических величин. Пути поступления пестицидов в океан многообразны. Прямое поступление происходит при внесении разных групп пестицидов для уничтожения, водных насекомых, водных растений.
В настоящее время во всем мире неуклонно растет производство синтетических поверхностно-активных веществ (ПАВ), которые широко используются как основной компонент моющих средств.
Интенсивное поступление в Мировой океан тяжелых металлов становится серьезной проблемой. Тяжелые металлы широко применяются в различных производствах, поэтому промышленные сточные воды, несмотря на очистительные мероприятия, содержат металлы в очень высоких концентрациях.
Слайд 64Строение и элементный состав литосферы
Считают, что Земля образовалась из протопланетного облака и
Строение и элементный состав литосферы
Считают, что Земля образовалась из протопланетного облака и

Слайд 65Строение и элементный состав литосферы
Планета Земля состоит из трех основных оболочек: коры,
Строение и элементный состав литосферы
Планета Земля состоит из трех основных оболочек: коры,

Большая разница между высокой плотностью Земли (среднее 5,52 г/см3) и малой плотностью ее верхних слоев (2,7–3,0 г/см3) указывает на наличие в центральных областях планеты плотных масс, слагающих ядро. Новые геофизические данные и данные по физике высоких давлений свидетельствуют о различном химическом составе основных оболочек Земли: земной коры, мантии и ядра, и указывают на жидкое состояние большей части земного ядра
Слайд 66Схема внутреннего строения Земли
Схема внутреннего строения Земли
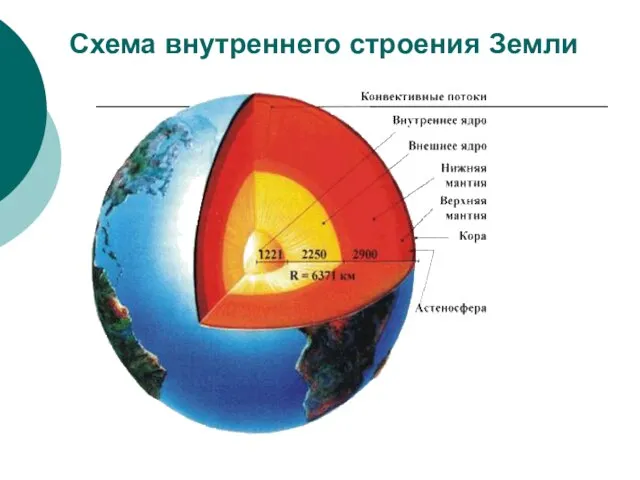
Слайд 67Ядро Земли состоит из сплава железа с более легким элементом, которым может
Ядро Земли состоит из сплава железа с более легким элементом, которым может

Верхний тонкий слой, средней мощностью около 35 км (от 5 км под материками до 75 км под высокими горами на континентах) называют земной корой. От лежащей ниже мантии, ее отделяет граница Мохоровичича (поверхность Мохо).
Мантия − самый мощный слой − состоит из магния, железа и свинца. Мантия мощностью около 2865 км (от 35 до 2900 км) составляет 83 % объема Земли и 2/3 ее массы. Вещество мантии находится в основном в твердом кристаллическом состоянии, скорость сейсмических волн растет с глубиной. В верхней части мантии, на глубинах 50–300 км выделяют слой пониженной твердости, прочности и вязкости – астеносферу. Вещество здесь находится в аморфном, пластичном состоянии, с его колебаниями связывают тектонические движения, явления магматизма и метаморфизма в земной коре.
Выделяют нижнюю и верхнюю мантию. Температура мантии около +2000 °С. Ученые установили, что температура горных пород с глубиной возрастает: в среднем на каждые 30 м глубины Земли становится теплее на 1 °С. Мантия получает огромное количество тепла от ядра Земли, которое ещё горячее.
Слайд 68Ядро и литосфера
Внутренняя часть Земли называется ядром. Его повышенную плотность (от
Ядро и литосфера
Внутренняя часть Земли называется ядром. Его повышенную плотность (от

В условиях сильного разогрева и частичного расплавления вещества планеты более тяжелые элементы (железо, никель и др.) «тонули» – они составили ядро, а относительно легкие (кремний, алюминий) «всплывали» – из них сформировались земная кора. Выделяющиеся из расплава газы и пары воды положили начало атмосфере и гидросфере.
Слой мантии, лежащий выше астеносферы, вместе с земной корой называют литосферой (от греч. lithos – камень и sphaira – шар). Это относительно хрупкая твердая оболочка Земли, разбитая глубинными разломами на крупные блоки – литосферные плиты. Эти плиты перемещаются по разжиженному слою мантии относительно друг друга. Литосферные плиты бывают материковые и океанические.
Слайд 69Верхняя часть литосферы – земная кора на 90 % состоит из 8
Верхняя часть литосферы – земная кора на 90 % состоит из 8

Верхний слой земной коры состоит из достаточно мягких горных пород. Они образованы в результате разрушения твёрдых пород (например, песок), отложения останков животных (мел) или растений (уголь), осаждения на дно морей и океанов разных веществ (поваренная соль).
Следующий слой земной коры – гранитный. Гранит называют магматической породой. Он образовался из магмы в толще земной коры в условиях высоких температур и давления. «Магма» в переводе с греческого означает «густая мазь». Она представляет собой расплавленное вещество земных недр, которое заполняет трещины в земной коре. При ее застывании образуется гранит. Химический анализ гранита показывает, что он содержит большое количество самых разных минералов – кремнезема, алюминия, кальция, калия, натрия.
Земная кора
Слайд 70 Наземная среда обитания расположена на континентальной коре, громадном резервуаре магматических и
Наземная среда обитания расположена на континентальной коре, громадном резервуаре магматических и
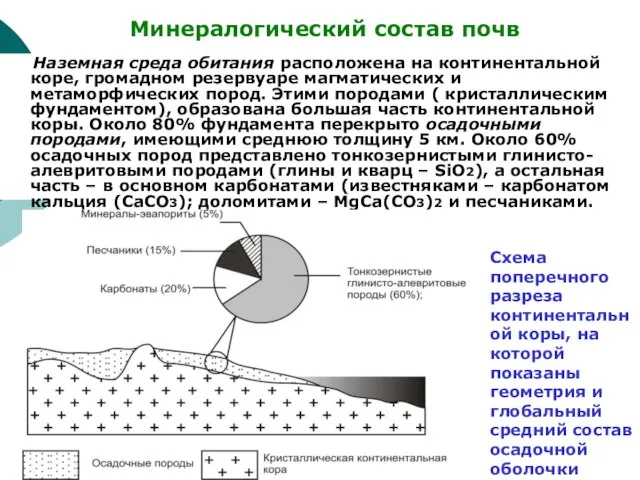
Минералогический состав почв
Схема поперечного разреза континентальной коры, на которой показаны
геометрия и глобальный средний состав осадочной оболочки
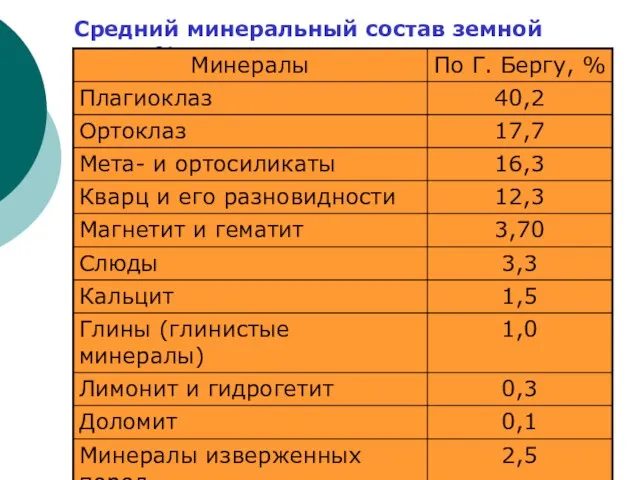
Слайд 71Средний минеральный состав земной коры, %
Средний минеральный состав земной коры, %
Слайд 72Глинистые минералы представлены небольшими чешуйками размером < 4 мкм (иногда считается, что
Глинистые минералы представлены небольшими чешуйками размером < 4 мкм (иногда считается, что

Глинистые минералы – это слоистые силикаты, построенные из слоев атомов в тетраэдрической и октаэдрической координации, известных как тетраэдрические и октаэдрические сетки.
Алюминий является распространенным катионом, и идеальный октаэдрический слой имеет состав гидроксида алюминия – минерала гиббсита (А1(ОН)3).
Глинистые минералы
Слайд 73Простейшим расположением тетраэдрических и октаэдрических сеток являются слои 1 : 1 (один
Простейшим расположением тетраэдрических и октаэдрических сеток являются слои 1 : 1 (один
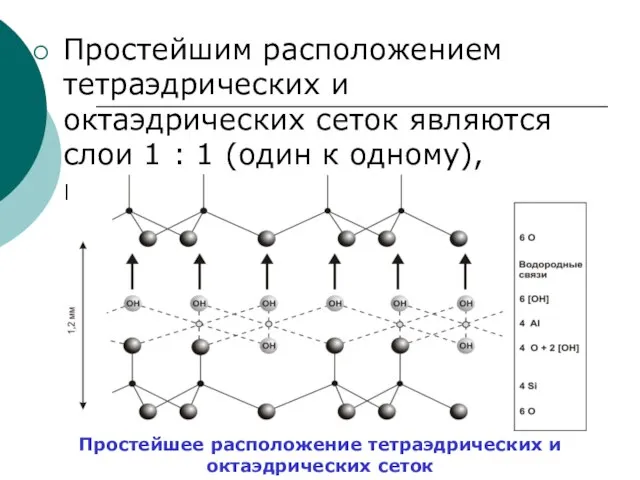
Простейшее расположение тетраэдрических и октаэдрических сеток
Слайд 74Другим важным структурным расположением является структура 2 : 1 (два к одному),
Другим важным структурным расположением является структура 2 : 1 (два к одному),
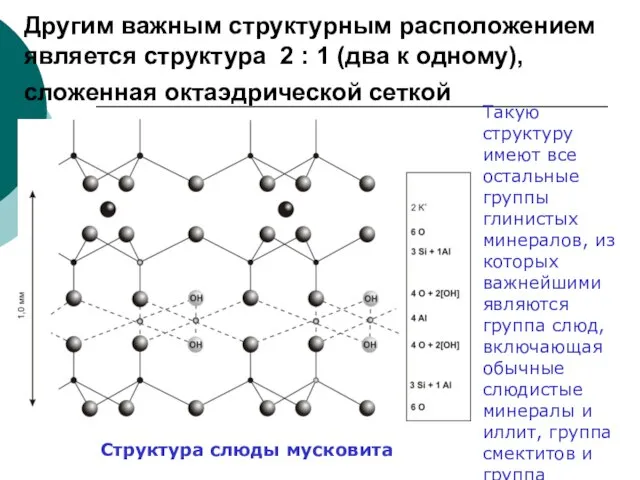
Структура слюды мусковита
Такую структуру имеют все остальные группы глинистых минералов, из которых важнейшими являются группа слюд, включающая обычные слюдистые минералы и иллит, группа смектитов и группа хлоритов.
Слайд 75Поглотительные способности почв
Поглотительной способностью почв называется свойство ее компонентов (твердой, жидкой,
Поглотительные способности почв
Поглотительной способностью почв называется свойство ее компонентов (твердой, жидкой,

Механическая поглотительная способность – свойство почвы поглощать поступающие с водным и воздушным потоком твердые частицы, размеры которых превышают размеры почвенных пор. Почва поглощает также и атмосферную пыль, а вместе с ней и техногенные загрязнения.
Химическая поглотительная способность обусловлена образованием в результате происходящих в почве химических реакций труднорастворимых соединений, выпадающих из раствора в осадок.
Поступающие в почву в составе атмосферных, грунтовых, поливных вод катионы и анионы могут образовывать с солями почвенного раствора нерастворимые или трудно растворимые соединения. Например:
Al(OH)3 + H3PO4 → AlPO4↓+ 3H2O
Na2CO3 + CaSO4 → CaCO3↓+ Na2SO4
Слайд 76Физическая поглотительная способность
Физическая поглотительная способность связана с изменением концентрации молекул на поверхности
Физическая поглотительная способность
Физическая поглотительная способность связана с изменением концентрации молекул на поверхности

Сухая почва сорбирует газы, которые образуют тонкую пленку на поверхности частиц. По способности сорбироваться газы располагаются в следующий ряд: N2 < O2 < O2. Степень сорбции, в основном, зависит от давления и температуры. Чем ниже температура и выше давление, тем больше сорбция газа. При увлажнении почвы сорбированные газы вытесняются молекулами воды.
Слайд 77Обменная поглотительная способность
Физико-химическая или обменная поглотительная способность − способность почвы поглощать и
Обменная поглотительная способность
Физико-химическая или обменная поглотительная способность − способность почвы поглощать и

Слайд 78Катионнообменная способность
Катионнообменную способность почв относят к числу фундаментальных свойств почвы.
Было показано, что
Катионнообменная способность
Катионнообменную способность почв относят к числу фундаментальных свойств почвы.
Было показано, что

Вся совокупность органических и минеральных коллоидных частиц почвы (представленных гумусовыми веществами, глинистыми минералами и гидроксидами железа и алюминия), участвующих в обменном поглощении катионов, была названа К.К. Гедройцем почвенным поглощающим комплексом (ППК). Способность органических и минеральных коллоидных частиц к обменному поглощению катионов обусловлена тем, что большая часть их имеет отрицательные заряды.
Катионы, которые входят в состав ППК и могут быть замещены в процессе ионного обмена, называются обменными катионами. Наиболее часто принимают участие в реакциях обмена катионы Са2+, Mg2+, K+, Na+, NH4+, H+, Al3+.
Поглотительную способность почв характеризует величина емкости поглощения. Она зависит от механического и минералогического состава почвы и содержания в ней органического вещества. Почвы с малым количеством коллоидной фракции (песчаные и супесчаные) имеют невысокую емкость поглощения.
Слайд 79Круговорот фосфора
Химическое поглощение (фиксация) фосфора обусловливает слабую подвижность его в почве
Круговорот фосфора
Химическое поглощение (фиксация) фосфора обусловливает слабую подвижность его в почве

Запасы фосфора, доступные живым существам, сосредоточены в литосфере и сравнительно невелики (не более 1 %). Этот необходимый всем организмам элемент, контролирующий первичную продуктивность биосферы, лимитирует накопление фитомассы и является главным регулятором биогеохимических циклов. Между тем его круговорот в биосфере не замкнут.
Слайд 80Биологическая поглотительная способность почв
Биологическая поглотительная способность почв обусловлена способностью живых почвообитающих организмов
Биологическая поглотительная способность почв
Биологическая поглотительная способность почв обусловлена способностью живых почвообитающих организмов

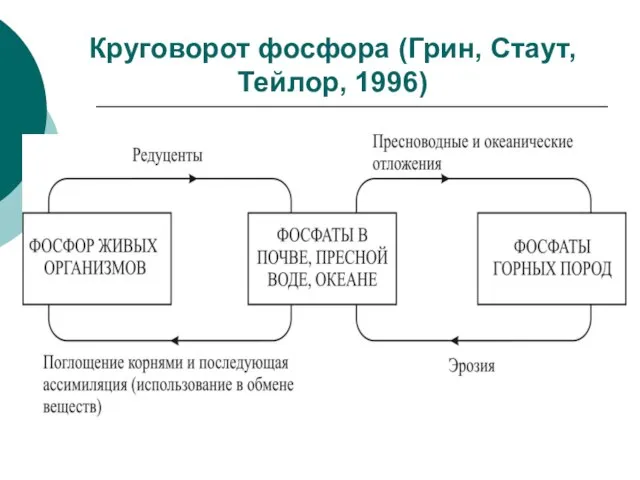
Слайд 81Круговорот фосфора (Грин, Стаут, Тейлор, 1996)
Круговорот фосфора (Грин, Стаут, Тейлор, 1996)
Слайд 82Круговорот фосфора
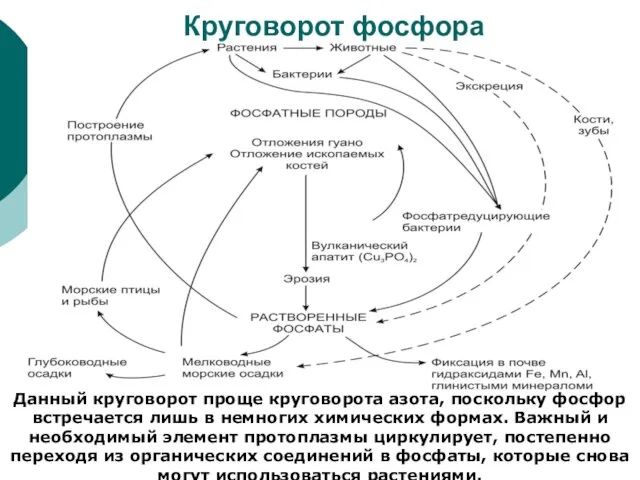
Данный круговорот проще круговорота азота, поскольку фосфор встречается лишь в
Круговорот фосфора
Данный круговорот проще круговорота азота, поскольку фосфор встречается лишь в
Слайд 83Круговорот фосфора
При внесении в почву химических фосфорных удобрений происходит химическое связывание
Круговорот фосфора
При внесении в почву химических фосфорных удобрений происходит химическое связывание

Неумеренное использование фосфорных удобрений, особенно на почвах, где подвижность фосфатов низкая, вызывает зафосфачивание почв. Хотя фосфор не относится к токсичным элементам, тем не менее повышенная концентрация солей в почве, возникающая при зафосфачивании, отрицательно влияет на рост и развитие растений, особенно в начале вегетации. Кроме того, зафосфачивание почв, усиливая относительный дефицит других элементов, приводит к экологически опасному типу нарушения питания растений другими элементами, в том числе и тяжелыми металлами.
Слайд 84Тенденции круговорота фосфора
1. Мобилизация фосфора из агроруд и шлаков, производство и применение
Тенденции круговорота фосфора
1. Мобилизация фосфора из агроруд и шлаков, производство и применение

2. Производство многочисленных фосфорсодержащих препаратов и их применение в быту.
3. Производство фосфорсодержащих ресурсов продовольствия и кормов, вывоз и потребление их в зонах концентрации населения и больших городов.
4. Развитие рыбного и китобойного промыслов, добыча морских моллюсков, водорослей влечет за собой перераспределение фосфора с океана на сушу.
5. В итоге наблюдается фосфотизация суши. Увеличивается содержание фосфора в окружающей среде больших городов, индустриальных центров, и наоборот, страны, экспортирующие органические продукты и не применяющие фосфорных удобрений, теряют его запасы в своих почвах.
 СОВЕЩАНИЕ ПО СТРОИТЕЛЬСТВУ ОБЪЕКТОВ ОБРАЗОВАНИЯ ПО ПРОЕКТАМ ПОВТОРНОГО ПРИМЕНЕНИЯНА ТЕРРИТОРИИ КРАСНОЯРСКОГО КРАЯ
СОВЕЩАНИЕ ПО СТРОИТЕЛЬСТВУ ОБЪЕКТОВ ОБРАЗОВАНИЯ ПО ПРОЕКТАМ ПОВТОРНОГО ПРИМЕНЕНИЯНА ТЕРРИТОРИИ КРАСНОЯРСКОГО КРАЯ Психофизиологические особенности использования ИКТ
Психофизиологические особенности использования ИКТ Ракеткой - по гиподинамии! . Социальный проект учащихся
Ракеткой - по гиподинамии! . Социальный проект учащихся Что? Где?
Что? Где? Признаки утомления и переутомления. Меры по их предупреждению
Признаки утомления и переутомления. Меры по их предупреждению Эскизные проекты зданий
Эскизные проекты зданий Конкурс проектных работ имени академика А.А. Бочвара в институте экотехнологий и инжиниринга
Конкурс проектных работ имени академика А.А. Бочвара в институте экотехнологий и инжиниринга Судебные стратегии и механизмы защиты от претензий контрагентов
Судебные стратегии и механизмы защиты от претензий контрагентов Путешествие по стране дорожных знаков
Путешествие по стране дорожных знаков Создание Центра комплексной экспертизы и развития управленческих компетенций Импульс ДВ
Создание Центра комплексной экспертизы и развития управленческих компетенций Импульс ДВ CASE-средство IBM Rational Rose
CASE-средство IBM Rational Rose Информационно-аналитический центр
Информационно-аналитический центр Типы парламентов и их влияние на законотворческий процесс. Общая структура и назначение
Типы парламентов и их влияние на законотворческий процесс. Общая структура и назначение Трансформаторы для выпрямительных установок
Трансформаторы для выпрямительных установок Презентация на тему Сельское хозяйство мира
Презентация на тему Сельское хозяйство мира Химическая связь и ее типы
Химическая связь и ее типы Рок и металл
Рок и металл Структура грошової системи
Структура грошової системи 7-Б литература 27.10
7-Б литература 27.10 Презентация на тему Путь к успеху
Презентация на тему Путь к успеху  Государство как субъект управления
Государство как субъект управления Гигиена – залог здоровья
Гигиена – залог здоровья Международные перевозки и их виды Подготовила: Клеутина С.А. ДС-01
Международные перевозки и их виды Подготовила: Клеутина С.А. ДС-01 Анализ перехода на новые образовательные стандарты субъектов ЮФО (по данным электронного мониторинга)
Анализ перехода на новые образовательные стандарты субъектов ЮФО (по данным электронного мониторинга) Современные образовательные технологии на уроке и во внеурочной деятельности по физике
Современные образовательные технологии на уроке и во внеурочной деятельности по физике ЗАО «Медицина и новые технологии»
ЗАО «Медицина и новые технологии» Критерии оценивания проекта
Критерии оценивания проекта Нации и межнациональные отношения
Нации и межнациональные отношения