Содержание
- 2. Которое зовут озоном. И в этом есть большой резон: В грозу запахнет над газоном – От
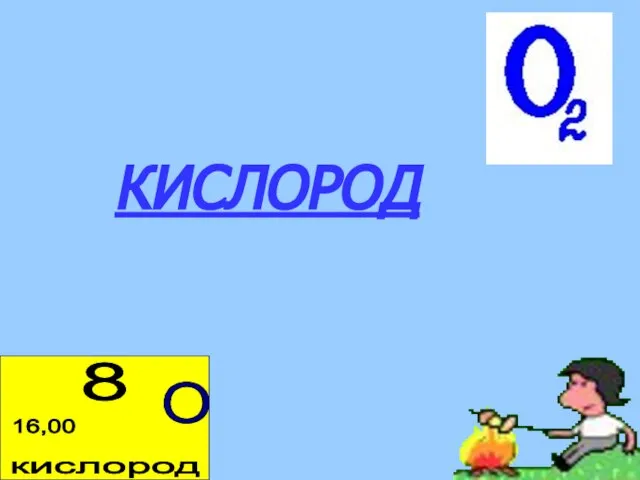
- 3. КИСЛОРОД
- 4. ЦЕЛИ УРОКА: ДАТЬ ОБЩУЮ ХАРАКТЕРИСТИКУ ЭЛЕМЕНТУ КИСЛОРОД. РАССМОТРЕТЬ РАСПРОСТРАНЕНИЕ КИСЛОРОДА В ПРИРОДЕ. ИЗУЧИТЬ ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ
- 5. 1. ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТА «КИСЛОРОД» Химический знак О Положение в ПСХЭ период II, группа VIА, порядковый
- 6. 2. РАСПРОСТРАНЕНИЕ КИСЛОРОДА В ПРИРОДЕ Первое место по распространенности в земной коре, т.е. литосфере, занимает кислород
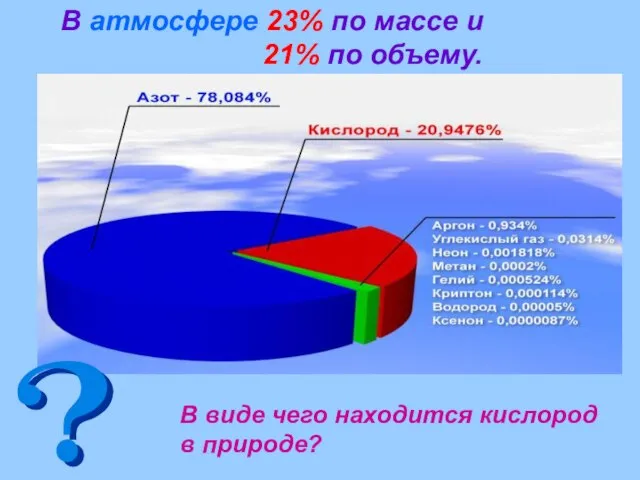
- 7. В атмосфере 23% по массе и 21% по объему. В виде чего находится кислород в природе?
- 8. Карл Вильгельм Шееле (шведский химик) в 1772 году получил и детально исследовал «огненный воздух», в котором
- 9. Антуан Лавуазье в 1774 году провел эксперимент и доказал, что воздух состоит на 1/5 часть из
- 10. 3. ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА Кислород – газ, без цвета и запаха, мало растворим в воде (в
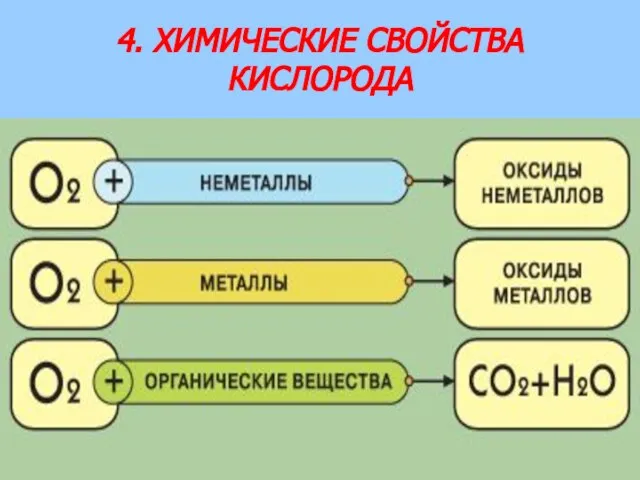
- 11. 4. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА
- 12. ЗАДАНИЕ: СОСТАВЬТЕ УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ ГОРЕНИЯ, НАПРИМЕР, СЕРЫ (VI), НАТРИЯ, МЕТАНА (CH4). Проверьте себя. 2S +
- 13. 5. СПОСОБЫ ПОЛУЧЕНИЯ КИСЛОРОДА 1. В промышленности кислород получают из воздуха. Воздух представляет собой смесь различных
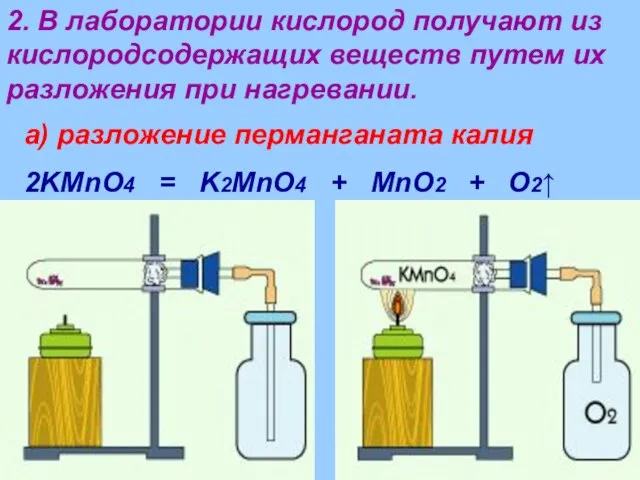
- 14. 2. В лаборатории кислород получают из кислородсодержащих веществ путем их разложения при нагревании. а) разложение перманганата
- 15. б) электролиз воды 2H2O = 2H2↑ + O2↑ в) разложение пероксида водорода 2H2O2 = 2H2O +
- 16. Джозеф Пристли (английский ученый) в 1774 году разложением оксида ртути (II) открыл кислород и изучил его
- 17. 6. ПРИМЕНЕНИЕ КИСЛОРОДА ЧЕЛОВЕКОМ
- 19. Скачать презентацию












 Профессия - Артист цирка. Поговорим о дрессировщиках
Профессия - Артист цирка. Поговорим о дрессировщиках Тест по творчеству Л.Н.ТолстогоЛитература 10 класс
Тест по творчеству Л.Н.ТолстогоЛитература 10 класс Великая Отечественная война в стихотворениях
Великая Отечественная война в стихотворениях Психология манипуляции
Психология манипуляции Логистический планировщик
Логистический планировщик Русские национальные виды спорта и игры
Русские национальные виды спорта и игры Проблема закона об оружии
Проблема закона об оружии Il cigno
Il cigno Австралия. Знакомство с материком 7 класс
Австралия. Знакомство с материком 7 класс The geography of the USA
The geography of the USA  Буддизм
Буддизм Грибы в Чёнках
Грибы в Чёнках Отдел по эксплуатации электросетей Ишимбая и Салавата
Отдел по эксплуатации электросетей Ишимбая и Салавата Комплексный подход кавтоматизацииЖКХ
Комплексный подход кавтоматизацииЖКХ Расчет элементов тепловой схемы ТЭС
Расчет элементов тепловой схемы ТЭС Экономическое управление бизнес-процессом диагностики состояния инфраструктуры. Выпускная аттестационная работа
Экономическое управление бизнес-процессом диагностики состояния инфраструктуры. Выпускная аттестационная работа Соловецкий монастырь
Соловецкий монастырь Заседание секции городского методического объединения учителей истории и обществознания28 марта 2006 года
Заседание секции городского методического объединения учителей истории и обществознания28 марта 2006 года SLA-ON Сервер Больше чем просто мониторинг. SLA-ON Сервер.
SLA-ON Сервер Больше чем просто мониторинг. SLA-ON Сервер. - пре- - при -
- пре- - при - Оценка рисков, связанных с реструктуризацией фирмы
Оценка рисков, связанных с реструктуризацией фирмы Коста-Рика
Коста-Рика «Проектный метод как средство социально-личностного развития дошкольника»
«Проектный метод как средство социально-личностного развития дошкольника» Классификация персональных компьютеров. Сизонов Вадим
Классификация персональных компьютеров. Сизонов Вадим 2.2. ОПРЕДЕЛЕНИЕ И ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ИНФОРМАЦИОННОГО ОБЩЕСТВА
2.2. ОПРЕДЕЛЕНИЕ И ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ИНФОРМАЦИОННОГО ОБЩЕСТВА Жизнь и деятельность Д.И.Менделеева
Жизнь и деятельность Д.И.Менделеева Управление стоимостью проекта (на основе стандарта PMI PMBOK Guide 4th Edition)
Управление стоимостью проекта (на основе стандарта PMI PMBOK Guide 4th Edition) Творчество А.С. Пушкина
Творчество А.С. Пушкина