Содержание
- 2. Меню Строение и свойства атомов. От металла к неметаллу. Добрый Литий. А где выгода? Открытие щелочных
- 3. Строение и свойства атомов. Щелочные металлы - это элементы главной подгруппы 1 группы Периодической системы Д.И.Менделеева:
- 4. Элемент легко отдает электроны, если их на внешнем энергетическом уровне мало (поэтому элементы первых трех групп,
- 5. В большом семиэтажном доме, в подъезде щелочных металлов, на втором этаже жил Литий - самый легкий
- 6. А где выгода? Спрашивает Натрий: «Почему ты, брат Литий, все свои электроны кислороду отдаешь? Не лучше
- 7. Открытие щелочных металлов Литий был открыт шведским химиком И. Арфведсоном в 1817г. и по предложению Й.
- 8. По многим свойствам металлы очень отличаются друг от друга: литий вдвое легче воды, а осмий тяжелее
- 9. Периодическая таблица, которую Менделеев составлял с конца 1860-х годов, не сразу получила признание, но впоследствии сделала
- 11. Скачать презентацию
Слайд 2Меню
Строение и свойства атомов.
От металла к неметаллу.
Добрый Литий.
А где выгода?
Открытие щелочных металлов.
В
Меню
Строение и свойства атомов.
От металла к неметаллу.
Добрый Литий.
А где выгода?
Открытие щелочных металлов.
В

Самый известный ученый!
Слайд 3Строение и свойства атомов.
Щелочные металлы - это элементы главной подгруппы 1 группы
Строение и свойства атомов.
Щелочные металлы - это элементы главной подгруппы 1 группы

Франций – редкий радиоактивный элемент.
На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемуся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются очень сильными восстановителями.
Во всех своих соединениях щелочные металлы проявляют степень окисления +1. Восстановительные свойства их усиливаются при переходе от Li к Cs, что связанно с ростом радиусов их атомов.
Слайд 4Элемент легко отдает электроны, если их на внешнем энергетическом уровне мало (поэтому
Элемент легко отдает электроны, если их на внешнем энергетическом уровне мало (поэтому
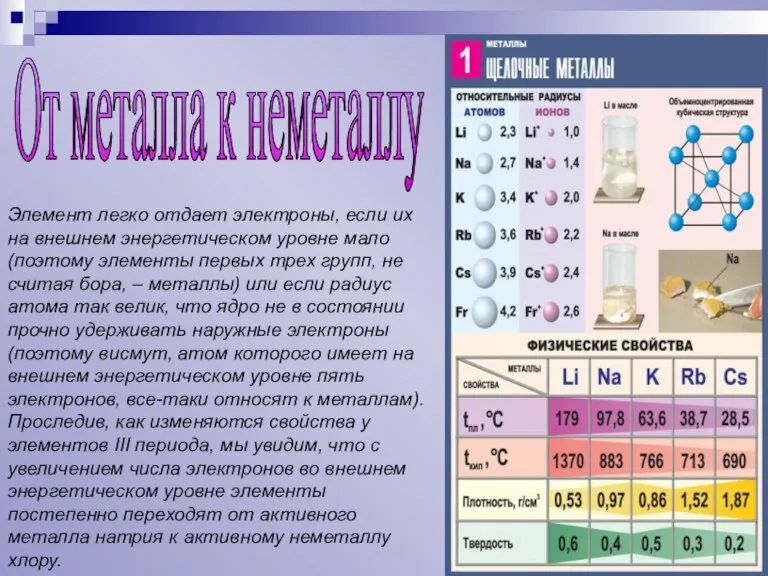
От металла к неметаллу
Слайд 5 В большом семиэтажном доме, в подъезде щелочных металлов, на
втором этаже жил
В большом семиэтажном доме, в подъезде щелочных металлов, на
втором этаже жил

Но все же Литий не был во всех отношениях похожим на своих собратьев: он был добр, щедр и прост. Он с охотой отдавал свои электроны и Кислороду, и Азоту, и многим другим элементам. Из-за этих-то особенностей Литий страдал, так как другие щелочные металлы, особенно такие хитрые, как Калий и Натрий, не давали ему прохода. Дело было в том, что, когда щелочные металлы горели в кислороде, каждые их два атома отдавали одной молекуле кислорода два своих электрона- каждому атому по одному. Остальные электроны они припрятывали до поры до времени. Литий же был честен – отдавал молекуле Кислорода в два раза больше электронов, чем остальные металлы: на четыре атома Лития - четыре электрона. Да и с Азотом Литий взаимодействовал спокойно, при обычной температуре, не то что другие - при нагревании.
И решили Натрий и Калий допытаться у Лития: почему он так поступает? Нет ли в его поведении каких-либо скрытых выгод?
Добрый Литий
Слайд 6А где выгода?
Спрашивает Натрий: «Почему ты, брат Литий, все свои электроны кислороду
А где выгода?
Спрашивает Натрий: «Почему ты, брат Литий, все свои электроны кислороду

Отвечал Литий: «Я всегда рад помочь другим, не то что вы - жадничаете. Я рад, что в моем оксиде Кислород имеет свою обычную степень окисления -2, не то что -1 в ваших странных, ни на что не похожих пероксидах». Сказал так и ушел восвояси. Долго стояли Натрий и Калий в раздумье, но так ничего и не поняли. И сейчас с Кислородом продолжают пероксиды образовывать. А оксиды состава M2O дают лишь тогда, когда их силой заставят, т.е. создадут соответствующие условия – нагревают пероксиды (Na2O2) с таким же металлом – «жадиной (Na)».
Слайд 7Открытие щелочных металлов
Литий был открыт шведским химиком И. Арфведсоном в 1817г.
и
Открытие щелочных металлов
Литий был открыт шведским химиком И. Арфведсоном в 1817г.
и

литос – камень), так как в отличии от калия, который до тех пор
находили только в золе растений, он был обнаружен в камне.
Натрий и калий были впервые получены английским химиком и
физиком Г. Дэви в 1807г. при электролизе едких щелочей. Й. Берцелиус
предложил назвать элемент N 11 натрием (от араб. натрун – сода),
а элемент N 19 по предложению Гильберта получил название калий
(от араб. Алкали – щелочь).
Слайд 8По многим свойствам металлы очень отличаются друг от друга: литий вдвое легче
По многим свойствам металлы очень отличаются друг от друга: литий вдвое легче

Он – «пограничный» элемент, за которым следуют неметаллы. Поскольку у элементов от скандия до никеля на внешнем энергетическом уровне не больше двух электронов, то они металлы. Каждый большой период включает в себя подобный ряд, состоящий только из металлов.
В чем же отличие?
Слайд 9Периодическая таблица, которую Менделеев составлял с конца 1860-х годов, не сразу получила признание,
Периодическая таблица, которую Менделеев составлял с конца 1860-х годов, не сразу получила признание,

Самый известный ученый!
 Развитие науки Вторая половина XIX века
Развитие науки Вторая половина XIX века Финансовая грамотность дошкольников
Финансовая грамотность дошкольников Встречают по одежке. Дизайн современной одежды
Встречают по одежке. Дизайн современной одежды Проекты использования генераторного газа в коммунальной теплоэнергетике
Проекты использования генераторного газа в коммунальной теплоэнергетике Профессия бухгалтер
Профессия бухгалтер День 4. Применять возрождение на практике
День 4. Применять возрождение на практике История сварочного дела. Славянов Николай Гаврилович
История сварочного дела. Славянов Николай Гаврилович КВАДРАНТ КИЙОСАКИ
КВАДРАНТ КИЙОСАКИ Быстрые методы гигиенического мониторинга
Быстрые методы гигиенического мониторинга Каменная соль – чудо-минерал
Каменная соль – чудо-минерал "Воспитание толерантности"
"Воспитание толерантности" АВТОМАТИЗАЦИЯ ЗВУКА Р, Рь В СЛОВАХ
АВТОМАТИЗАЦИЯ ЗВУКА Р, Рь В СЛОВАХ ЦЕЛЬ: РАСШИРИТЬ ЗНАНИЕ УЧАЩИХСЯ О ПРАВИЛЬНОМ ПИТАНИИ
ЦЕЛЬ: РАСШИРИТЬ ЗНАНИЕ УЧАЩИХСЯ О ПРАВИЛЬНОМ ПИТАНИИ Подготовка к ВПР (№ 8) (геометрические задания). Математика. УМК: любой. 6 класс
Подготовка к ВПР (№ 8) (геометрические задания). Математика. УМК: любой. 6 класс Жизнь и творчество Д.Н.Ушакова
Жизнь и творчество Д.Н.Ушакова SELFLLERY Рынок цифровой фотографии
SELFLLERY Рынок цифровой фотографии Соблюдение лицензионных требований в сфере телерадиовещания
Соблюдение лицензионных требований в сфере телерадиовещания LR5_1ch__Stoimostnye_kharakteristiki_informatsionnoy_deyatelnosti
LR5_1ch__Stoimostnye_kharakteristiki_informatsionnoy_deyatelnosti Земля отцов – моя земля (из истории местных географических названий)
Земля отцов – моя земля (из истории местных географических названий) Движение
Движение Бораны и карбораны
Бораны и карбораны Время глагола
Время глагола походами ходили
походами ходили Компьютер Что это такое?
Компьютер Что это такое? Международный день чая
Международный день чая Декоративное убранство русского северного дома
Декоративное убранство русского северного дома Александр Солженицын
Александр Солженицын Совет единомышленников ГБОУ СОШ № 2001
Совет единомышленников ГБОУ СОШ № 2001