Содержание
- 2. Предмет и задачи молекулярной физики и термодинамики Молекулярная физика – раздел физики, изучающий строение и свойства
- 3. Термодинамическая система – совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией, как между собой, так и
- 4. Любое изменение в термодинамической системе, связанное с изменением хотя бы одного из ее термодинамических параметров, называется
- 5. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ Основные положения молекулярно-кинетической теории Молекулярно-кинетическая теория (МКТ) основана на статистическом методе, поэтому иногда ее
- 6. Строение вещества Современные приборы позволяют наблюдать изображения отдельных атомов и молекул. С помощью электронного микроскопа или
- 7. Логика рассуждений Демокрита, если перевести ее на современный язык, была крайне проста. Представим, говорил он, что
- 8. Хаотическое движение частиц Непрерывное хаотическое движение частиц подтверждается броуновским движением и диффузией. Хаотичность движения означает, что
- 9. Броуновское движение (или брауновское движение) – это непрерывное хаотическое движение малых частиц, взвешенных в жидкости или
- 10. Роберт Броун родился 21 декабря 1773 года в Монтрозе в Шотландии, учился в Абердине, в Эдинбургском
- 11. Взаимодействие частиц Существование устойчивых жидких и твёрдых тел объясняется наличием сил межмолекулярного взаимодействия (сил взаимного притяжения
- 12. Частицы веществ способны отталкиваться друг от друга. Это подтверждается тем, что жидкие, а особенно твердые тела
- 13. Сила взаимодействия между молекулами имеет определённую зависимость от расстояния между молекулами. Эта зависимость изображена на рисунке.
- 14. Зависимость сил взаимодействия молекул от расстояния между ними качественно объясняет молекулярный механизм появления сил упругости в
- 15. Масса и размеры молекул. Количество вещества Массы атомов и молекул малы и составляют величины порядка 10-26
- 16. Многие опыты показывают, что размер молекулы очень мал. Линейный размер молекулы или атома можно найти различными
- 17. В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса, которая, как указывалось, измеряется в
- 18. Это огромное число называется числом Авогадро . То есть числом Авогадро называется число атомов, содержащихся в
- 19. Итак, количество вещества ν равно отношению числа молекул в данном теле к числу атомов в 12
- 20. Количество вещества равно отношению массы вещества к его молярной массе: ν = m / μ Массу
- 21. Агрегатные состояния вещества Молекулярно-кинетическая теория даёт объяснение тому, что все вещества могут находиться в трёх основных
- 22. Движение молекул в газах В газах обычно расстояние между молекулами и атомами значительно больше размеров молекул,
- 23. Движение молекул в жидкостях В жидкостях молекулы не только колеблются около положения равновесия, но и совершают
- 24. Движение молекул в твёрдых телах Молекулы и атомы твёрдого тела расположены в определённом порядке и образуют
- 25. Температура и её физический смысл Существование состояния термодинамического равновесия называют первым исходным положением термодинамики. Вторым исходным
- 26. В равновесном состоянии температура имеет одинаковое значение для всех макроскопических частей системы. Если в системе два
- 27. Чтобы измерить температуру какого-либо тела, его необходимо привести в тепловой контакт с «пробным» телом — термометром.
- 28. Единицы и шкалы измерения температуры Из того, что температура — это мера кинетической энергии молекул, ясно,
- 29. Уи́льям То́мсон, лорд Ке́львин, род. 26 июня 1824 года в Белфасте, Ирландия; умер 17 декабря 1907
- 30. Шкала Цельсия В технике, медицине, метеорологии и в быту используется шкала Цельсия, в которой точка замерзания
- 31. Шкала Фаренгейта В Англии и, в особенности, в США используется шкала Фаренгейта. Ноль градусов Цельсия —
- 32. Энергия теплового движения при абсолютном нуле Когда материя охлаждается, многие формы тепловой энергии и связанные с
- 33. Интересные факты Самая низкая температура на Земле до 1910 г.: −68 °С, Верхоянск Поверхность Солнца имеет
- 35. Скачать презентацию
Слайд 2Предмет и задачи молекулярной физики и термодинамики
Молекулярная физика – раздел физики, изучающий
Предмет и задачи молекулярной физики и термодинамики
Молекулярная физика – раздел физики, изучающий

Законы поведения совокупностей молекул являются статистическими закономерностями и изучаются с помощью статистического метода, согласно которому свойства макроскопической системы определяются в конечном счете усредненными значениями динамических характеристик частиц (скорости, ускорения, и т. д.).
Термодинамика - раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями. В основе термодинамики лежат несколько фундаментальных законов (начал), которые обобщают экспериментальные данные и выполняются независимо от конкретной природы макроскопической системы.
Слайд 3Термодинамическая система – совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией, как
Термодинамическая система – совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией, как

Состояние системы задается термодинамическими параметрами (параметрами состояния) – совокупностью физических величин, характеризующих свойства термодинамической системы (температура, давление, объем и т. д.)
Слайд 4Любое изменение в термодинамической системе, связанное с изменением хотя бы одного из
Любое изменение в термодинамической системе, связанное с изменением хотя бы одного из

Макроскопическая система находится в состоянии термодинамического равновесия, если ее состояние не изменяется с течением времени.
Таким образом, у молекулярной физики и термодинамики общий предмет изучения – свойства веществ и происходящие в них процессы. Подходя к изучению этих свойств и процессов с различных точек зрения, молекулярная физика и термодинамика взаимно дополняют друг друга, образуя единое целое
Слайд 5МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ
Основные положения молекулярно-кинетической теории
Молекулярно-кинетическая теория (МКТ) основана на статистическом методе, поэтому
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ
Основные положения молекулярно-кинетической теории
Молекулярно-кинетическая теория (МКТ) основана на статистическом методе, поэтому

МКТ изучает микроскопическую структуру макроскопических объектов.
Основные положения МКТ:
Вещество имеет дискретную структуру – состоит из частиц (молекул и атомов).
Частицы находятся в непрерывном хаотическом движении.
Частицы взаимодействуют друг с другом: на расстояниях, сравнимых с размерами молекул, преобладают силы отталкивания, на более дальних – силы притяжения. Эти силы взаимодействия имеют электромагнитную природу.
Слайд 6Строение вещества
Современные приборы позволяют наблюдать изображения отдельных атомов и молекул. С помощью
Строение вещества
Современные приборы позволяют наблюдать изображения отдельных атомов и молекул. С помощью

Диаметр любого атома имеет порядок d = 10-8 см (10-10 м). Размеры молекул больше размеров атомов. Поскольку молекулы состоят из нескольких атомов, то чем больше количество атомов в молекуле, тем больше её размер. Размеры молекул лежат в пределах от 10-8 см (10-10 м) до 10-5 см (10-7 м).
Основоположником идеи дискретного строения вещества (т.е. состоящего из отдельных частиц) считается древнегреческий философ Демокрит, живший около 470 года до новой эры. Демокрит считал, что все тела состоят из бесчисленного количества сверхмалых, невидимых глазу, неделимых частиц. «Они бесконечно разнообразны, имеют впадины и выпуклости, которыми сцепляются, образуя все материальные тела, а в природе существуют только атомы и пустота»
Слайд 7Логика рассуждений Демокрита, если перевести ее на современный язык, была крайне проста.
Логика рассуждений Демокрита, если перевести ее на современный язык, была крайне проста.

Представим, говорил он, что у нас есть самый острый в мире нож. Берем первый попавшийся под руку материальный объект и разрезаем его пополам, затем одну из получившихся половинок также разрезаем пополам, затем разрезаем пополам одну из получившихся четвертинок и так далее. Рано или поздно, утверждал он, мы получим частицу столь мелкую, что дальнейшему делению на две она не поддается. Это и будет неделимый атом материи.
Демокрит без видимой причины часто разражался смехом, настолько смешными казались ему людские дела на фоне великого мирового порядка (отсюда его прозвище «Смеющийся Философ»). Сограждане сочли Демокрита умалишенным, и даже пригласили для его освидетельствования знаменитого врача Гиппократа. Тот действительно встретился с философом, но постановил, что Демокрит абсолютно здоров как физически, так и психически, и помимо этого утвердил, что Демокрит один из умнейших людей, с которыми ему приходилось общаться.
Слайд 8Хаотическое движение частиц
Непрерывное хаотическое движение частиц подтверждается броуновским движением и диффузией. Хаотичность
Хаотическое движение частиц
Непрерывное хаотическое движение частиц подтверждается броуновским движением и диффузией. Хаотичность

Диффузия (от латинского diffusion – растекание, распространение) – явление, когда в результате теплового движения вещества происходит самопроизвольное проникновение одного вещества в другое (если эти вещества соприкасаются).
Взаимное перемешивание веществ происходит по причине непрерывного и беспорядочного движения атомов или молекул (или других частиц) вещества. С течением времени глубина проникновения молекул одного вещества в другое увеличивается. Глубина проникновения зависит от температуры: чем выше температура, тем больше скорость движения частиц вещества и тем быстрее протекает диффузия.
Диффузия наблюдается во всех состояниях вещества – в газах, жидкостях и твёрдых телах. Примером диффузии в газах служит распространение запахов в воздухе при отсутствии прямого перемешивания. Диффузия в твёрдых телах обеспечивает соединение металлов при сварке, пайке, хромировании и т.п. В газах и жидкостях диффузия происходит намного быстрее, чем в твёрдых телах.
Слайд 9Броуновское движение (или брауновское движение) –
это непрерывное хаотическое движение малых частиц,
Броуновское движение (или брауновское движение) –
это непрерывное хаотическое движение малых частиц,

взвешенных в жидкости или газе (при этом
подразумевается, что сила тяжести не влияет
на их движение).
Это явление впервые наблюдал Роберт Броун (Браун, годы жизни 1773 – 1858), когда рассматривал в микроскоп движение цветочной пыльцы, взвешенной в воде. В наше время для таких наблюдений используют маленькие части краски гуммигут, которая не растворяется в воде. В газе броуновское движение совершают, например, взвешенные в воздухе частицы пыли или дыма.
Наблюдения показывают, что броуновское движение никогда не прекращается. В капле воды (если не давать ей высохнуть) движение крупинок можно наблюдать в течение многих дней, месяцев, лет. Оно не прекращается ни летом, ни зимой, ни днем, ни ночью.
Слайд 10Роберт Броун родился 21 декабря 1773 года в Монтрозе в Шотландии, учился
Роберт Броун родился 21 декабря 1773 года в Монтрозе в Шотландии, учился

В 1805 году Броун возвратился в Англию, привезя с собой около 4 000 видов австралийских растений, множество птиц и минералов; он потратил несколько лет на разработку этого богатого материала, какого ещё никто никогда не привозил из дальних стран.
Явление броуновского движения было им открыто в 1827 году, когда он проводил исследования пыльцы растений.
В 1905 году Альбертом Эйнштейном была создана молекулярно-кинетическая теория для количественного описания броуновского движения.
Слайд 11Взаимодействие частиц
Существование устойчивых жидких и твёрдых тел объясняется наличием сил межмолекулярного взаимодействия
Взаимодействие частиц
Существование устойчивых жидких и твёрдых тел объясняется наличием сил межмолекулярного взаимодействия

Проделаем опыт. Возьмем два свинцовых цилиндрика. Ножом или лезвием зачистим их торцы до блеска и плотно прижмем друг к другу. Мы обнаружим, что цилиндрики "сцепятся". Сила их сцепления настолько велика, что при удачном проведении опыта цилиндрики выдерживают тяжесть гири в 10 кг.
Из опыта следует вывод: частицы веществ способны притягиваться друг к другу. Однако это притяжение возникает лишь тогда, когда поверхности тел очень гладкие (для этого и понадобилась зачистка лезвием) и, кроме того, плотно прижаты друг к другу.
Слайд 12Частицы веществ способны отталкиваться друг от друга. Это подтверждается тем, что жидкие,
Частицы веществ способны отталкиваться друг от друга. Это подтверждается тем, что жидкие,

Притяжение или отталкивание частиц веществ возникает лишь в том случае, если они находятся в непосредственной близости. На расстояниях, чуть больших размеров самих частиц, они притягиваются. На расстояниях, меньших размеров частиц, они отталкиваются. Если же поверхности тел удалены на расстояние, заметно большее, чем размер частиц, то взаимодействие между ними не проявляется никак. Например, нельзя заметить никакого притяжения между свинцовыми цилиндриками, если их сначала не сжать, то есть не сблизить их частицы.
Силы межмолекулярного взаимодействия имеют электромагнитную природу – это силы электрического происхождения. Причиной этого является то, что молекулы и атомы состоят из заряженных частиц с противоположными знаками зарядов – электронов и положительно заряженных атомных ядер. В целом молекулы электрически нейтральны.
Слайд 13Сила взаимодействия между молекулами имеет определённую зависимость от расстояния между молекулами. Эта
Сила взаимодействия между молекулами имеет определённую зависимость от расстояния между молекулами. Эта
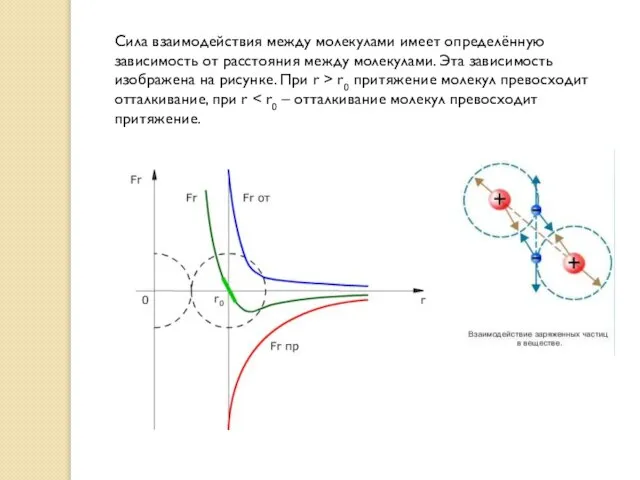
Слайд 14Зависимость сил взаимодействия молекул от расстояния между ними качественно объясняет молекулярный механизм
Зависимость сил взаимодействия молекул от расстояния между ними качественно объясняет молекулярный механизм

При растяжении твёрдого тела частицы удаляются друг от друга на расстояния, превышающие r0. При этом появляются силы притяжения молекул, которые возвращают частицы в первоначальное положение.
При сжатии твёрдого тела частицы сближаются на расстояния, меньшие расстояния r0. Это приводит к увеличению сил отталкивания, которые возвращают частицы в первоначальное положение и препятствуют дальнейшему сжатию.
Если смещение молекул из положений равновесия мало, то силы взаимодействия растут линейно с увеличением смещения. На графике этот отрезок показан утолщённой линией светло-зелёного цвета.
Поэтому при малых деформациях (в миллионы раз превышающих размер молекул) выполняется закон Гука, согласно которому сила упругости пропорциональна деформации. При больших смещениях закон Гука не действует.
Слайд 15Масса и размеры молекул. Количество вещества
Массы атомов и молекул малы и составляют
Масса и размеры молекул. Количество вещества
Массы атомов и молекул малы и составляют

Масса, равная 1/12 массы атома 12С, называется атомной единицей массы (а.е.м.).
1 а.е.м. = 1,660 * 10-27 кг
Относительной атомной массой элемента называется отношение массы атома этого элемента к атомной единице массы. Относительной молекулярной массой называется отношение массы молекулы к атомной единице массы. Относительная молекулярная масса вещества может быть вычислена путём сложения относительных атомных масс элементов, входящих в состав молекулы вещества. Относительная атомная масса химических элементов указана в периодической системе химических элементов Д.И. Менделеева.
Слайд 16Многие опыты показывают, что размер молекулы очень мал. Линейный размер молекулы или
Многие опыты показывают, что размер молекулы очень мал. Линейный размер молекулы или

Используя достижения современной экспериментальной техники, удалось определить линейные размеры простых атомов и молекул, которые составляют около 10-10 м. Линейные размеры сложных атомов и молекул намного больше. Например, размер молекулы белка составляет 43*10-10 м.
Размер молекулы настолько мал, что представить его можно только с помощью сравнений. Например, молекула воды во столько раз меньше крупного яблока, во сколько раз яблоко меньше земного шара.
Слайд 17В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса, которая,
В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса, которая,

Количество вещества принято считать пропорциональным числу частиц. Количество вещества ν – это физическая величина, характеризующая число молекул и атомов в теле.
Единица количества вещества называется молем (моль).
Моль есть количество вещества, которое содержит столько же частиц (атомов, молекул, ионов), сколько атомов содержится в 12 граммах углерода. Сколько же частиц содержится в 12 граммах углерода?
Приблизительно 602 000 000 000 000 000 000 000!
Слайд 18Это огромное число называется числом Авогадро .
То есть числом Авогадро называется число
Это огромное число называется числом Авогадро .
То есть числом Авогадро называется число

Число или постоянная Авогадро – это количество молекул или атомов в 1 моле вещества. Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856).
На заре развития атомной теории (1811) А. Авогадро выдвинул гипотезу, согласно которой при одинаковых температуре и давлении в равных объёмах идеальных газов содержится одинаковое число молекул. Позже было показано, что эта гипотеза есть необходимое следствие кинетической теории, и сейчас она известна как закон Авогадро. Его можно сформулировать так: один моль любого газа при одинаковых температуре и давлении занимает один и тот же объем, при нормальных условиях равный 22,4 л. Эта величина известна как молярный объем газа.
Слайд 19Итак, количество вещества ν равно отношению числа молекул в данном теле к
Итак, количество вещества ν равно отношению числа молекул в данном теле к

Молярная масса – это масса вещества, взятого в количестве одного моля: μ = m0 * NA где m0 – масса молекулы.
Молярная масса выражается в кг/моль = кг*моль-1.
Масса любого количества вещества m равна произведению массы одной молекулы m0 на количество молекул: m = m0N = m0NAν = μν
Слайд 20Количество вещества равно отношению массы вещества к его молярной массе:
ν =
Количество вещества равно отношению массы вещества к его молярной массе: ν =

Задание.
Определите массу одной молекулы воды.
Решение.
1. Находим молекулярную массу воды: 16*1+1*2=18 2. Молярная масса = 18 г/моль 3. Масса 1 моля воды = 18 г 4. В 1 моле вещества содержится число Авогадро молекул 6,022*10 в 23 степени. 5. Чтобы найти массу одной молекулы, надо молярную массу разделить на число Авогадро, приблизительно будет 2,99*10 в минус 23 степени грамма.
Слайд 21Агрегатные состояния вещества
Молекулярно-кинетическая теория даёт объяснение тому, что все вещества могут
Агрегатные состояния вещества
Молекулярно-кинетическая теория даёт объяснение тому, что все вещества могут

Агрегатные состояния вещества (от латинского aggrego – присоединяю, связываю) – состояния одного и того же вещества, переходы между которыми сопровождаются изменением его физических свойств. В этом и заключается изменение агрегатных состояний вещества.
Во всех трёх состояниях молекулы одного и того же вещества ничем не отличаются друг от друга, меняется только их расположение, характер теплового движения и силы межмолекулярного взаимодействия.
Изменение агрегатного состояния может сопровождаться скачкообразным изменением свободной энергии, энтропии, плотности и других основных физических свойств
Слайд 22Движение молекул в газах
В газах обычно расстояние между молекулами и атомами значительно
Движение молекул в газах
В газах обычно расстояние между молекулами и атомами значительно

Движение молекул в разных агрегатных состояниях вещества
Слайд 23Движение молекул в жидкостях
В жидкостях молекулы не только колеблются около положения равновесия,
Движение молекул в жидкостях
В жидкостях молекулы не только колеблются около положения равновесия,

Время оседлой жизни уменьшается с повышением температуры. Расстояние между молекулами жидкости меньше размеров молекул, частицы расположены близко друг к другу, а межмолекулярное притяжение велико. Тем не менее, расположение молекул жидкости не является строго упорядоченным по всему объёму.
Жидкости, как и твёрдые тела, сохраняют свой объём, но не имеют собственной формы. Поэтому они принимают форму сосуда, в котором находятся. Жидкость обладает таким свойством, как текучесть. Благодаря этому свойству жидкость не сопротивляется изменению формы, мало сжимается, а её физические свойства одинаковы по всем направлениям внутри жидкости (изотропия жидкостей). Впервые характер молекулярного движения в жидкостях установил советский физик Яков Ильич Френкель (1894 – 1952).
Слайд 24Движение молекул в твёрдых телах
Молекулы и атомы твёрдого тела расположены в определённом
Движение молекул в твёрдых телах
Молекулы и атомы твёрдого тела расположены в определённом

Термодинамическое (тепловое) равновесие
Термодинамическое равновесие — состояние системы, при котором остаются неизменными по времени макроскопические параметры этой системы (температура, давление, объём, энтропия и др.- в общем, эти величины не являются постоянными, они лишь флуктуируют (колеблются) возле своих средних значений).
Любая термодинамическая система в условиях изолированности от внешней среды самопроизвольно переходит в состояние термодинамического равновесия. В состоянии термодинамического равновесия не происходит теплообмен с окружающими телами, не изменяются объём и давление тела, отсутствуют взаимные превращения жидкостей, газов и твёрдых тел.
Слайд 25Температура и её физический смысл
Существование состояния термодинамического равновесия называют первым исходным положением
Температура и её физический смысл
Существование состояния термодинамического равновесия называют первым исходным положением

Таким образом, температура тела – это физический параметр, одинаковый во всех частях системы тел, которая находится в состоянии термодинамического равновесия.
«... мерилом температуры является не само движение, а хаотичность этого движения. Хаотичность состояния тела определяет его температурное состояние, и эта идея (которая впервые была разработана Больцманом), что определённое температурное состояние тела вовсе не определяется энергией движения, но хаотичностью этого движения, и является тем новым понятием в описании температурных явлений, которым мы должны пользоваться »
П. Л. Капица
Слайд 26В равновесном состоянии температура имеет одинаковое значение для всех макроскопических частей системы.
В равновесном состоянии температура имеет одинаковое значение для всех макроскопических частей системы.

Если в системе два тела имеют одинаковую температуру, то между ними не происходит передачи кинетической энергии частиц (тепла). Если же существует разница температур, то тепло переходит от тела с более высокой температурой к телу с более низкой.
Температура связана также с субъективными ощущениями «тепла» и «холода», связанными с тем, отдаёт ли живая ткань тепло или получает его.
Свойства температуры изучает раздел физики — термодинамика. Температура также играет важную роль во многих областях науки, включая другие разделы физики, а также химию и биологию.
Слайд 27Чтобы измерить температуру какого-либо тела, его необходимо привести в тепловой контакт с
Чтобы измерить температуру какого-либо тела, его необходимо привести в тепловой контакт с

Средства измерения температуры часто проградуированы по относительным шкалам — Цельсия или Фаренгейта.
На практике для измерения температуры также используют
жидкостные и механические термометры,
термопару,
термометр сопротивления,
газовый термометр,
пирометр.
Самым точным практическим термометром является платиновый термометр сопротивления
Слайд 28Единицы и шкалы измерения температуры
Из того, что температура — это мера кинетической энергии
Единицы и шкалы измерения температуры
Из того, что температура — это мера кинетической энергии

Абсолютная температура. Шкала температур Кельвина
Понятие абсолютной температуры было введено У. Томсоном (Кельвином), в связи с чем шкалу абсолютной температуры называют шкалой Кельвина или термодинамической температурной шкалой. Единица абсолютной температуры — кельвин (К).
Абсолютная шкала температуры называется так, потому что мера основного состояния нижнего предела температуры — абсолютный ноль, то есть наиболее низкая возможная температура, при которой в принципе невозможно извлечь из вещества тепловую энергию.
Абсолютный ноль определён как 0 K, что равно −273.15 °C.
Шкала температур Кельвина — это шкала, в которой начало отсчёта ведётся от абсолютного нуля.
Слайд 29Уи́льям То́мсон, лорд Ке́львин, род. 26 июня 1824 года в Белфасте, Ирландия;
Уи́льям То́мсон, лорд Ке́львин, род. 26 июня 1824 года в Белфасте, Ирландия;

В 1846 году двадцатидвухлетний Томсон занял кафедру теоретической физики в университете в Глазго. Необыкновенные заслуги Томсона в чистой и прикладной науке были вполне оценены его современниками.
В 1866 году Томсон возведён в дворянское достоинство, в 1892 году королева Виктория пожаловала ему пэрство с титулом «барон Кельвин».
Слайд 30Шкала Цельсия
В технике, медицине, метеорологии и в быту используется шкала Цельсия, в
Шкала Цельсия
В технике, медицине, метеорологии и в быту используется шкала Цельсия, в

В настоящее время шкалу Цельсия определяют через шкалу Кельвина: цена одного деления в шкале Цельсия равна цене деления шкалы Кельвина, t(°С) = Т(К) — 273,15.
Шкала Цельсия практически очень удобна, поскольку вода очень распространена на нашей планете и на ней основана наша жизнь. Ноль Цельсия — особая точка для метеорологии, поскольку связана с замерзанием атмосферной воды. Шкала предложена Андерсом Цельсием -профессором астрономии Упсальского университета (1730—1744) - в 1742 г.
Слайд 31Шкала Фаренгейта
В Англии и, в особенности, в США используется шкала Фаренгейта. Ноль
Шкала Фаренгейта
В Англии и, в особенности, в США используется шкала Фаренгейта. Ноль

В настоящее время принято следующее определение шкалы Фаренгейта: это температурная шкала, 1 градус которой (1 °F) равен 1/180 разности температур кипения воды и таяния льда при атмосферном давлении, а точка таяния льда имеет температуру +32 °F. Температура по шкале Фаренгейта связана с температурой по шкале Цельсия (t °С) соотношением t °С = 5/9 (t °F — 32), t °F = 9/5 t °С + 32. Предложена Г. Фаренгейтом в 1724 году.
Шкала Реомюра
Основная статья: Градус Реомюра
Предложена в 1730 году Р. А. Реомюром, который описал изобретённый им спиртовой термометр.
Единица — градус Реомюра (°Ré), 1 °Ré равен 1/80 части температурного интервала между опорными точками — температурой таяния льда (0 °Ré) и кипения воды (80 °Ré)
1 °Ré = 1,25 °C.
В настоящее время шкала вышла из употребления, дольше всего она сохранялась во Франции, на родине автора.
Слайд 32Энергия теплового движения при абсолютном нуле
Когда материя охлаждается, многие формы тепловой энергии
Энергия теплового движения при абсолютном нуле
Когда материя охлаждается, многие формы тепловой энергии

«… современное понятие абсолютного нуля не есть понятие абсолютного покоя, наоборот, при абсолютном нуле может быть движение — и оно есть, но это есть состояние полного порядка …» П. Л. Капица
Газ превращается в жидкость и затем кристаллизуется в твёрдое тело (гелий и при абсолютном нуле остаётся в жидком состоянии при атмосферном давлении). Движение атомов и молекул замедляется, их кинетическая энергия уменьшается. Но даже при абсолютном нуле электроны проводимости движутся между атомами со скоростью порядка 106 м/с.
Температура, при которой частицы вещества имеют минимальное количество движения, сохраняющееся только благодаря квантовомеханическому движению, — это температура абсолютного нуля (Т = 0К). Температуры абсолютного нуля достичь невозможно.
Слайд 33Интересные факты
Самая низкая температура на Земле до 1910 г.: −68 °С,
Интересные факты
Самая низкая температура на Земле до 1910 г.: −68 °С,

Поверхность Солнца имеет температуры около 6000 K.
Самая низкая температура, созданная человеком, была получена в 1995 году Эриком Корнеллом и Карлом Виманом из США при охлаждении атомов рубидия. Она была выше абсолютного нуля менее чем на 1/170 млрд долю K (5,9·10−12 K).
Рекордная низкая температура на поверхности земли −89.2° С была зарегистрирована на советской внутриконтинентальной научной станции Восток, Антарктида (высота 3488 м над уровнем моря) 21 июля 1983 года.
Рекордно высокая температура на поверхности земли + 56,7 ˚C была зарегистрирована 10 июля 1913 года на ранчо Гринленд в долине Смерти (штат Калифорния, США).
 Методы и формы работы в программе дополнительного образования
Методы и формы работы в программе дополнительного образования Синдром одержимости
Синдром одержимости Лек 3 харак кулин продукции
Лек 3 харак кулин продукции Символизм и модерн как стилистические направления начала XX века
Символизм и модерн как стилистические направления начала XX века Бухгалтерская (финансовая) отчетность. Отчет об изменениях капитала. Лекция 5
Бухгалтерская (финансовая) отчетность. Отчет об изменениях капитала. Лекция 5 Поддержка стандарта OpenGIS в СУБД ЛИНТЕР
Поддержка стандарта OpenGIS в СУБД ЛИНТЕР № 1 Введение в дисциплину
№ 1 Введение в дисциплину Как сохранить здоровье ребенка? 7 класс
Как сохранить здоровье ребенка? 7 класс Warp Knitted Safety Jacket Fabric
Warp Knitted Safety Jacket Fabric Родительское собраниепо теме"Школа-дом-одна семья"
Родительское собраниепо теме"Школа-дом-одна семья" ТЕМА: ОБОРУДОВАНИЕ ДЛЯ ПРИЕМКИ ПРОДУКЦИИ
ТЕМА: ОБОРУДОВАНИЕ ДЛЯ ПРИЕМКИ ПРОДУКЦИИ Ledeco – профессиональный партнер в сфере реализации инженерно-строительных проектов
Ledeco – профессиональный партнер в сфере реализации инженерно-строительных проектов Тест по экономике
Тест по экономике МОУ Лицей №74
МОУ Лицей №74 Разработка модели управления Разработка модели управленияпроцессом полоролевого воспитания детей дошкольного и младшего шк
Разработка модели управления Разработка модели управленияпроцессом полоролевого воспитания детей дошкольного и младшего шк Проверочная работа по теме: «Функциональное устройство компьютера» (Запишите на листочках свои имя и фамилию,номер варианта и за
Проверочная работа по теме: «Функциональное устройство компьютера» (Запишите на листочках свои имя и фамилию,номер варианта и за Итоги проведения конкурсных процедур и приемки государственных контрактов, выполненных в рамках ФЦПРО на 2011-2015 годы в 2011 году
Итоги проведения конкурсных процедур и приемки государственных контрактов, выполненных в рамках ФЦПРО на 2011-2015 годы в 2011 году Способы разделения смесей
Способы разделения смесей Характерные черты информационного общества
Характерные черты информационного общества Школьная профилактически - образовательная программа «УРОКИ ЗДОРОВЬЯ»
Школьная профилактически - образовательная программа «УРОКИ ЗДОРОВЬЯ» Инклюзивное образование
Инклюзивное образование ВНИМАНИЕ!!!
ВНИМАНИЕ!!! Повторение изученного по фонетике и орфоэпии
Повторение изученного по фонетике и орфоэпии OKD_chistaya_linia
OKD_chistaya_linia Культура через призму психоанализа: Фрейд, Юнг, Фромм
Культура через призму психоанализа: Фрейд, Юнг, Фромм Поручение Президента РФ
Поручение Президента РФ Презентация на тему Money деньги
Презентация на тему Money деньги  Украинцы в Красноярском крае
Украинцы в Красноярском крае