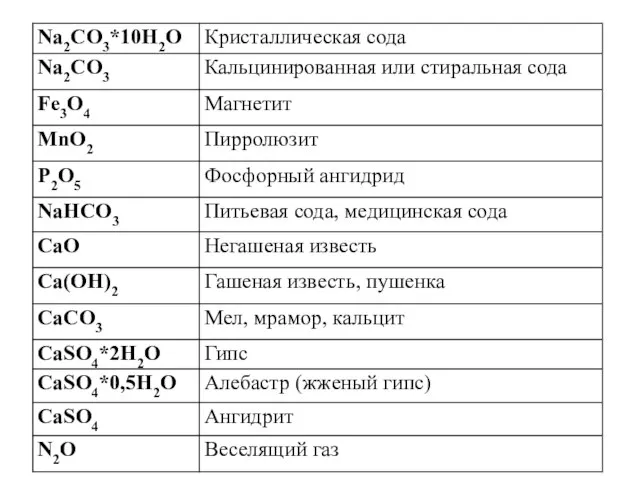
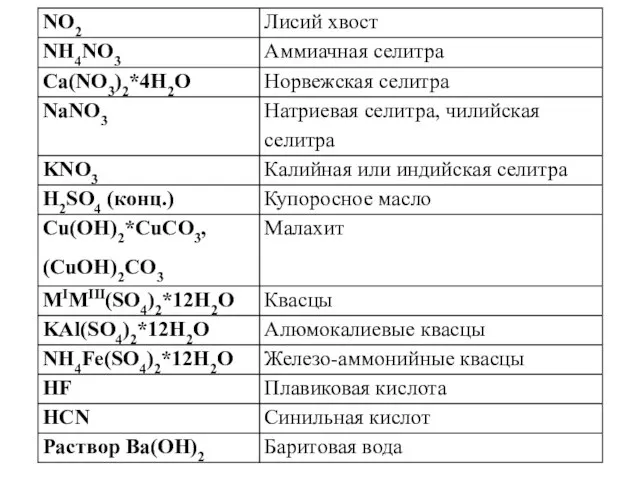
на 9,65%. Определите процентный состав полученной твердой смеси.
РЕШЕНИЕ
Запишем уравнения химической реакции:
СаO + H2O = Са(OH)2
На основании анализа условия задачи можно сделать два вывода:
1. конечная смесь является твердым веществом и состоит из оксида и гидроксида кальция;
2. вода прореагировала полностью и прирост массы реакционной смеси на 9,65% равен массе прореагировавшей воды.
В последнее время большинстве школ при решении задач используют понятие количества вещества, а в некоторых - расчет проводят через массы. Учащиеся должны владеть и тем и другим методом решения.









 Индивидуальные особенности младшего дошкольного и старшего дошкольного возраста
Индивидуальные особенности младшего дошкольного и старшего дошкольного возраста Энциклопедия слова - земляника
Энциклопедия слова - земляника ООО «Аквасток-монтаж»
ООО «Аквасток-монтаж» 3aff641d30b4094e
3aff641d30b4094e Презентація (2)
Презентація (2) Цель: Научиться варить мыло в домашних условиях Задачи:1. Познакомиться с историей возникновения мыла. 2.Узнать технологию его изго
Цель: Научиться варить мыло в домашних условиях Задачи:1. Познакомиться с историей возникновения мыла. 2.Узнать технологию его изго Бакалавриат заочное отделение. Направления и профили подготовки
Бакалавриат заочное отделение. Направления и профили подготовки Презентация на тему Координатный луч (5 класс)
Презентация на тему Координатный луч (5 класс) Кабинет 510, тел 660-480
Кабинет 510, тел 660-480 Моббинг
Моббинг Лобачевский и его геометрия
Лобачевский и его геометрия Методические рекомендации по созданию мини-проектов в Microsoft PowerPoint
Методические рекомендации по созданию мини-проектов в Microsoft PowerPoint Восьмеричная система счисления
Восьмеричная система счисления История государственного флага РФ
История государственного флага РФ Технологии социального партнерства в деятельности образовательного учреждения
Технологии социального партнерства в деятельности образовательного учреждения Презентация на тему Права и свободы по Конституции РФ
Презентация на тему Права и свободы по Конституции РФ Нефте - и - водонасыщенность коллекторов
Нефте - и - водонасыщенность коллекторов Presentation Title
Presentation Title  PRESENT SIMPLE TENSE Настоящее простое время
PRESENT SIMPLE TENSE Настоящее простое время  Основные правила и принципы гражданского процесса
Основные правила и принципы гражданского процесса Теория речевой деятельности. Письмо как вид РД
Теория речевой деятельности. Письмо как вид РД Сергий Радонежский: идеальный образ русского святого(по агиографической повести Епифания Премудрого «Житие преподобного от
Сергий Радонежский: идеальный образ русского святого(по агиографической повести Епифания Премудрого «Житие преподобного от Китай
Китай Образовательный стандарт. История возникновения и развития в РФ
Образовательный стандарт. История возникновения и развития в РФ Стандарты оказания услуг салона красоты Beauty house
Стандарты оказания услуг салона красоты Beauty house АССОЦИАЦИЯ «МЕЖДУНАРОДНЫЙ КОНГРЕСС КАЧЕСТВА ТЕЛЕКОММУНИКАЦИЙ»
АССОЦИАЦИЯ «МЕЖДУНАРОДНЫЙ КОНГРЕСС КАЧЕСТВА ТЕЛЕКОММУНИКАЦИЙ» ОСОБЕННОСТИ РЕКЛАМНОГО РЫНКА «МАЛОГО» ГОРОДА
ОСОБЕННОСТИ РЕКЛАМНОГО РЫНКА «МАЛОГО» ГОРОДА Контур информационной безопасности предприятия
Контур информационной безопасности предприятия