Содержание
- 2. Цели урока Изучить закон объёмных отношений Гей- Люссака. Изучить закон Авогадро и следствия, вытекающие из закона.
- 3. Число атомов и молекул в обычных образцах веществ очень велико. Какую специальную единицу измерения используют при
- 4. Существует физическая величина, прямо пропорциональная числу частиц, составляющих данное вещество и входящих во взятую порцию этого
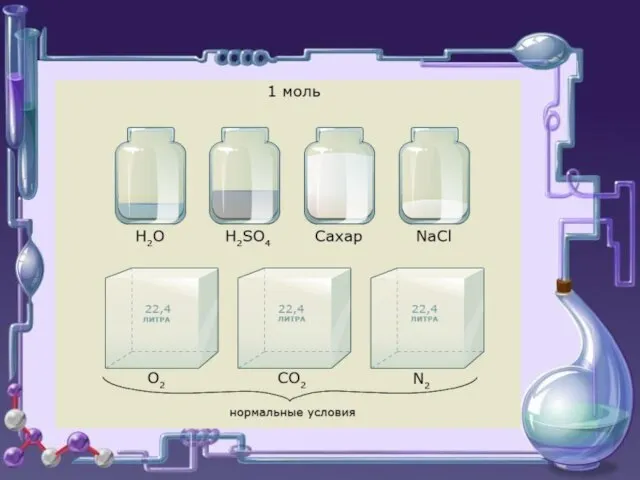
- 5. В системе СИ единицей количества вещества (ν) является МОЛЬ – количество вещества, содержащее столько же частиц
- 6. Установлено 12 г изотопа углерода-12 содержит 6,02·1023 атомов Следовательно: 1 моль – порция вещества, содержащая число
- 7. Молярная масса масса одного моля вещества. М=[г/моль] молярная масса численно равна молекулярной массе , отсюда и
- 8. Что вам известно из курса физики о газообразном состоянии вещества? Газообразные вещества состоят из молекул. Молекулы
- 10. о Измеряя объемы, и объемы газов, полученных в результате реакции. Открыл закон газовых отношений. Ж.Л. Гей-Люссак
- 11. Закон объёмных отношений При постоянных давлении и температуре объёмы вступающих в реакцию газов относятся друг к
- 12. Например
- 13. Закон объёмных отношений позволил итальянскому учёному А. Авогадро предположить, что молекулы простых газов состоят из двух
- 14. о о А. Авогадро 1811 Открытый Гей- Люссаком закон объемных отношений предполагал общее для всех газов.
- 15. о о Закон Авогадро (для газов) В равных объемах различных газов при одинаковых температуре и давлении
- 16. Следствия (для газов) Одно и то же число молекул различных газов при одинаковых условиях занимает одинаковые
- 18. Vm =22,4л/моль Мвозд.=29г/моль NA =6,02*1023 1/моль Константы: М вещества численно равна относительной молекулярной массе.
- 19. Взаимосвязь физических величин D2=M1/M2 M= ρ*Vm V=ν*Vm N= ν*NA m= ρ*V m = ν* М
- 20. Гремучий газ – смесь водорода Н2 и кислорода в соотношении 2:1 по объёму. При поджигании смесь
- 21. Рудничный газ или метан СН4, - настоящее бедствие для шахтёров. Его взрывы в шахтах приводят к
- 22. Запах сернистого газа SO2 знает каждый, кто хоть раз зажигал спичку. Этот газ хорошо растворяется в
- 23. За час взрослый человек выдыхает примерно 40 г углекислого газа. Определите объём (н.у.) данной массы этого
- 24. 4,48 л 560 л 10 г 32 г/моль 17 г/моль Ответы к задачам
- 26. Скачать презентацию





![Молярная масса масса одного моля вещества. М=[г/моль] молярная масса численно равна молекулярной массе , отсюда и](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/373009/slide-6.jpg)
















 Презентация на тему Алгебра и логика высказываний
Презентация на тему Алгебра и логика высказываний Заболевание височно-нижнечелюстного сустава
Заболевание височно-нижнечелюстного сустава  Конфликтный треугольник: семья-ребенок-образовательное учреждение. Детская агрессия
Конфликтный треугольник: семья-ребенок-образовательное учреждение. Детская агрессия кольцово
кольцово Проблемы преемственности начального и основного (общего) образования
Проблемы преемственности начального и основного (общего) образования Проектная деятельность
Проектная деятельность Власть. Структурная и ситуационная власть
Власть. Структурная и ситуационная власть Свечникова В.В. правоведение тема 2 презентация
Свечникова В.В. правоведение тема 2 презентация Майолика. Гутные изделия. Ковка
Майолика. Гутные изделия. Ковка Saint Petersburg state University
Saint Petersburg state University  Форма и размеры Земли
Форма и размеры Земли Поздравление крестной жениха
Поздравление крестной жениха Гендерные аспекты образования и рынка труда
Гендерные аспекты образования и рынка труда Геометрия на службе у архитектуры
Геометрия на службе у архитектуры Психология двигательно-волевой сферы психической деятельности
Психология двигательно-волевой сферы психической деятельности Команда звёздочки
Команда звёздочки История семейного образования в СанктПетербурге
История семейного образования в СанктПетербурге Русский пейзаж в поэзии и живописи
Русский пейзаж в поэзии и живописи Физическая культура в период самоизоляции студентов педагогического вуза
Физическая культура в период самоизоляции студентов педагогического вуза Заповедники России
Заповедники России Презентация на тему Прощание с 1 классом
Презентация на тему Прощание с 1 классом Клёш и фалды
Клёш и фалды Быть нормальным
Быть нормальным Основные формы рельефа Алтайского края
Основные формы рельефа Алтайского края  Проект: Комплексное сопровождение покупки страховой компании
Проект: Комплексное сопровождение покупки страховой компании Сделка. Предпринимательская деятельность
Сделка. Предпринимательская деятельность русский язык - язык международного общения
русский язык - язык международного общения Условия признания и исполнения иностранных судебных решений
Условия признания и исполнения иностранных судебных решений