Слайд 2Проверка домашнего задания
Упражнение №5
Al2 (SO4)3+ KOH(нед) =
Al 2(SO4)3+ KOH(изб.) =

Упражнение №6
Al ? AlCl3 ? Al(OH)2 ? Al2 O3 ? NaAlO2 ? Al 2(SO4)3 ? Al(OH)3 ? AlCl3 ? NaAlO2
Слайд 3Ответы
Упражнения №5
1.Al2 (SO4)3 + 6KOH(нед.) = 2AL(OH)3 +3K2SO4
2. Al2 (SO4)3 + 8KOH(изб)

= 2KAlO2 + 3K2SO4 +
4H2O
Слайд 4Упражнение №6
2Al +3Cl2 = 2AlCl3
AlCl3 + 3NaOH =Al(OH)3 + 3NaCl
2Al(OH)3 = Al2O3

+ 3H2O
Al2O3 +2NaOH =2NaAlO2 + H2O
2NaAlO2 + 4H2SO4(изб.) = Na2SO4 + Al2 (SO4 )3 +4H2O
Al2 (SO4 ) + 6NaOH = 2Al (OH)3 + 3Na2 SO4
Al(OH)3 +3HCl =AlCl3 + 3H2O
AlCl3 + 4NaOH(избыт.)= NaAlO2 + 3NaCl + 2H2O
Слайд 5Изучение нового материала
Характеристика по плану:
1.Положение железа в ПСХЭ (период, ряд, группа, подгруппа,

порядковый номер)
2.Атомное строение(число электронов, протонов , нейтронов, относительная атомная масса)
3.Электронные слои, распределение электронов по слоям, электронная конфигурация.
Слайд 6Характеристика элемента
4-период, 4ряд, 8-группа, побочная подгруппа, порядковый номер 26
26 электронов, 26 протонов,

относительная атомная масса 56, 30 нейтронов.
4 электронных слоя, 2)8)14)2), электронная конфигурация 1s22s2p63s2p6d64s2
Степень окисления 0,+2, +3 ,+4 и иногда + 6; является восстановителем
Слайд 7Физические свойства железа
Серебристо-серый, мягкий металл, обладает хорошей пластичностью, ковкостью и способностью к

намагничиванию.
Плотность 7,864г/см3, температура плавления 1539 * С
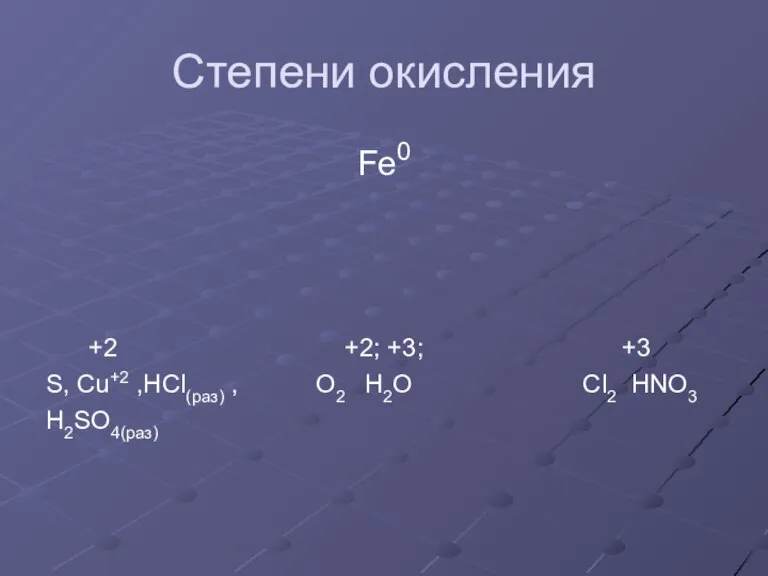
Слайд 8Степени окисления
Fe0
+2 +2; +3; +3
S, Cu+2 ,HCl(раз) , O2 H2O Cl2 HNO3
H2SO4(раз)
Слайд 9Химические свойства
При нагревании
2Fe + 3Cl2 =2FeCl3
3Fe +2O2= Fe3O4 (FeO Fe2O3)
Fe +S =FeS
При

очень высокой температуре
4Fe + 3C =Fe4C3
4Fe + 3Si =Fe4Si3
3Fe + 2P = Fe3P2
Слайд 10Химические свойства
Fe + CuSO4 = Cu + FeSO4
Fe + 2HClр =

FeCl2 + H2
Fe + H2SO4 p= FeSO4 + H2
Fe + H2SO4(k) =/=
Fe + HNO3 (к)=/=
Слайд 11При нагревании
2Fe + 6H2SO4(k)=Fe2(SO4)3 + 3SO2+6H2O
Fe+ 6HNO3(k)= Fe(NO3)3+ 3NO2+ 3H2O

Слайд 12
Химические свойства
Fe0 + HNO3 (p) = Fe +2(NO3 )2 + N20 +

H2 O
Fe0 + HNO3(р) = Fe+3 (NO3)3 + N+2 O + H20
Fe0 + HNO3(р) = Fe+2(NO3)2 + N-3 H4 N+5 O3+ H2O
Слайд 13Уравнивание реакций
5Fe0 + 12 HN+5 O3 (p) = 5Fe +3(NO3 )2 +

N20 +6 H2 O
вос-ль окис-ль
Fe0 - 2e = Fe+2 10 1
2N+5 + 10e = N20 2 5
Fe0 +4 HN+5 O3 = Fe+3 (NO3)3 + N+2 O + 2H20
Fe0 - 3e = Fe+3 3 1
N+5 + 3e = N+2 3 1
Fe0 – восстановитель
HNO3 – окислитель
4Fe0 +10 HNO3 =4 Fe+2(NO3)2 + N-3 H4 N+5 O3+ 3H2O
вос-ль окис-ль
Fe0 - 2e = Fe+2 8 4
N+5 + 8e = N-3 2 1
Слайд 14Минералы железо
Fe3O4 магнитный железняк или магнетит
Fe2O3 красный железняк или гематит
2Fe2O3.3H2O бурый

железняк или лимонит
FeS2 железный или серный колчедан
FeSO4.7H2O железный купорос
Слайд 15Применение
Магнитный, красный, бурый железняки –для производства черной металлургии (чугуна и стали)
Железный колчедан

– для производства серной кислоты
Железный купорос– для борьбы с вредителями растений, для приготовления минеральных красок, для обработки древесины
Соединение железа издавна применяют для лечения малокровия, при истощении, упадке сил.
Чугун и сталь в технике и в быту.
Хлорид железа(lll)– при очистке воды, в качестве протравы при крашении тканей.
Сульфат железа(lll) при очистке воды, в качестве растворителя в гидрометаллургии .
Слайд 16Источники железа
Шпинат
Салат
Капуста
Черная черешня
Говядина
Телятина
















 Структура холдинга
Структура холдинга Imagine – John Lennon
Imagine – John Lennon  Цели расследовательской деятельности журналиста
Цели расследовательской деятельности журналиста Синергетична концепція інноваційного розвитку інформаційного права
Синергетична концепція інноваційного розвитку інформаційного права Результаты исследования «SEO-альманах» ТопЭксперт.РФ
Результаты исследования «SEO-альманах» ТопЭксперт.РФ Профессиональная компетентность педагога
Профессиональная компетентность педагога Нормативно-правовые основы образования
Нормативно-правовые основы образования Задачи и объекты SWOT-анализа
Задачи и объекты SWOT-анализа Оформление и ведение учета операции с неплатежеспособными денежными знаками
Оформление и ведение учета операции с неплатежеспособными денежными знаками кибер-готы
кибер-готы Как увеличить вашу прибыль и расширить круг клиентов
Как увеличить вашу прибыль и расширить круг клиентов СOBIT® и ITIL®
СOBIT® и ITIL® Молодежный театр Эксперимент
Молодежный театр Эксперимент Компания «Винтер»
Компания «Винтер» Транспорт будущего
Транспорт будущего Анализ результатов Глобального опроса взрослого населения о потреблении табака в Российской Федерации и рекомендации для дальне
Анализ результатов Глобального опроса взрослого населения о потреблении табака в Российской Федерации и рекомендации для дальне himiki_i_ih_zaslugi
himiki_i_ih_zaslugi Кейс – технологии в учебном процессе
Кейс – технологии в учебном процессе Maslenitsa
Maslenitsa Ртуть
Ртуть Парные согласные в конце слова
Парные согласные в конце слова 10 вопросов о Солнце
10 вопросов о Солнце Дроби (6 класс)
Дроби (6 класс) Грибы
Грибы Мастер-классы по “Косметике для гурманов” учебного центра Yazykov-Group
Мастер-классы по “Косметике для гурманов” учебного центра Yazykov-Group Фонограф
Фонограф Организационное стимулирование
Организационное стимулирование Презентация на тему Internet-игра по русскому языку «Коротышкины задачи» с использованием web сервиса LearningApps.org
Презентация на тему Internet-игра по русскому языку «Коротышкины задачи» с использованием web сервиса LearningApps.org