Содержание
- 2. Сафиканов А.Ф. 1. История открытия галогенов 2. Положение в Периодической системе 3. Химические свойства 4. Применение
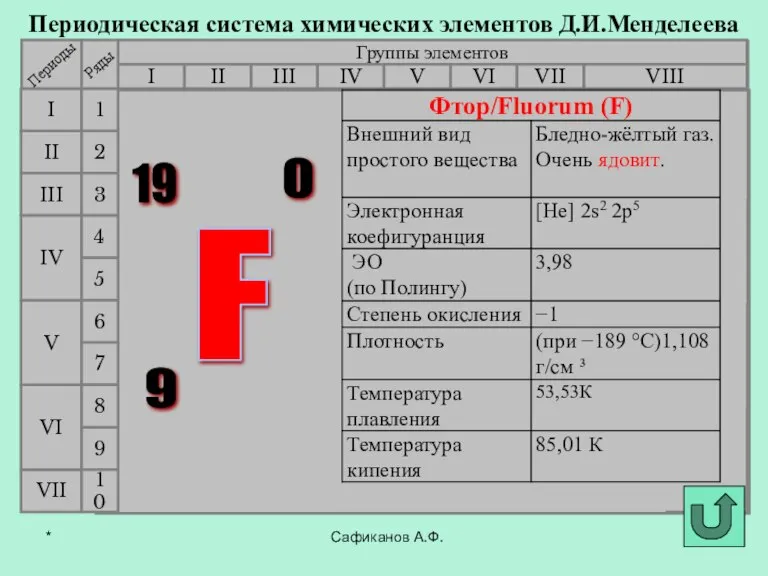
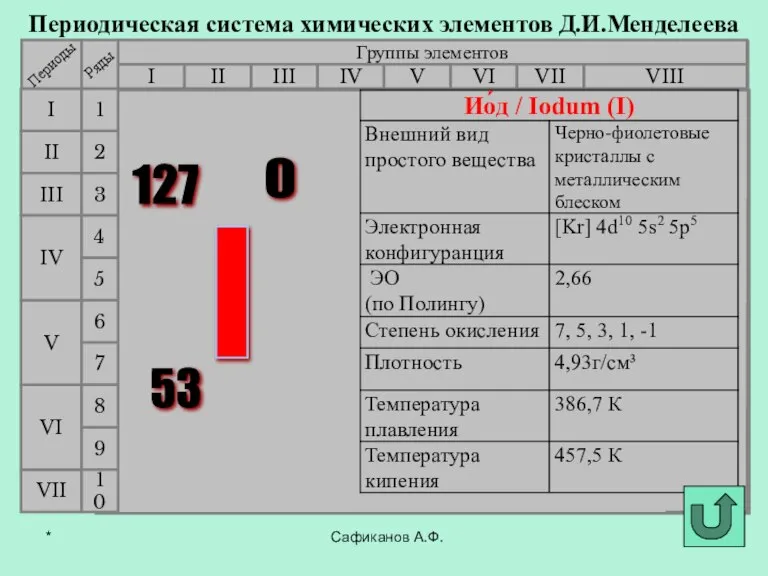
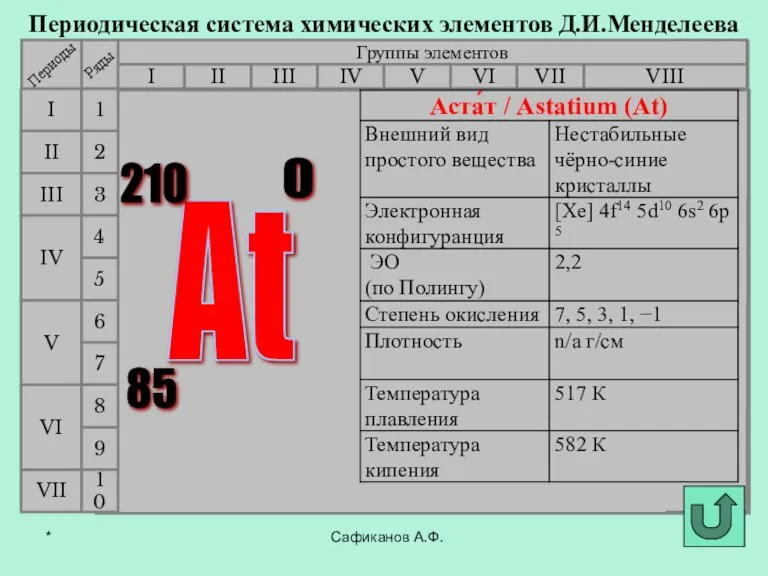
- 3. Фтор История открытия галогенов Сафиканов А.Ф. Хлор Бром Йод Астат *
- 4. В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до температуры –23°C (в
- 5. В 1774 году шведский ученый К. Шееле открыл хлор, который принял за сложное вещество и назвал
- 6. В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость, который он назвал
- 7. В 1811 году французский химик Бернар Куртуа открыл иод путём перегонки маточных растворов от своего азотнокислого
- 8. В 1869 г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем (как «эка-иод»). Впервые астат
- 9. Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI
- 10. Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI
- 11. Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI
- 12. Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI
- 13. Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI
- 14. Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI
- 15. Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут на холоду, при нагревании – даже с
- 16. Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут на холоду, при нагревании – даже с
- 17. Химические свойства Cl2 - сильно реакционноспособен (искл. C, O2, N2 и некот. др.) С простыми веществами:
- 18. Химические свойства Cl2 - сильно реакционноспособен (искл. C, O2, N2 и некот. др.) С простыми веществами:
- 19. Химические свойства Br2 - реакционноспособен С простыми веществами: С металлами С неметаллами Al + Br2 →
- 20. Химические свойства Br2 - реакционноспособен С простыми веществами: С металлами С неметаллами 2Al + 3Br2 →
- 21. Химические свойства I2 - химически наименее активен С простыми веществами: С металлами С неметаллами Hg +
- 22. Химические свойства I2 - химически наименее активен С простыми веществами: С металлами С неметаллами Hg +
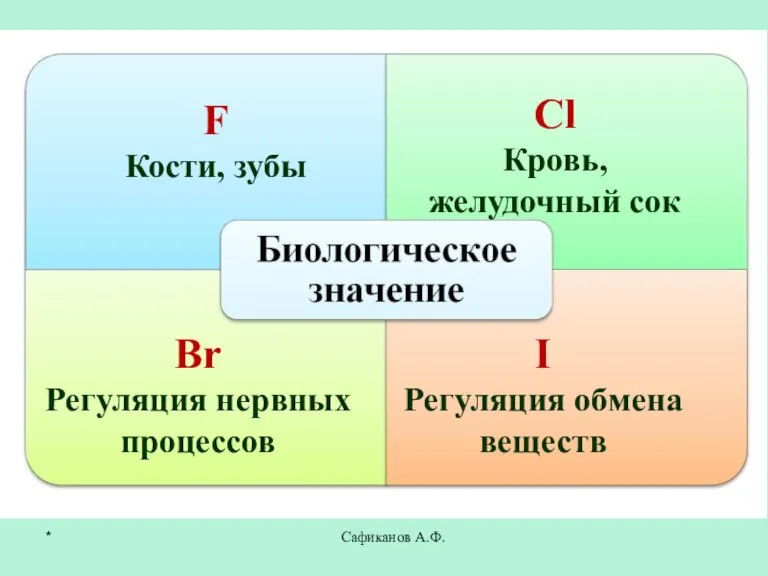
- 23. Сафиканов А.Ф. F Кости, зубы Сl Кровь, желудочный сок Br Регуляция нервных процессов I Регуляция обмена
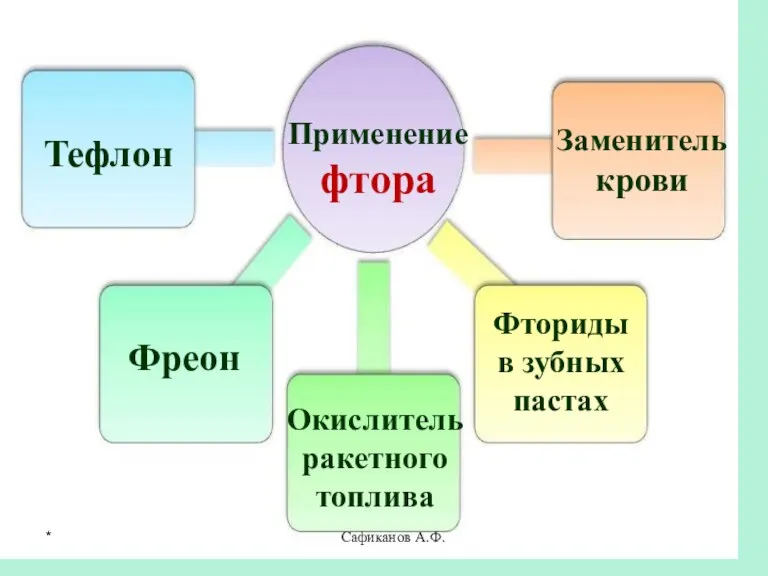
- 24. Сафиканов А.Ф. Применение фтора Тефлон Фреон Окислитель ракетного топлива Заменитель крови Фториды в зубных пастах *
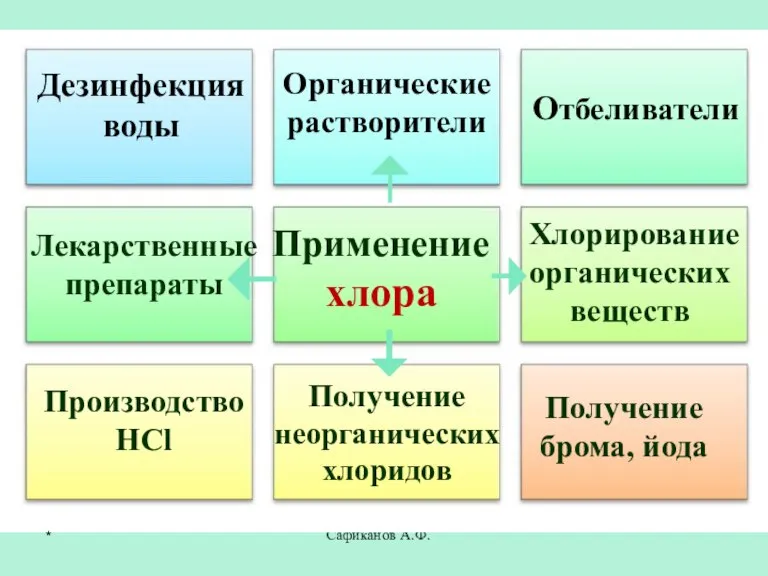
- 25. Сафиканов А.Ф. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты
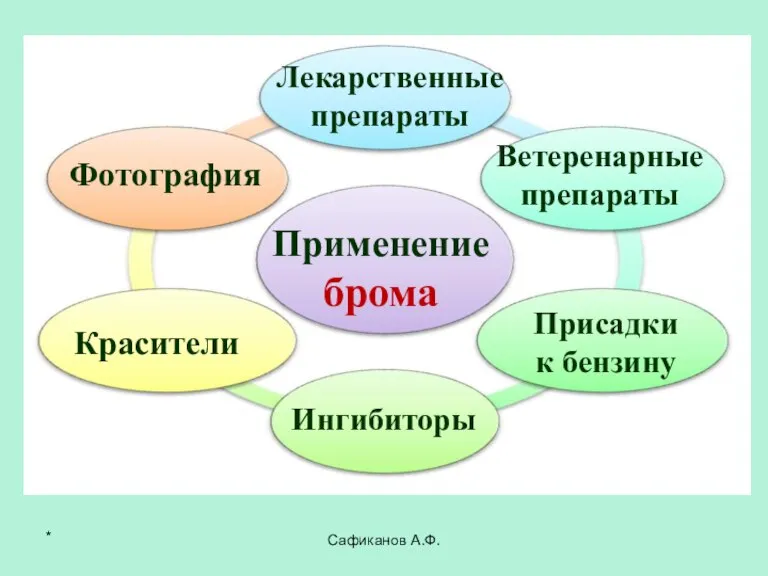
- 26. Сафиканов А.Ф. Применение брома Лекарственные препараты Красители Фотография Ветеренарные препараты Ингибиторы Присадки к бензину *
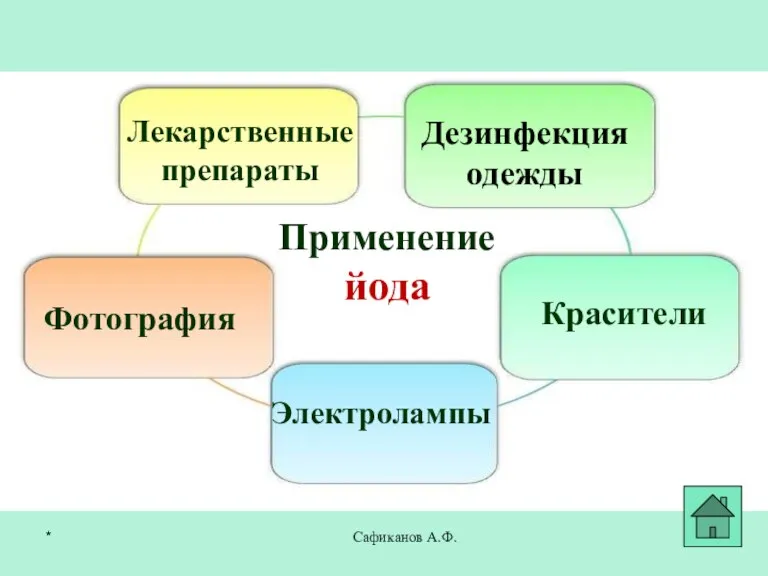
- 27. Сафиканов А.Ф. Применение йода Лекарственные препараты Фотография Красители Дезинфекция одежды Электролампы *
- 28. Физические свойства галогенов Заполни пропуски Фтор - , в воде , так как интенсивно с ней
- 29. Химические свойства галогенов Поставь коэффициенты Сафиканов А.Ф. Na + Cl2 = NaCl S + F2 =
- 30. Химические свойства галогенов Найди соответствие между исходными веществами и продуктами реакций Сафиканов А.Ф. Xe + 2F2
- 31. Сафиканов А.Ф. § 17, упр.5, 8 стр 63. Дополнительно: ссылка на сайт учителя химии Сафиканова А.Ф.
- 32. Сафиканов А.Ф. Спасибо за урок! Благодарю за сотрудничество. *
- 34. Скачать презентацию























 По одёжке встречают
По одёжке встречают Губаха ALIVE. Истории шахтёрского города
Губаха ALIVE. Истории шахтёрского города Подготовка к сочинению-рассуждению на лингвистическую тему (С 2. 1)
Подготовка к сочинению-рассуждению на лингвистическую тему (С 2. 1) Упражнения для тренировки дома
Упражнения для тренировки дома Это непростое стихотворение
Это непростое стихотворение Один день Латышевых
Один день Латышевых Императоры Российской империи
Императоры Российской империи Кюхельбекер
Кюхельбекер Бег как средство укрепления здоровья
Бег как средство укрепления здоровья Алхимики
Алхимики Образовательные форумы Молодежка. ru. Молодежное самоуправление
Образовательные форумы Молодежка. ru. Молодежное самоуправление История паралимпийских игр
История паралимпийских игр Современные космологические концепции
Современные космологические концепции  Инвестиционный проект: сущность, цели, виды
Инвестиционный проект: сущность, цели, виды Componentele unui geam
Componentele unui geam Встроенные видеоредакторы
Встроенные видеоредакторы Диагностика готовности к школьному обучению по методике Л.А. Ясюковой
Диагностика готовности к школьному обучению по методике Л.А. Ясюковой Из чего состоит КОМПЛЕКСНЫЙ ИНТЕРНЕТ_МАРКЕТИНГ _.ppt (1)
Из чего состоит КОМПЛЕКСНЫЙ ИНТЕРНЕТ_МАРКЕТИНГ _.ppt (1) Материнские платы
Материнские платы Командитне підприємство
Командитне підприємство Русская живопись 1-ая пол. 19 век
Русская живопись 1-ая пол. 19 век Совещание заместителей директоров образовательных учреждений по учебно-воспитательной работе
Совещание заместителей директоров образовательных учреждений по учебно-воспитательной работе Сказ Тамбовской Земли
Сказ Тамбовской Земли Призыв на воинскую службу, что необходимо знать
Призыв на воинскую службу, что необходимо знать Культура буддизма
Культура буддизма “Кто постигает новое, лелея старое, тот может быть учителем.” Конфуций
“Кто постигает новое, лелея старое, тот может быть учителем.” Конфуций Основы графической культуры
Основы графической культуры Русские художники –передвижники. В 1870г- молодые художники создали «Товарищество передвижных художественных выставок», во главе
Русские художники –передвижники. В 1870г- молодые художники создали «Товарищество передвижных художественных выставок», во главе