Содержание
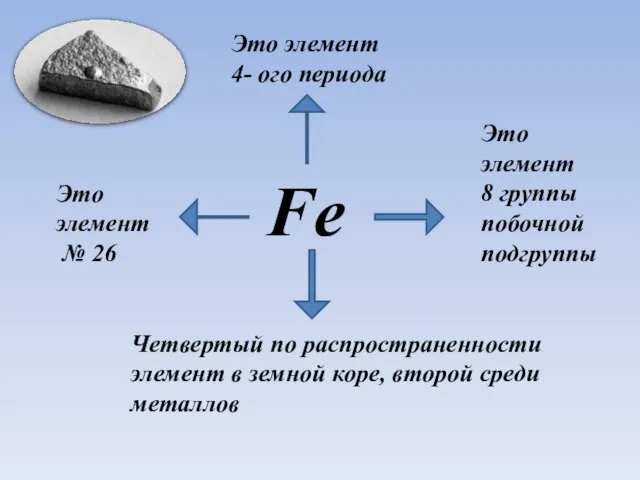
- 2. Fe Это элемент № 26 Это элемент 4- ого периода Четвертый по распространенности элемент в земной
- 3. Электронное строение железа
- 4. Нахождение в природе В земной коре железо распространено достаточно широко — на его долю приходится около
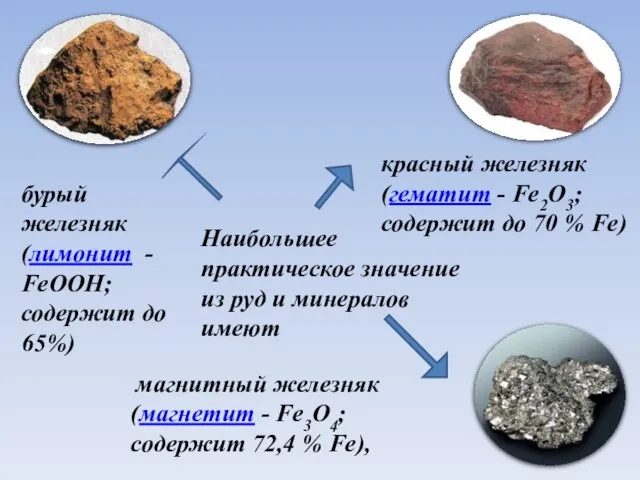
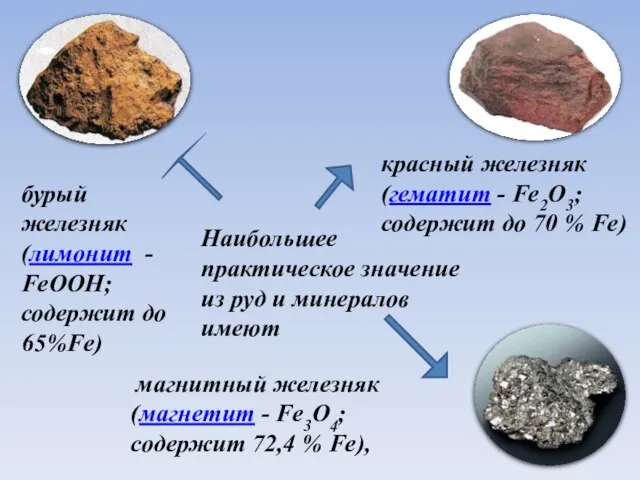
- 5. Наибольшее практическое значение из руд и минералов имеют магнитный железняк (магнетит - Fe3O4; содержит 72,4 %
- 6. Наибольшее практическое значение из руд и минералов имеют магнитный железняк (магнетит - Fe3O4; содержит 72,4 %
- 7. Физические свойства железа Железо- сравнительно мягкий , ковкий серебристо-серый металл Температура плавления 15350C Температура кипения 28000C
- 8. Химические свойства 1. Реакции с простыми веществами Железо сгорает в чистом кислороде при нагревании:4Fe +3O2=2Fe2O3 Реагирует
- 9. Химические свойства 2. Реакции со сложными веществами С кислотами: А) с соляной кислотой 2HCL + Fe
- 10. Железо в организме Железо присутствует в организмах всех растений и животных, но в малых количествах (в
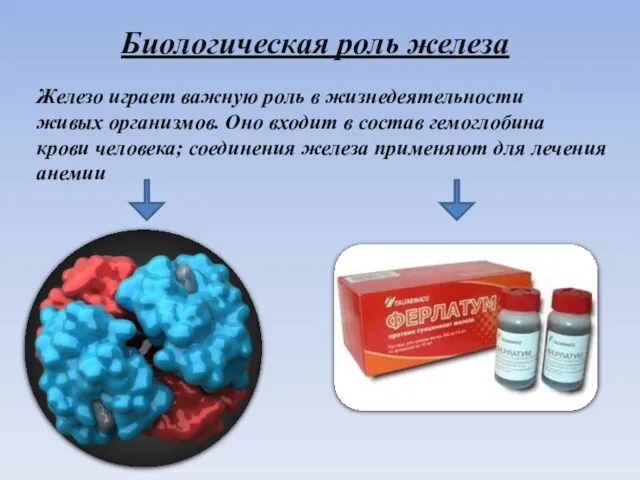
- 11. Биологическая роль железа Железо играет важную роль в жизнедеятельности живых организмов. Оно входит в состав гемоглобина
- 12. Первое металлическое железо, попавшее в руки человека, имело, вероятно, метеоритное происхождение. Руды железа широко распространены и
- 13. Люди впервые овладели железом в четвертом-третьем тысячелетиях до н. э., подбирая упавшие с неба камни —
- 14. Применение железа, его сплавов и соединений Чистое железо имеет довольно ограниченное применение. Его используют при изготовлении
- 15. «Чистое железо способно быстро намагничиваться и размагничиваться, поэтому его применяют для изготовления сердечников, трансфо-, мембраноматоров, электромагнитов
- 17. Скачать презентацию










 Розы на день матери
Розы на день матери Тот, кто не знает своего прошлого, не может понять настоящее и предвидеть будущее. Н.М Карамзин
Тот, кто не знает своего прошлого, не может понять настоящее и предвидеть будущее. Н.М Карамзин Дефектология
Дефектология 10 аргументов в пользу выбора профессии в сфере туристического бизнеса и гостеприимства
10 аргументов в пользу выбора профессии в сфере туристического бизнеса и гостеприимства Многообразие птиц
Многообразие птиц Солнце – вечный огонь Вселенной. Солнечная система
Солнце – вечный огонь Вселенной. Солнечная система Эскиз сюжетной росписи кухонной доски
Эскиз сюжетной росписи кухонной доски Переход одних частей речи в другие.
Переход одних частей речи в другие. Автор: Дмитриев Александр; Карымов Савва.
Автор: Дмитриев Александр; Карымов Савва. Развитие мыслительной деятельности на уроке
Развитие мыслительной деятельности на уроке История компьютерных сетей
История компьютерных сетей Технологическая карта современного урока
Технологическая карта современного урока Роль всех литературно-художественных направлений всех эпох в развитии литературы
Роль всех литературно-художественных направлений всех эпох в развитии литературы ЖОСТОВО
ЖОСТОВО ООО Формула фасада Стиль в архитектуре
ООО Формула фасада Стиль в архитектуре Состав и польза шоколада
Состав и польза шоколада Презентация на тему Деление многозначных чисел
Презентация на тему Деление многозначных чисел Methods of Study of Nanosized Systems
Methods of Study of Nanosized Systems Цветовой круг. Цветоведение
Цветовой круг. Цветоведение Презентация в состоянии подготовки (ее надо выложить)
Презентация в состоянии подготовки (ее надо выложить) Разряды прилагательных по значеню
Разряды прилагательных по значеню МУНИЦИПАЛЬНОЕ ОБРАЗОВАНИЕ "ИКРЯНИНСКИЙ РАЙОН"
МУНИЦИПАЛЬНОЕ ОБРАЗОВАНИЕ "ИКРЯНИНСКИЙ РАЙОН" Теоретические и практические вопросы подготовки к ЕГЭ по математике
Теоретические и практические вопросы подготовки к ЕГЭ по математике Перфоративная язва
Перфоративная язва Oracle. Средства хранения данных и автоматизации деятельности предприятий.
Oracle. Средства хранения данных и автоматизации деятельности предприятий. Культура и религия
Культура и религия Методы и средства обеспечения информационной безопасности в системе 1С:Предприятие 8.1
Методы и средства обеспечения информационной безопасности в системе 1С:Предприятие 8.1 B3: Анализ программы
B3: Анализ программы