Содержание
- 2. Базис молекулярной биотехнологии (МБТ) I. Биологические системы, использующиеся в МБТ Прокариоты: Escherichia coli и др. микроорганизмы
- 3. Технология рекомбинантных ДНК (ее называют также молекулярным клонированием или генной инженерией) — это совокупность экспериментальных процедур,
- 4. По Баеву А.А. генетическая инженерия - конструирование in vitro функционально активных генетических структур (рекомбинантных ДНК), или
- 5. Генетическая инженерия - получение новых комбинаций генетического материала путем проводимых вне клетки манипуляций с молекулами нуклеиновых
- 6. Цель прикладной генетической инженерии заключается в конструировании таких рекомбинантных молекул ДНК, которые при внедрении в генетический
- 7. Что такое молекулярная биология Молекулярная биология - это наука, изучающая функционирование живых организмов сквозь призму химической
- 8. Структура белков Белки - это нерегулярные полимеры, мономерами которых являются L-аминокислоты. Помимо L - аминокислот, входящих
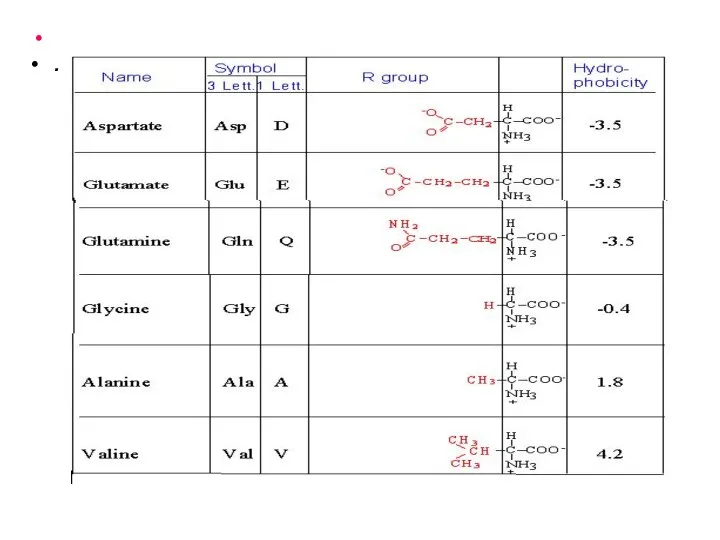
- 9. Классификация аминокислот, входящих в состав белков, по принципу полярности (неполярности) радикала 1. Неполярные или гидрофобные радикалы.
- 10. . Индекс гидрофобности указывает на сродство радикала к воде, т.е. на его растворимость в водных растворителях.
- 11. .
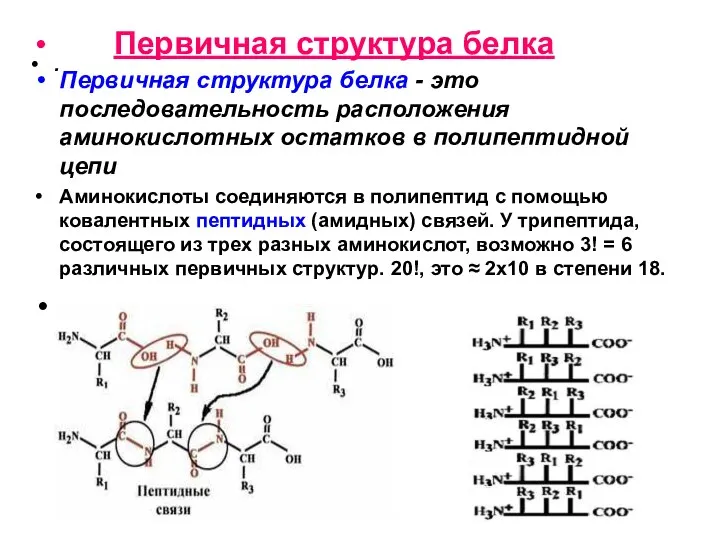
- 12. . Первичная структура белка Первичная структура белка - это последовательность расположения аминокислотных остатков в полипептидной цепи
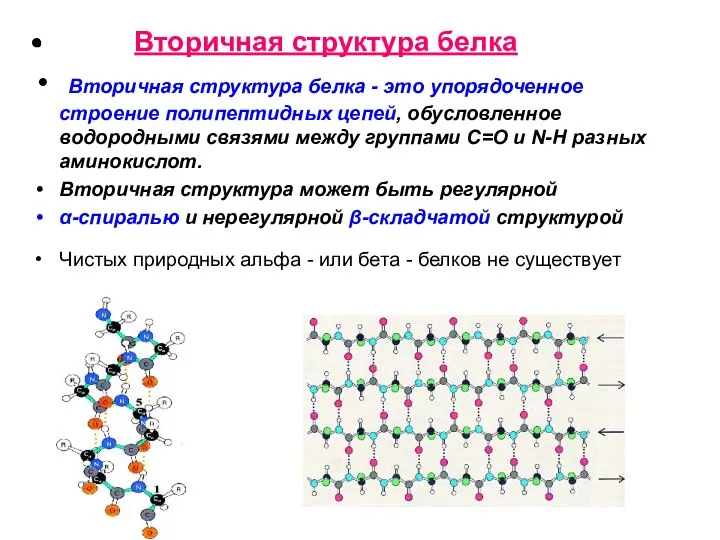
- 13. Вторичная структура белка Вторичная структура белка - это упорядоченное строение полипептидных цепей, обусловленное водородными связями между
- 14. . Третичная структура белка Третичная структура белка - это пространственная конформация полипептида, имеющего вторичную структуру, и
- 15. . Третичная структура полностью задается первичной. Определяющими являются гидрофобные взаимодействия в силу неизбирательности (неспецифичности) и многочисленности.
- 16. . Четвертичная структура белка Четвертичная структура - это агрегация двух или большего числа полипептидных цепей, имеющих
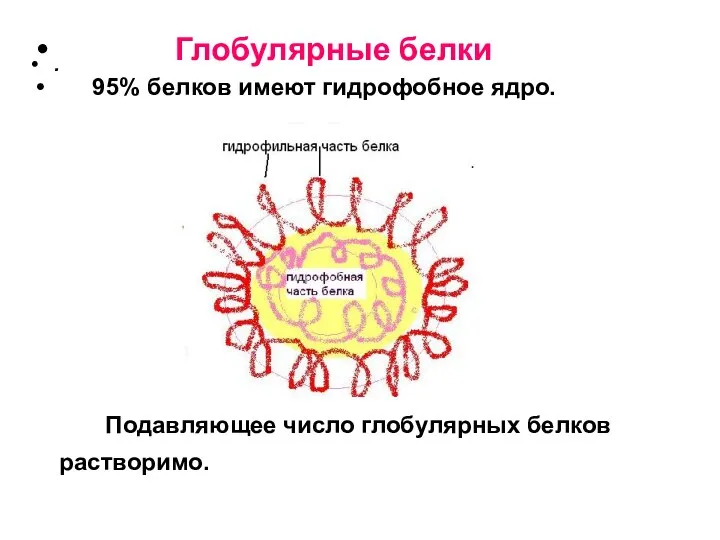
- 17. . Глобулярные белки 95% белков имеют гидрофобное ядро. Подавляющее число глобулярных белков растворимо.
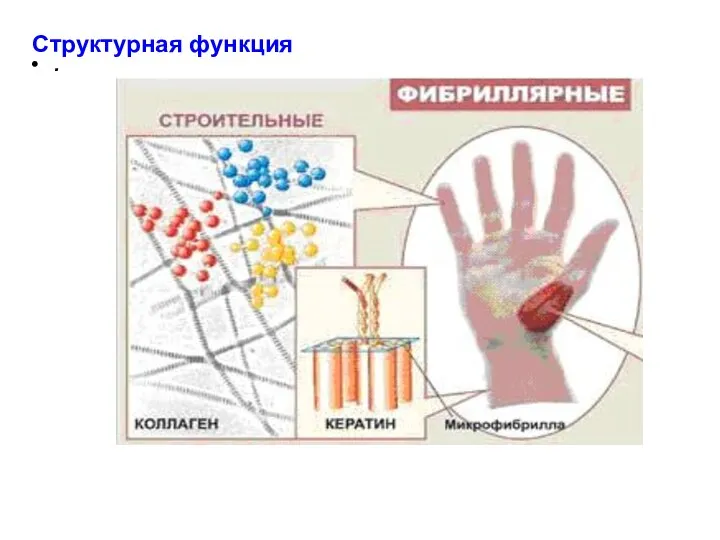
- 18. . Фибриллярные белки 5% природных белков – фибриллярные. Фибриллярные белки содержат большую долю заряженных аминокислот, чем
- 19. . Функции белков Белок - это отдельный полипептид или агрегат нескольких полипептидов, выполняющий биологическую функцию. Полипетид
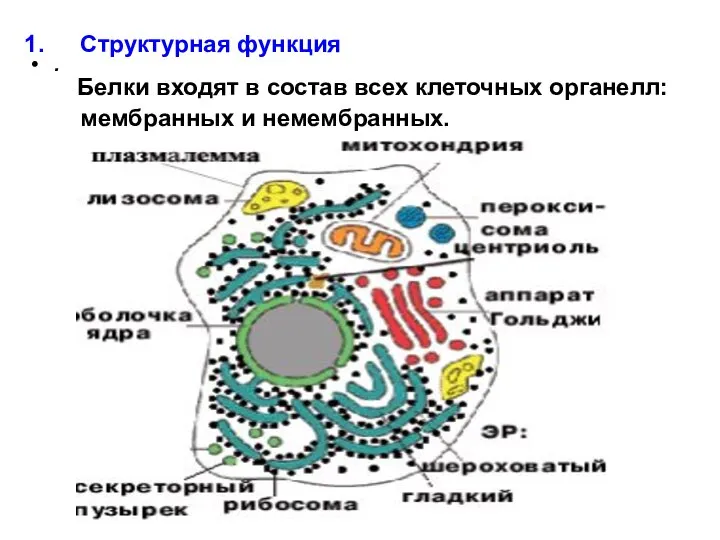
- 20. . Структурная функция Белки входят в состав всех клеточных органелл: мембранных и немембранных.
- 21. . Структурная функция
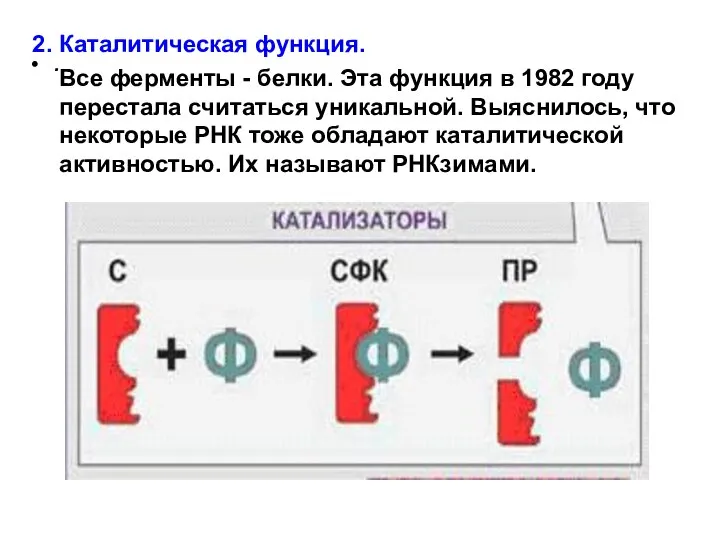
- 22. . 2. Каталитическая функция. Все ферменты - белки. Эта функция в 1982 году перестала считаться уникальной.
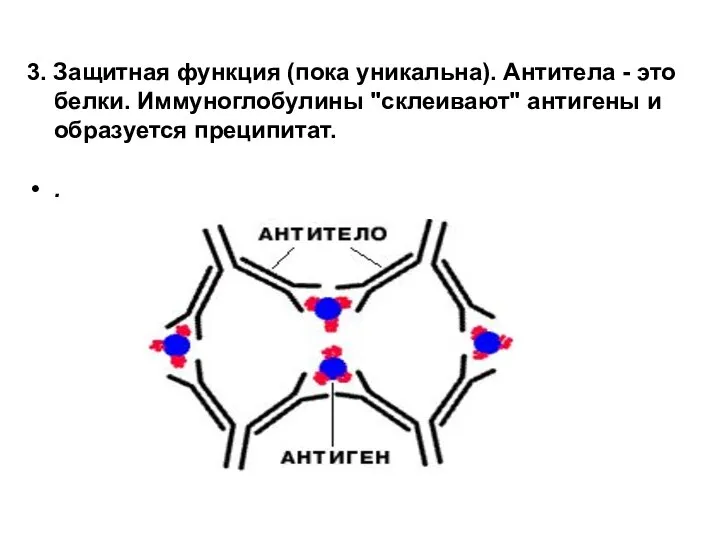
- 23. 3. Защитная функция (пока уникальна). Антитела - это белки. Иммуноглобулины "склеивают" антигены и образуется преципитат. .
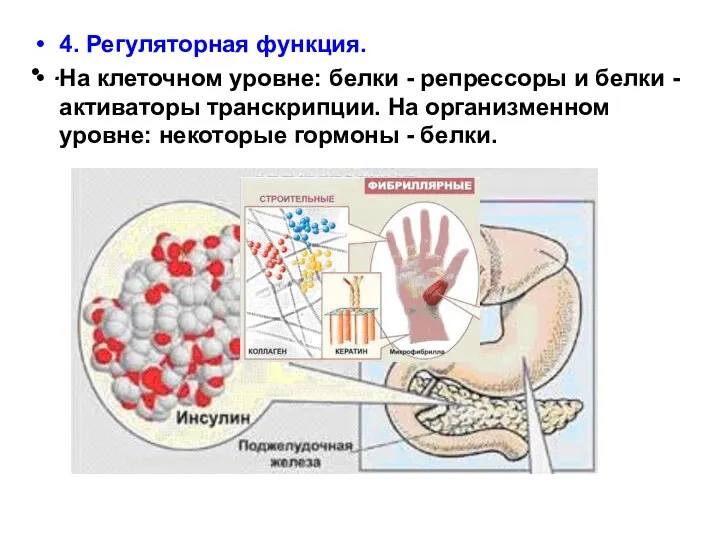
- 24. . 4. Регуляторная функция. На клеточном уровне: белки - репрессоры и белки - активаторы транскрипции. На
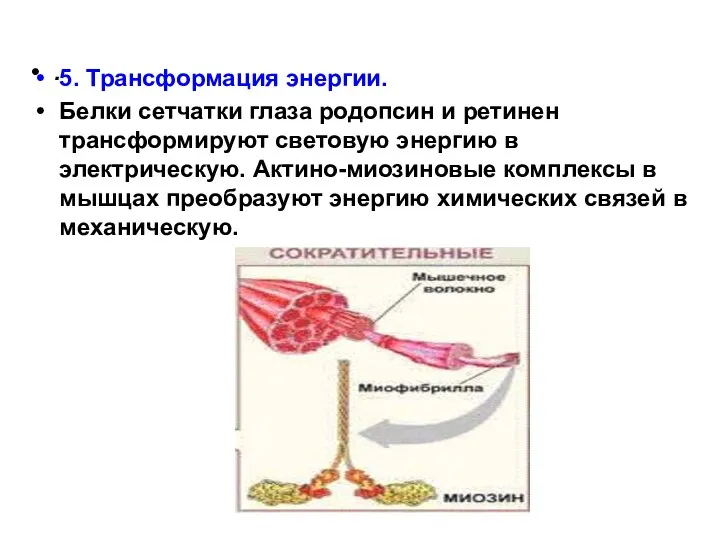
- 25. . 5. Трансформация энергии. Белки сетчатки глаза родопсин и ретинен трансформируют световую энергию в электрическую. Актино-миозиновые
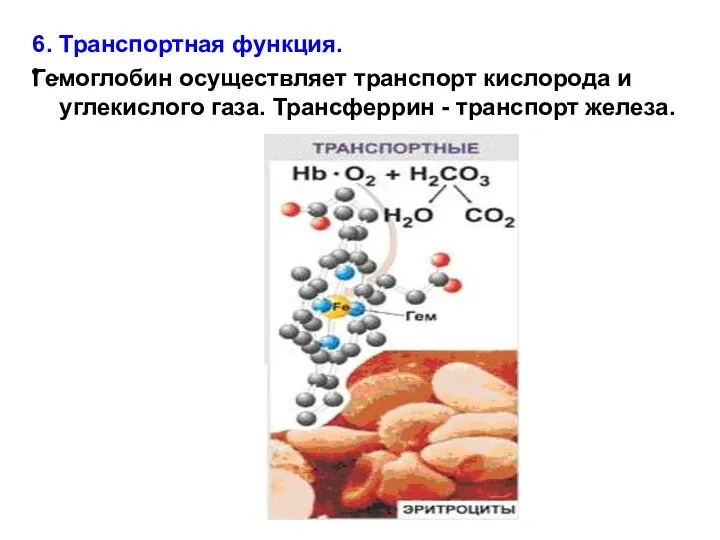
- 26. . 6. Транспортная функция. Гемоглобин осуществляет транспорт кислорода и углекислого газа. Трансферрин - транспорт железа.
- 27. 7. Энергетическая функция. 11 из 20 аминокислот, входящих в состав белков, в организме человека "сгорают" с
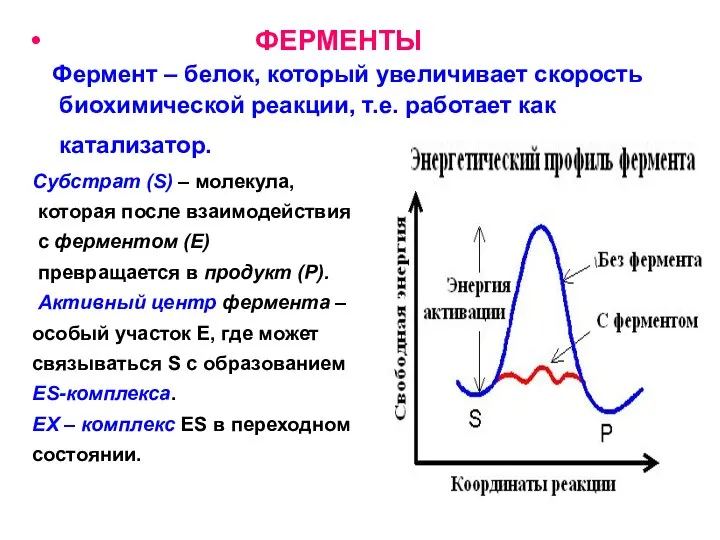
- 28. ФЕРМЕНТЫ Фермент – белок, который увеличивает скорость биохимической реакции, т.е. работает как катализатор. Субстрат (S) –
- 29. Фермент увеличивает скорость реакции: 1. Понижая свободную энергию переходного состояния путем стабилизации активированного комплекса. 2. Увеличивая
- 30. КЛАССИФИКАЦИЯ ФЕРМЕНТОВ По рекомендации International Union of Biochemistry и Molecular Biology (IUBMB) предложена классификация ферментов на
- 31. 4. Лиазы. Катализ разрыва связи С–С, С-О, С-S и C-N без гидролиза: декарбоксилазы и альдолазы. 5.
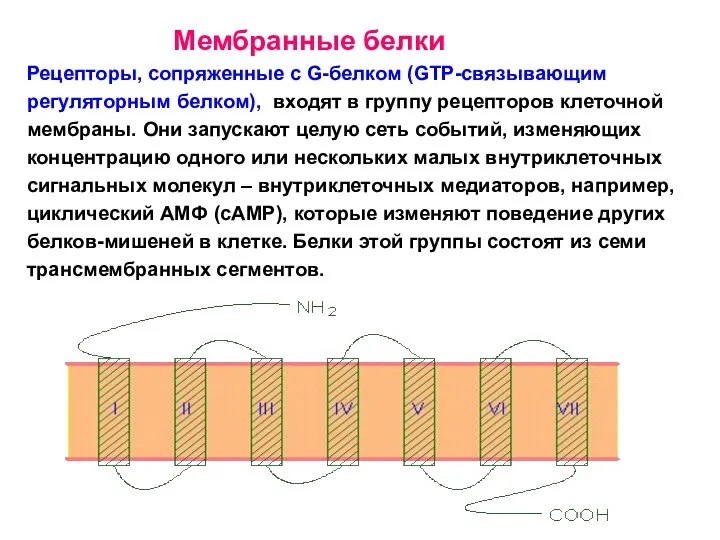
- 32. Мембранные белки Рецепторы, сопряженные с G-белком (GTP-связывающим регуляторным белком), входят в группу рецепторов клеточной мембраны. Они
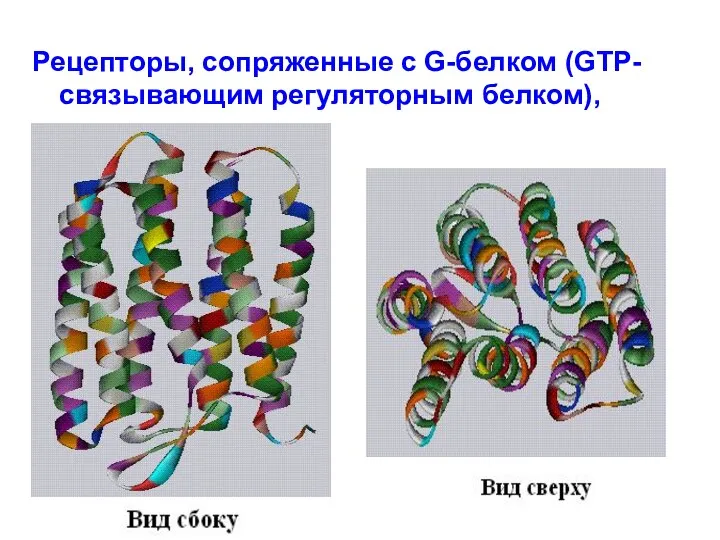
- 33. Рецепторы, сопряженные с G-белком (GTP-связывающим регуляторным белком),
- 34. Семейство иммуноглобулинов – это молекулы, циркулирующие в организме и отвечающие за распознавание чужеродных, или “не своих”,
- 35. Белки ионных каналов. Существует много типов ионных трансмембранных каналов. Они различаются по типу проводимых ионов: кальциевые,
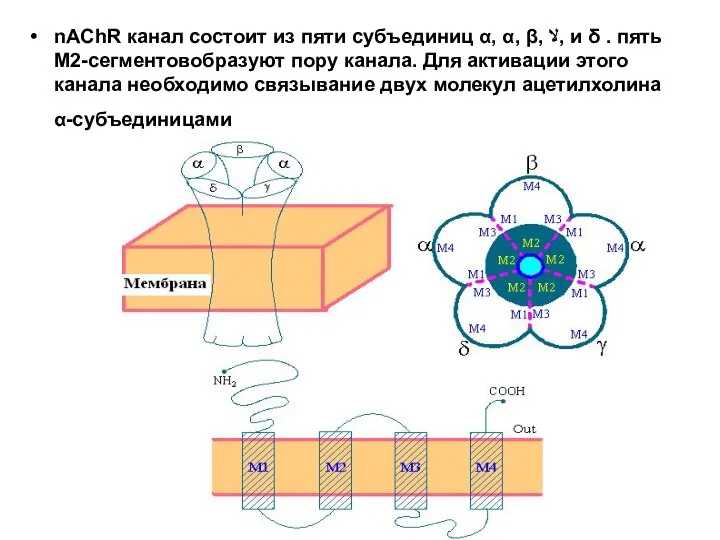
- 36. nAChR канал состоит из пяти субъединиц α, α, β, ﻻ, и δ . пять М2-сегментовобразуют пору
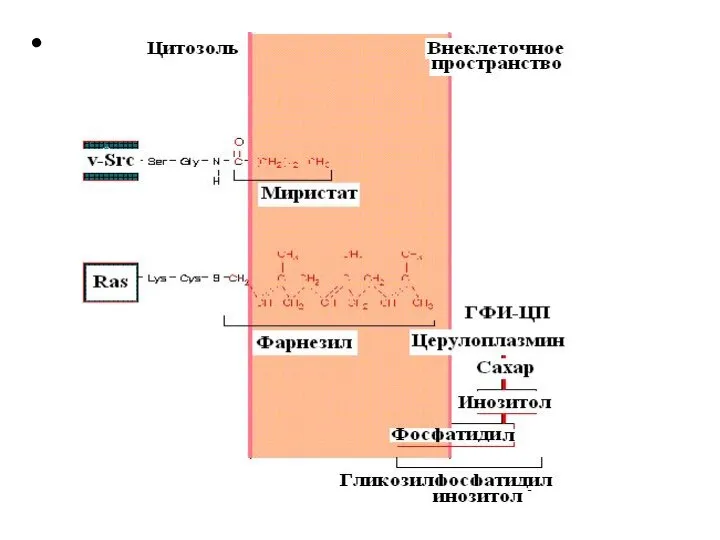
- 37. Мембраносвязанные белки можно подразделить на три группы: - связанные с цитозольной стороной плазматической мембраны посредством миристата
- 40. Скачать презентацию





















 Презентация на тему Тип Кольчатые черви. Класс Малощетинковые
Презентация на тему Тип Кольчатые черви. Класс Малощетинковые  Звери запасаются
Звери запасаются Приспособления организмов к жизни в природе
Приспособления организмов к жизни в природе Древотравы. Жизненная форма растений
Древотравы. Жизненная форма растений Характеристика царства бактерий. Биология (5 класс)
Характеристика царства бактерий. Биология (5 класс) Презентация на тему Генетика популяций
Презентация на тему Генетика популяций 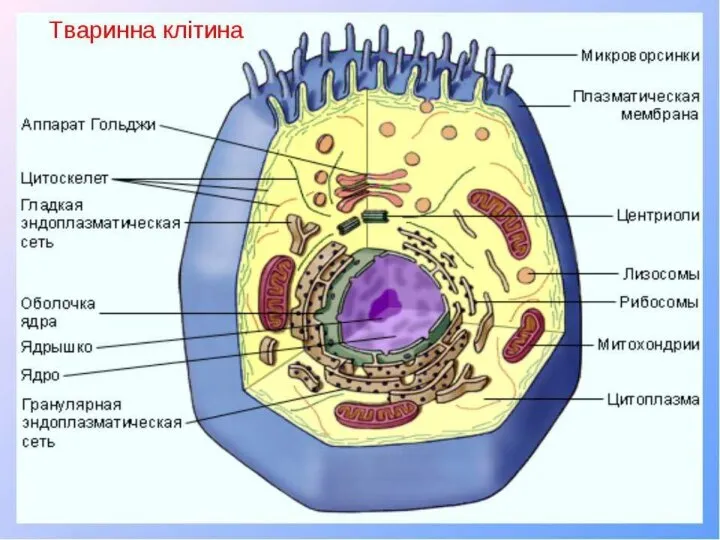 Тваринна клітина
Тваринна клітина Отделы ЦНС. Часть 2
Отделы ЦНС. Часть 2 Наследственная изменчивость, типы мутаций
Наследственная изменчивость, типы мутаций Презентация на тему ВИРУСЫ
Презентация на тему ВИРУСЫ  Уход за комнатными растениями
Уход за комнатными растениями Страницы красной книги
Страницы красной книги Моделирование развития виртуальных колоний и связь его с развитием живых колоний и другими естественными явлениями
Моделирование развития виртуальных колоний и связь его с развитием живых колоний и другими естественными явлениями Большой Арктический государственній природный заповедник
Большой Арктический государственній природный заповедник Необычные формы ДНК
Необычные формы ДНК Fotosinteza
Fotosinteza Животные нашего края
Животные нашего края 07. Обеспечение клеток энергией
07. Обеспечение клеток энергией Модели популяции. Часть 1
Модели популяции. Часть 1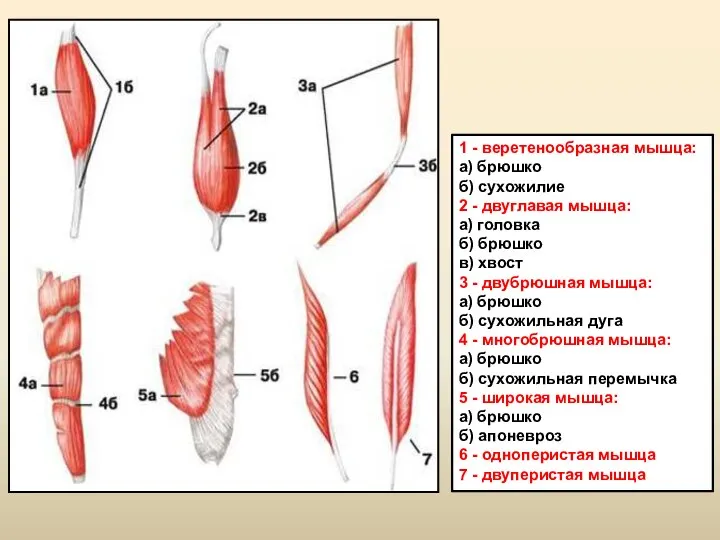 Мышцы головы и шеи
Мышцы головы и шеи Так образуются мегаспора и яйцеклетка
Так образуются мегаспора и яйцеклетка Семейство Бульдоговые летучие мыши (Molossidae)
Семейство Бульдоговые летучие мыши (Molossidae) Строение клетки. Клеточная мембрана. Цитоплазма
Строение клетки. Клеточная мембрана. Цитоплазма Инсектоакарицидные средства
Инсектоакарицидные средства Самые-самые растения
Самые-самые растения Дыхательная система
Дыхательная система Как сажать лес
Как сажать лес Фотосинтез - питание растений. 6 класс
Фотосинтез - питание растений. 6 класс