Слайд 2Изменение энергетики химической реакции
Н2СО3=Н2О+СО2
Энергия активации (Еа)– дополнительное кол-во кинетической энергии, необходимое молекулам

в-ва, чтобы они вступили в реакцию.
Молекула, обладающая Еа находится в переходном состоянии.
Изменение свободной энергии (∆G)-разница энергий между исходным реагентом (Н2СО3) и конечными соединениями (Н2О и СО2)
(фото. из Северин)
Слайд 3Энергетическая диаграмма химической р-ции
Изменение свободной энергии системы во время р-ции S →
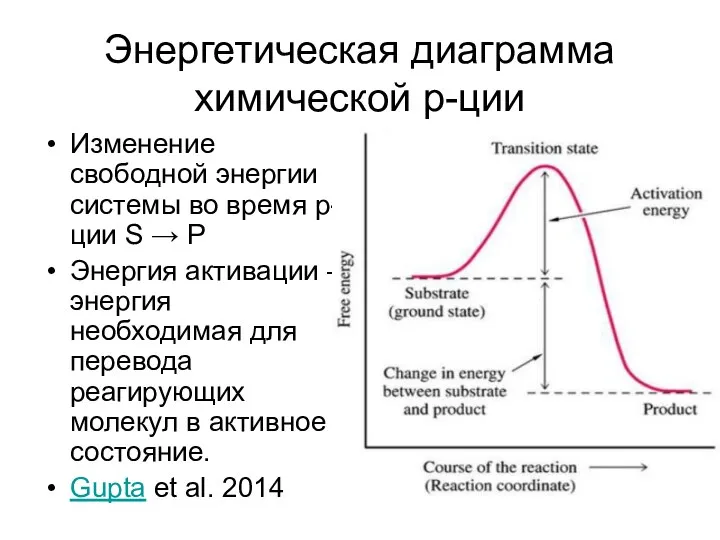
P
Энергия активации – энергия необходимая для перевода реагирующих молекул в активное состояние.
Gupta et al. 2014
Слайд 4Ферменты снижают высоту энергетического барьера
Изменение свободной энергии в ходе химической реакции, некатализируемой
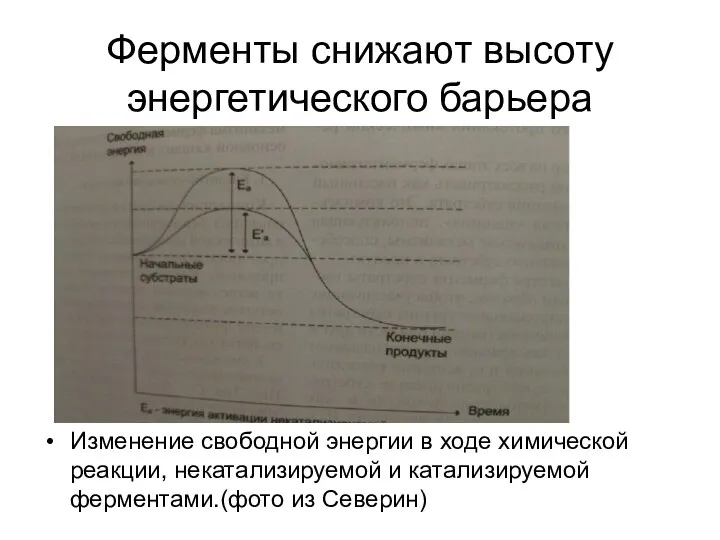
и катализируемой ферментами.(фото из Северин)
Слайд 5Активный центр
Активный центр ферментов расположен в шарнирных, более лабильных сайтах между
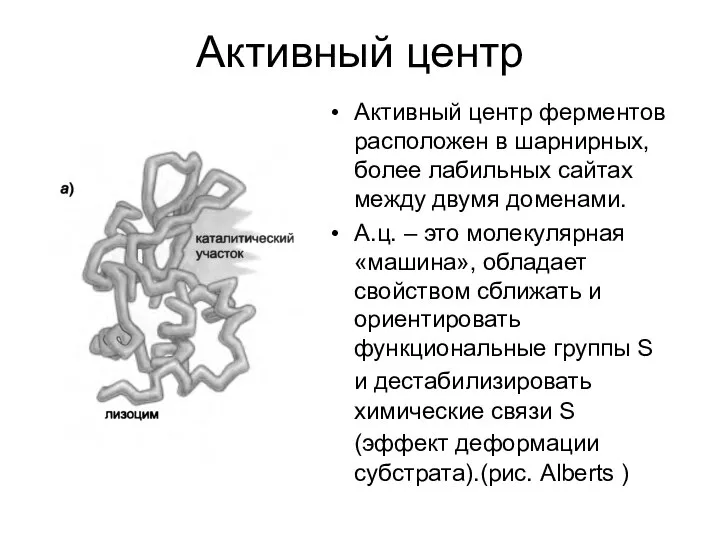
двумя доменами.
А.ц. – это молекулярная «машина», обладает свойством сближать и ориентировать функциональные группы S и дестабилизировать химические связи S (эффект деформации субстрата).(рис. Alberts )
Слайд 6Этапы ферментативного катализа
Е + S ↔ ES ↔ EP ↔ E +
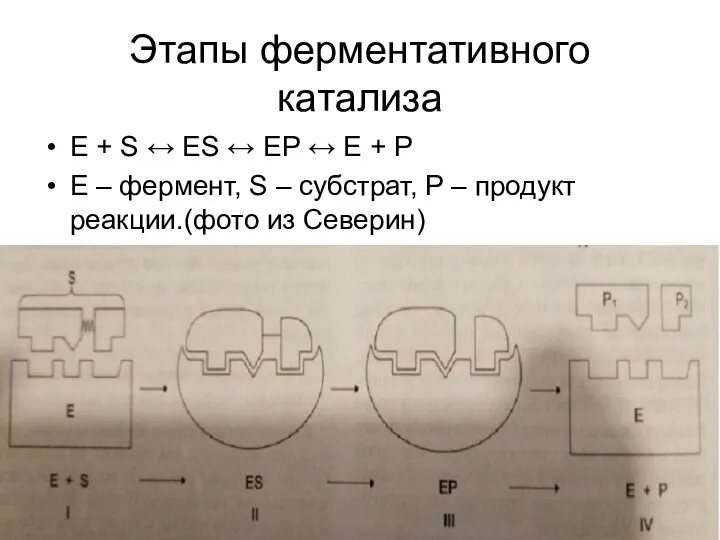
P
E – фермент, S – субстрат, P – продукт реакции.(фото из Северин)
Слайд 7Этапы ферментативного катализа
Е + S (I этап) ↔ ES (II этап)
I этап
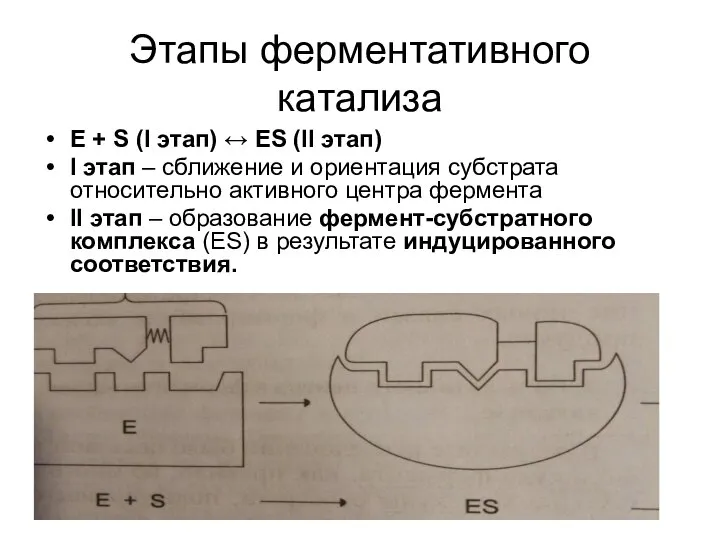
– сближение и ориентация субстрата относительно активного центра фермента
II этап – образование фермент-субстратного комплекса (ЕS) в результате индуцированного соответствия.
Слайд 8Этапы ферментативного катализа
III этап (ЕР) – деформация субстрата и образование нестабильного комплекса
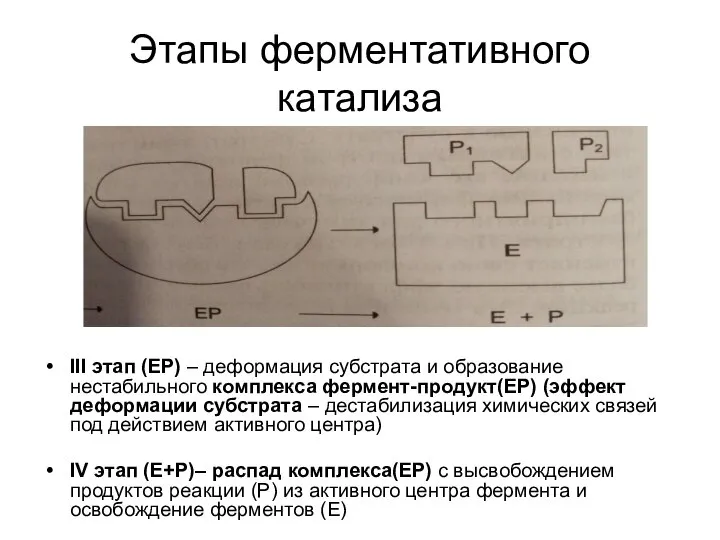
фермент-продукт(ЕР) (эффект деформации субстрата – дестабилизация химических связей под действием активного центра)
IV этап (Е+Р)– распад комплекса(ЕР) с высвобождением продуктов реакции (Р) из активного центра фермента и освобождение ферментов (Е)
Слайд 9Молекулярные механизмы ферментативного катализа
Кислотно-основной катализ. Аминокислотные остатки активного центра имеют функциональные группы
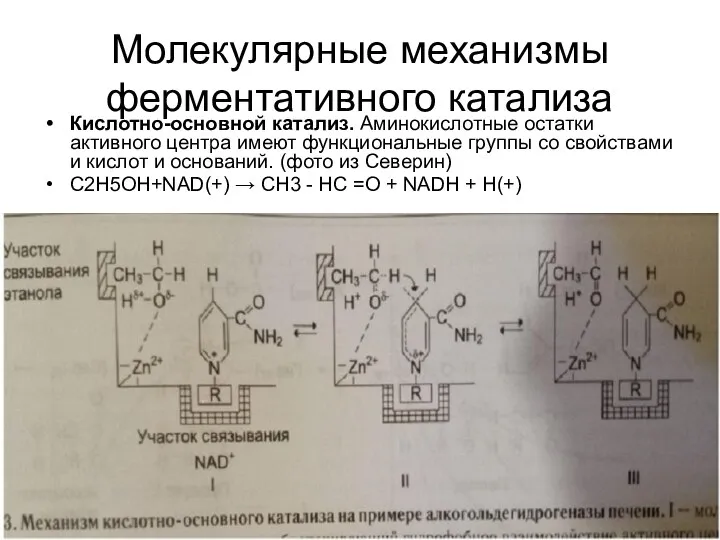
со свойствами и кислот и оснований. (фото из Северин)
С2Н5ОН+NAD(+) → CH3 - HC =O + NADH + H(+)
Слайд 10Ковалентный катализ
Между субстратом и ферментом (коферментом или функциональной группой а.к. остатка активного

центра фермента (ацф) образуется ковалентная связь.
К.к. основан на атаках нуклеофильных (отрицательно заряженных) или электрофильных (положительно зар-х) групп ацф молекулами субстрата.
Слайд 11Механизм ковалентного катализа в активном центре химотрипсина (гидролиз пептидных связей при переваривании
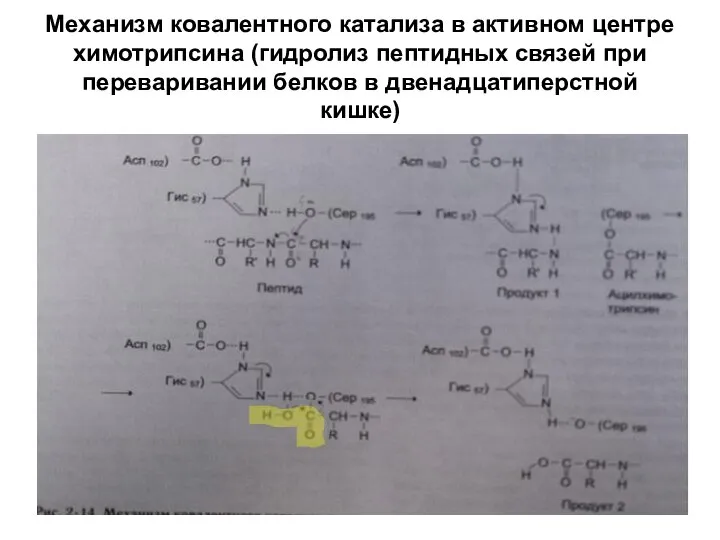
белков в двенадцатиперстной кишке)
Слайд 12Мультисубстратные р-ции.
1. Механизм «пинг-понг»

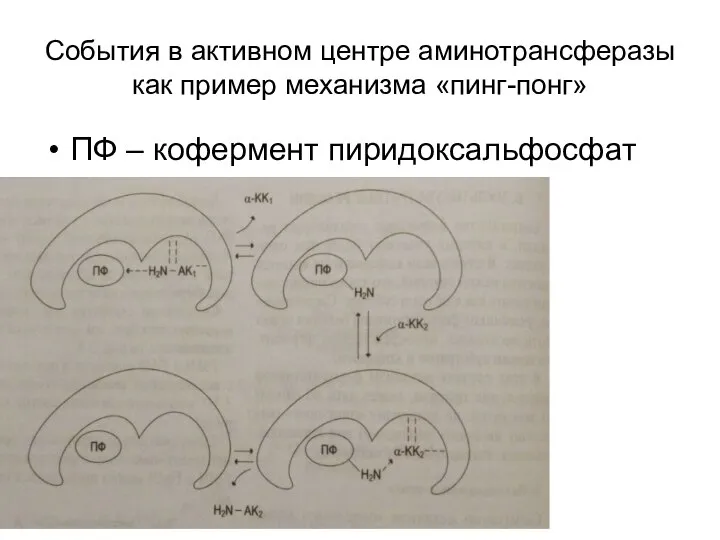
Слайд 13События в активном центре аминотрансферазы как пример механизма «пинг-понг»
ПФ – кофермент пиридоксальфосфат
Слайд 142. Последовательный механизм
1. Механизм упорядоченного взаимодействия субстрата с активным центром фермента.














 Сравнение клеток разных систематических групп
Сравнение клеток разных систематических групп Medical biology
Medical biology Отруйні гриби
Отруйні гриби Природа России (Тест)
Природа России (Тест) Анатомия и физиология сердечно-сосудистой системы человека
Анатомия и физиология сердечно-сосудистой системы человека Строение клетки и функции органоидов. Органеллы клетки
Строение клетки и функции органоидов. Органеллы клетки Марсупиализация,основные аспекты проведения (создание искусственного соустья между слизистой оболочкой бартолиновой железы
Марсупиализация,основные аспекты проведения (создание искусственного соустья между слизистой оболочкой бартолиновой железы Семейство кленовые
Семейство кленовые Биология_8 класс_Питание_Сравнение пищеварительной системы беспозвоночных, жвачных животных и человека_Презентация
Биология_8 класс_Питание_Сравнение пищеварительной системы беспозвоночных, жвачных животных и человека_Презентация Род дикобразы (hystrix)
Род дикобразы (hystrix) Дыхательная система. Лекция №7
Дыхательная система. Лекция №7 Возрастные особенности эндокринной системы
Возрастные особенности эндокринной системы Презентация на тему ЧЛЕНИСТОНОГИЕ
Презентация на тему ЧЛЕНИСТОНОГИЕ  Biochimie du tissu nerveux et musculaire
Biochimie du tissu nerveux et musculaire Сурок Байбак
Сурок Байбак Физиология ЦНС
Физиология ЦНС Составляющие элементы процесса репликации ДНК. (Лекция 11)
Составляющие элементы процесса репликации ДНК. (Лекция 11) Игра с фразеологизмами И это все скелет для 8 классов
Игра с фразеологизмами И это все скелет для 8 классов Презентация на тему Современные методы селекции
Презентация на тему Современные методы селекции  Липиды. Углеводы_, 9-10 класс
Липиды. Углеводы_, 9-10 класс Отделы пищеварительной системы
Отделы пищеварительной системы Лекарственное значение листьев растений
Лекарственное значение листьев растений Морские обитатели.. Морской конёк
Морские обитатели.. Морской конёк Объекты живой и неживой природы
Объекты живой и неживой природы Летняя и осенняя окраска листьев
Летняя и осенняя окраска листьев Домашние животные
Домашние животные Лабораторная работа: Скелет и мышцы. Утомление при статической и динамической работе
Лабораторная работа: Скелет и мышцы. Утомление при статической и динамической работе