Слайд 2КОНКУРЕНТНОЕ И НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ ФЕРМЕНТОВ
Схема неконкурентного ингибирования активности фермента
Схема конкурентного ингибирования активности
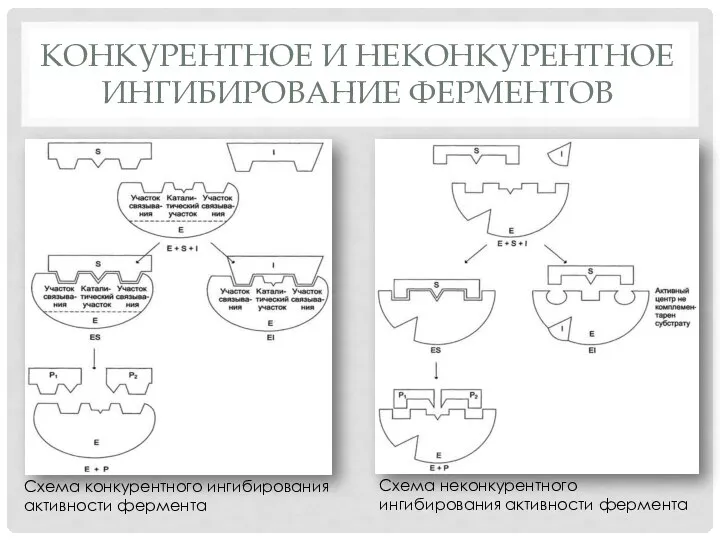
фермента
Слайд 3КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
В этом случае ингибитор связывается в активном центре фермента и конкурирует
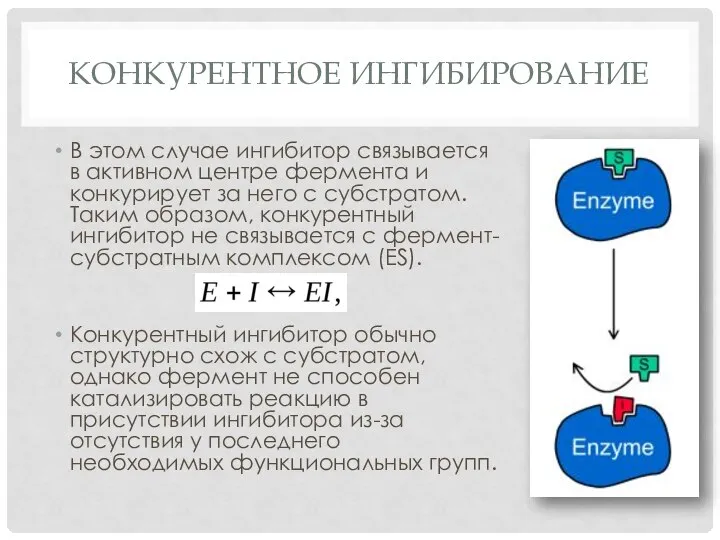
за него с субстратом. Таким образом, конкурентный ингибитор не связывается с фермент-субстратным комплексом (ES).
Конкурентный ингибитор обычно структурно схож с субстратом, однако фермент не способен катализировать реакцию в присутствии ингибитора из-за отсутствия у последнего необходимых функциональных групп.
Слайд 4КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
Реакция, катализируемая сукцинатдегидрогеназой, и ее конкурентное ингибирование.
Конкурентные ингибиторы напоминают в структурном

отношении сукцинат- они содержат две определенным образом расположенные в пространстве отрицательно заряженные группы, которые соответствуют конформации активного центра.
Слайд 5НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
В случае неконкурентного ингибирования ингибитор связывается с ферментом не в активном

центре.
Неконкурентные ингибиторы связываются обратимо как с ферментом, так и с фермент-субстратным комплексом.
Ингибитор вызывает такие конформационные изменения, которые не позволяют ферменту превращать субстрат в продукт, но не влияют на сродство фермента к субстрату.




 Условия нормального функционирования зрительного анализатора
Условия нормального функционирования зрительного анализатора Ядовитые и неядовитые змеи
Ядовитые и неядовитые змеи Презентация на тему Биология - наука о живой природе (6 класс)
Презентация на тему Биология - наука о живой природе (6 класс)  Разнообразие животного мира планеты
Разнообразие животного мира планеты История систематики растении
История систематики растении Доказательства эволюции живой природы
Доказательства эволюции живой природы Genetik
Genetik Презентация на тему Животные космонавты
Презентация на тему Животные космонавты  Водорастворимые витамины
Водорастворимые витамины Презентация на тему Значение ОДС. Строение костей
Презентация на тему Значение ОДС. Строение костей  Энергозатарты человека и пищевой рацион
Энергозатарты человека и пищевой рацион Презентация на тему Дыхание и здоровье человека
Презентация на тему Дыхание и здоровье человека  Морские и пресноводные животные
Морские и пресноводные животные Экологическая задача Ч.Дарвина
Экологическая задача Ч.Дарвина Метаболизм углеводов
Метаболизм углеводов Ткани, органы и системы органов
Ткани, органы и системы органов Вычисление линейного увеличения клеток
Вычисление линейного увеличения клеток Перелётные птицы скворцы
Перелётные птицы скворцы Деревья зимой и летом
Деревья зимой и летом Нуклеиновые кислоты
Нуклеиновые кислоты Семейство розоцветные
Семейство розоцветные Организм человека. Общий обзор. Урок № 1.3. Клетка: строение, химический состав и жизнедеятельность
Организм человека. Общий обзор. Урок № 1.3. Клетка: строение, химический состав и жизнедеятельность Животный мир. 5 класс
Животный мир. 5 класс Роль железа в организме человека
Роль железа в организме человека Применение удобрений в лесном питомнике
Применение удобрений в лесном питомнике Белки: строение и функции. Лекция 2
Белки: строение и функции. Лекция 2 Презентация на тему СТЕБЕЛЬ
Презентация на тему СТЕБЕЛЬ  Презентация на тему Строение и соединение костей
Презентация на тему Строение и соединение костей