Содержание
- 2. История метода В 1971 г. норвежский учёный Хьелль Клеппе предложил способ амплификации ДНК с помощью пары
- 3. История метода Science. 1985. V. 230. P. 1350-1354 Нобелевская премия 1993
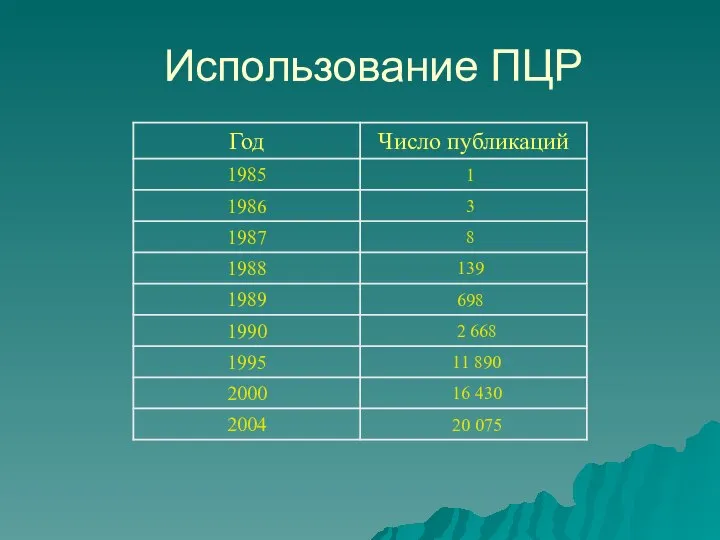
- 4. Использование ПЦР
- 5. Применение ПЦР Клонирование генов Генотипирование организмов Диагностика наследственных, инфекционных и онкологических заболеваний Идентификация личности и установление
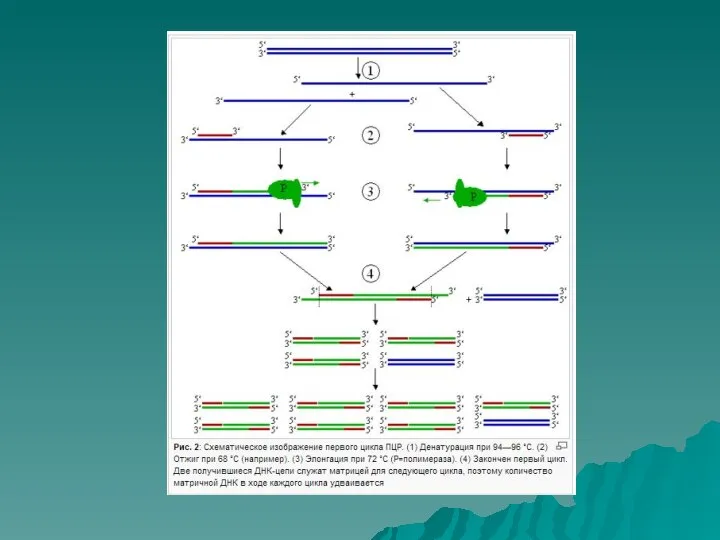
- 6. Основные этапы ПЦР ДЕНАТУРАЦИЯ ОТЖИГ ПРАЙМЕРА ЭЛОНГАЦИЯ
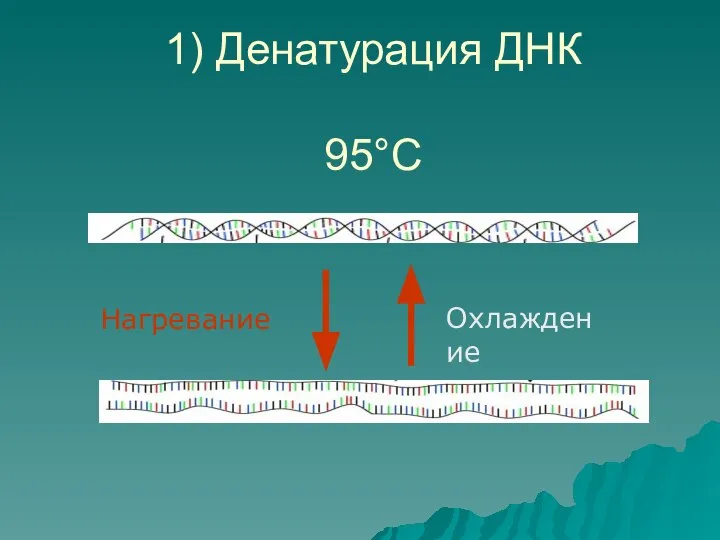
- 7. 1) Денатурация ДНК 95°С
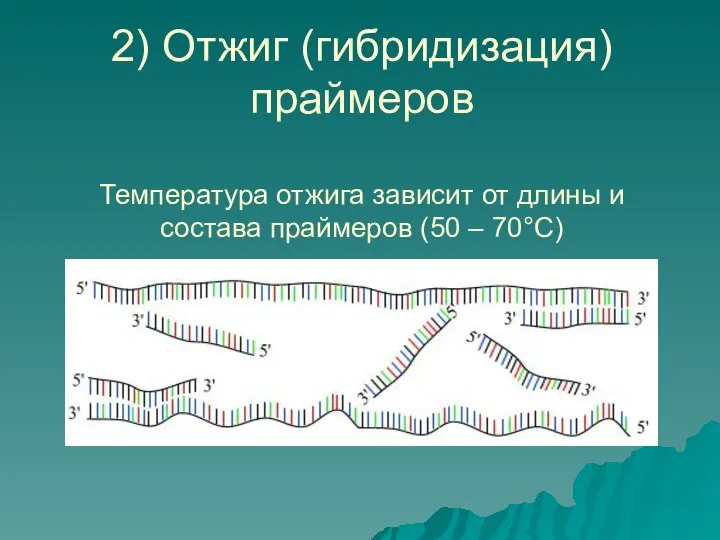
- 8. 2) Отжиг (гибридизация) праймеров Температура отжига зависит от длины и состава праймеров (50 – 70°С)
- 9. 3) Элонгация 72°С Дезоксирибонуклеозидтрифосфоты (dATP, dGTP, dCTP, dTTP)
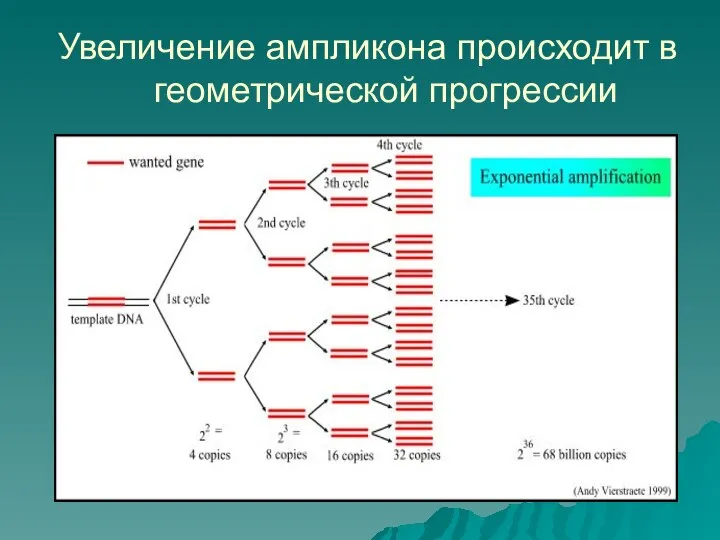
- 11. Увеличение ампликона происходит в геометрической прогрессии
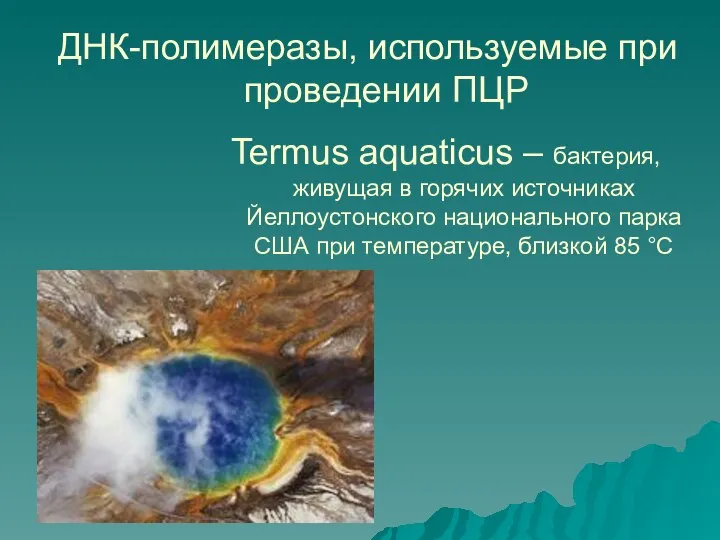
- 12. ДНК-полимеразы, используемые при проведении ПЦР Termus aquaticus – бактерия, живущая в горячих источниках Йеллоустонского национального парка
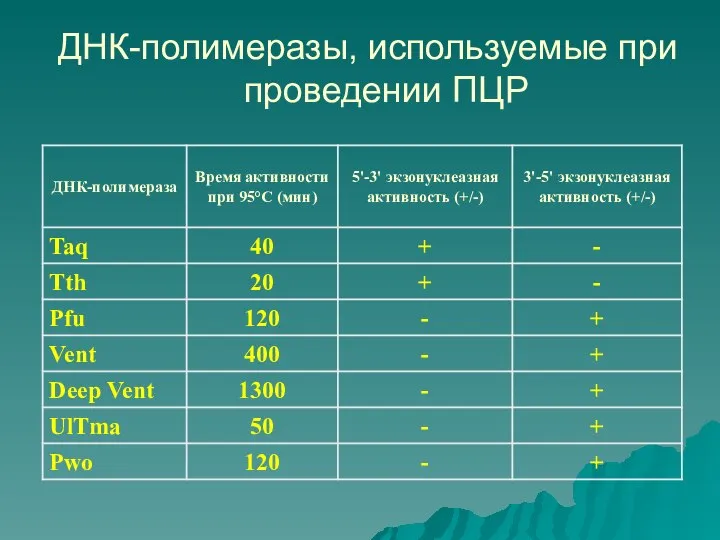
- 13. ДНК-полимеразы, используемые при проведении ПЦР
- 14. Подбор праймеров Длина праймеров – 18-30 нуклеотидов Содержание GC должно составлять 45-55% Разница в температурах отжига
- 15. Основные компоненты для проведения ПЦР ДНК-матрица ДНК-полимераза Буфер: - 10 mM Tris-HCl, pH = 8,0-8,8; -
- 16. Дополнительные компоненты для проведения ПЦР ДМСО (5%) – улучшает амплификацию GC-богатых матриц и отжиг праймеров Формамид
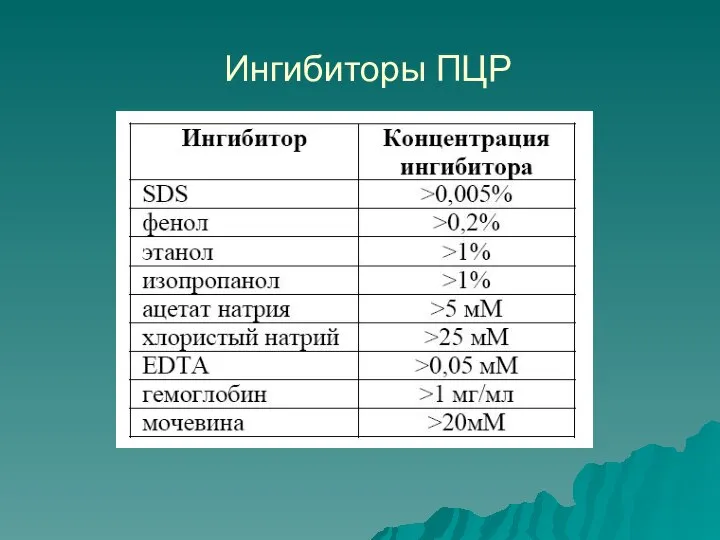
- 17. Ингибиторы ПЦР
- 18. 95˚C- 2 мин (горячий старт - денатурация) 2) 94˚С -30 сек (денатурация) 3) 62˚С -45 сек
- 20. Скачать презентацию









 Презентация на тему Среды обитания животных
Презентация на тему Среды обитания животных  История породы сенбернар
История породы сенбернар Методы изучения живых организмов. Многообразие форм живых организмов
Методы изучения живых организмов. Многообразие форм живых организмов Всемирный день защиты животных
Всемирный день защиты животных Шежере
Шежере Развитие живых организмов
Развитие живых организмов Подцарство одноклеточные. 5 класс
Подцарство одноклеточные. 5 класс Углеводы: глюкоза, фруктоза, сахароза, крахмал, лактоза
Углеводы: глюкоза, фруктоза, сахароза, крахмал, лактоза Общие признаки розоцветных
Общие признаки розоцветных Гормон страха. Адреналин
Гормон страха. Адреналин Красота родной природы
Красота родной природы Дыхание у растений
Дыхание у растений Болезни питомников, лесных культур и молодняков. Болезни стволиков, побегов и ветвей
Болезни питомников, лесных культур и молодняков. Болезни стволиков, побегов и ветвей Взаимодействие генов
Взаимодействие генов Деревья наших парков
Деревья наших парков Рослинні угрупування нашого краю
Рослинні угрупування нашого краю 7. Химические вещества в клетке
7. Химические вещества в клетке Офиуры или змеехвостки. Тип иглокожие
Офиуры или змеехвостки. Тип иглокожие Основные систематические группы рыб
Основные систематические группы рыб Презентация на тему Ель, сосна – хвойные растения
Презентация на тему Ель, сосна – хвойные растения  АТФ (аденозинтрифосфорная кислота)
АТФ (аденозинтрифосфорная кислота)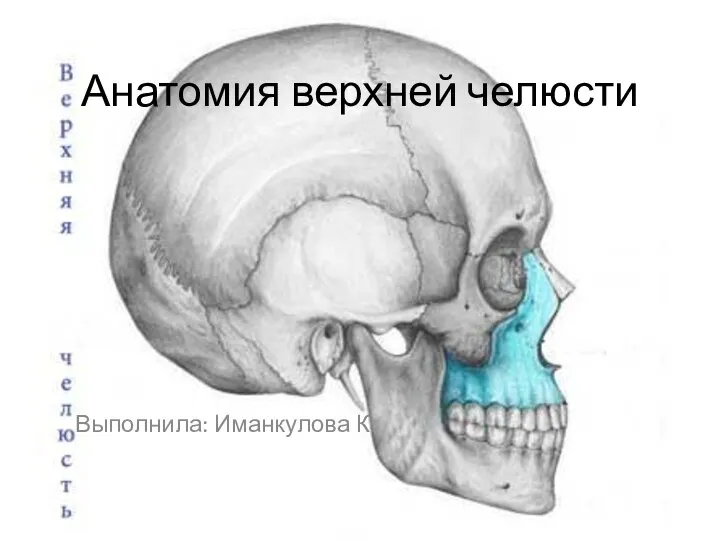 Анатомия верхней челюсти
Анатомия верхней челюсти Lektsia_2
Lektsia_2 Презентация на тему Бактерии
Презентация на тему Бактерии  Царство грибов в живой природе. 6 класс
Царство грибов в живой природе. 6 класс Строение и функции органов дыхания
Строение и функции органов дыхания Растения России
Растения России Из истории открытия простейших
Из истории открытия простейших