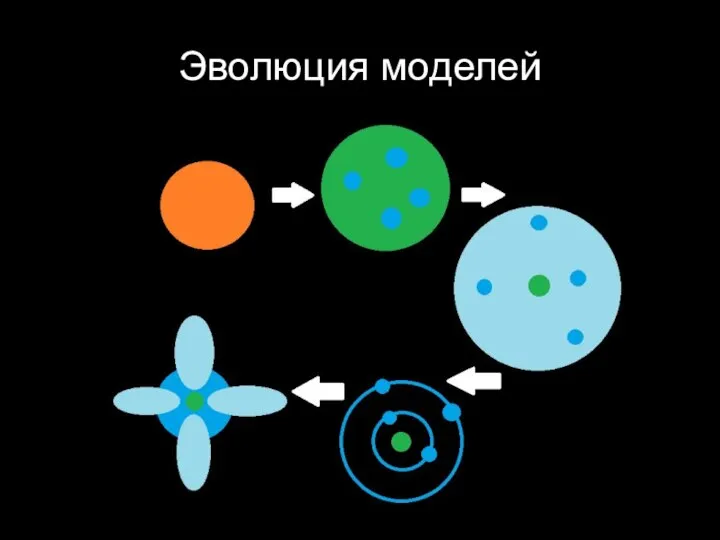
Слайд 2Развитие представлений о строении вещества

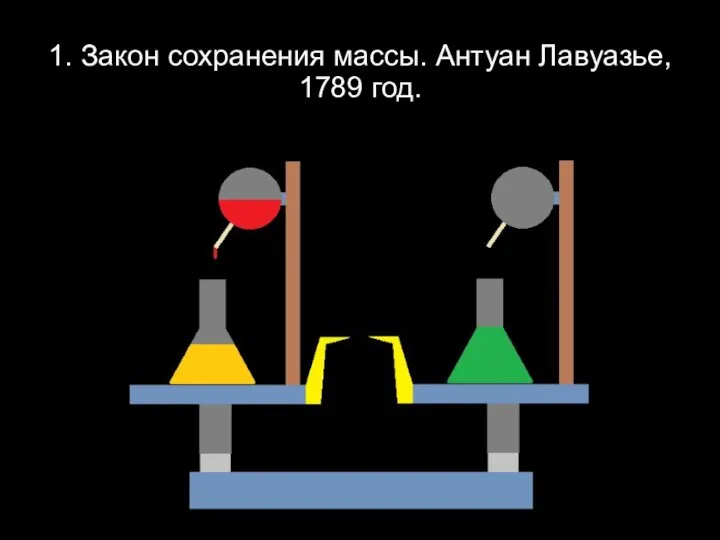
Слайд 31. Закон сохранения массы. Антуан Лавуазье, 1789 год.
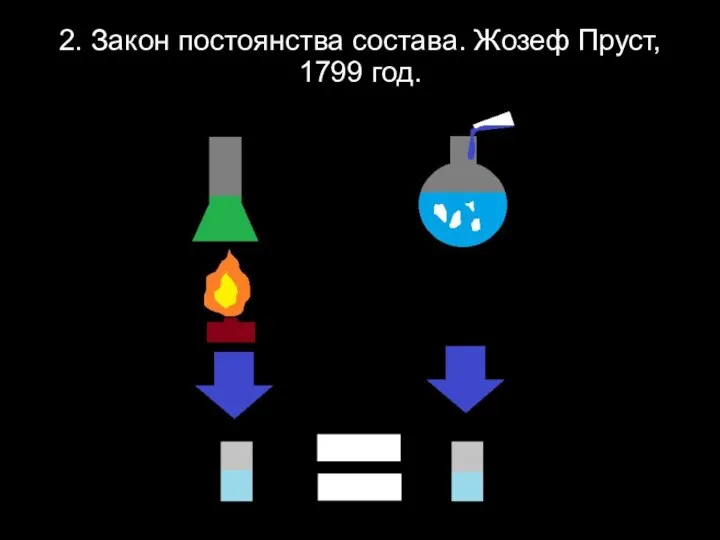
Слайд 42. Закон постоянства состава. Жозеф Пруст, 1799 год.
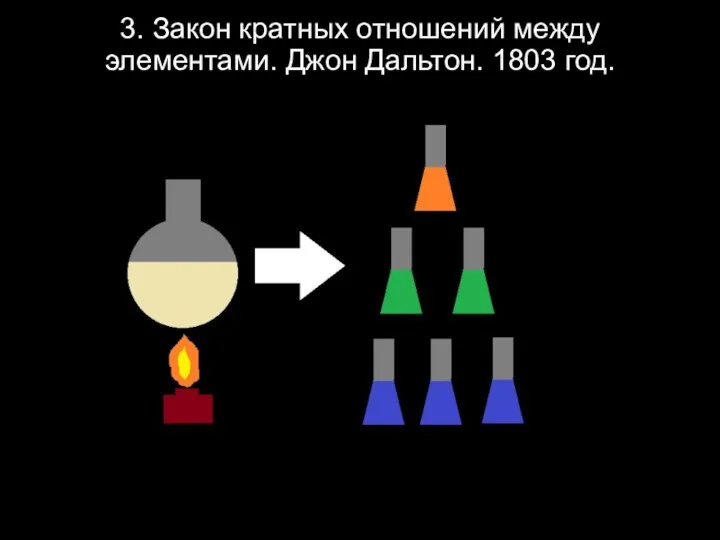
Слайд 53. Закон кратных отношений между элементами. Джон Дальтон. 1803 год.
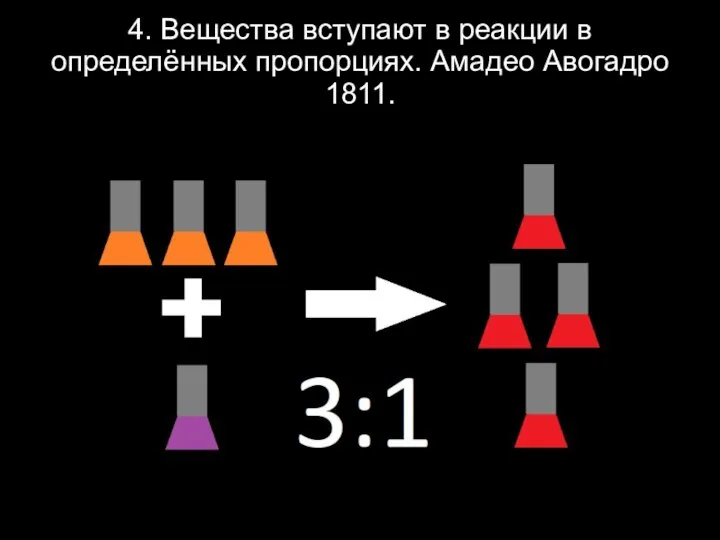
Слайд 64. Вещества вступают в реакции в определённых пропорциях. Амадео Авогадро 1811.
Слайд 10Атом — частица вещества, наименьшая часть химического элемента, являющаяся носителем его свойств.

Слайд 11Концепция неделимого атома
Джон Дальтон
(1766 - 1844)

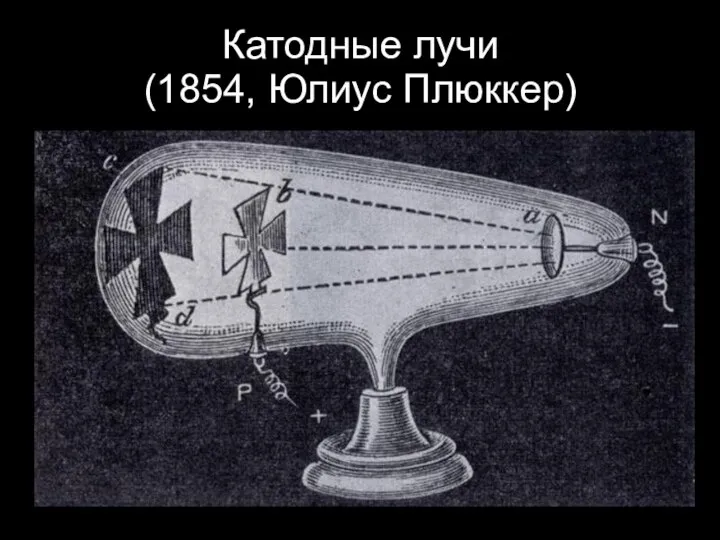
Слайд 12Катодные лучи
(1854, Юлиус Плюккер)
Слайд 14Открытие электрона
Джозеф Джон Томсон
(1856 - 1940)
Отклонение катодных лучей в электрических и

магнитных полях.
Слайд 15Открытие электрона
Джозеф Джон Томсон
(1856 - 1940)
Атом не неделим!

Слайд 16Начало 20-го века. Что известно?
Атомы электрически нейтральны.
Атомы содержат электроны.
Атомы излучают свет только

на определённых частотах.
Слайд 17Модели, рассмотренные Томсоном
Джозеф Джон Томсон
(1856 - 1940)

Слайд 18Модели, рассмотренные Томсоном
Джозеф Джон Томсон
(1856 - 1940)

Слайд 19Модели, рассмотренные Томсоном
Джозеф Джон Томсон
(1856 - 1940)

Слайд 20Модели, рассмотренные Томсоном
Джозеф Джон Томсон
(1856 - 1940)

Слайд 21Начало 20-го века. Модель Томсона.
Джозеф Джон Томсон
(1856 - 1940)

Слайд 22Начало 20-го века. Модель Томсона.
Джозеф Джон Томсон
(1856 - 1940)

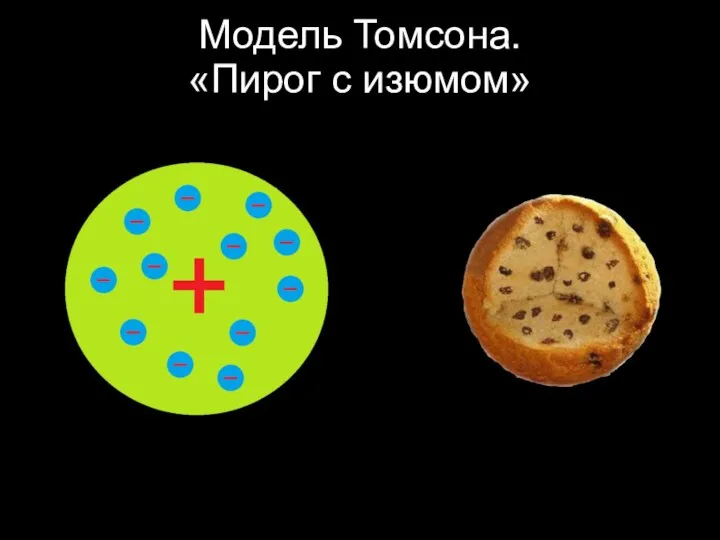
Слайд 23Модель Томсона.
«Пирог с изюмом»

Слайд 24Модель Томсона.
«Пирог с изюмом»
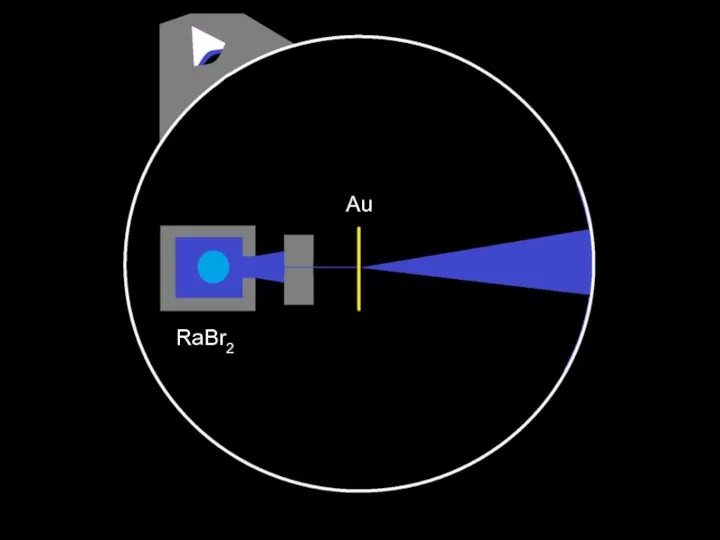
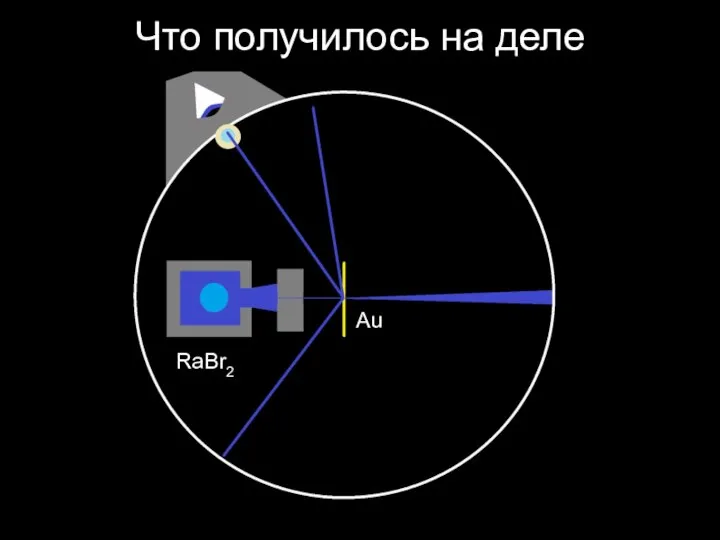
Слайд 25Схема эксперимента Гейгера — Марсдена — Резерфорда (1909)
RaBr2
Au

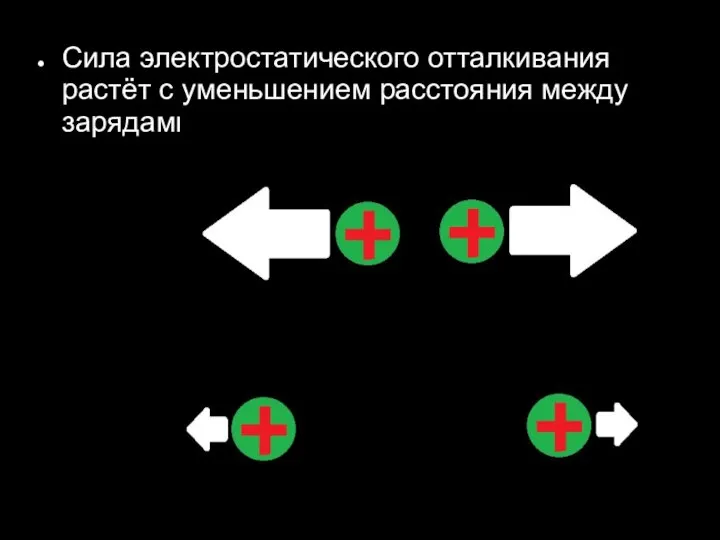
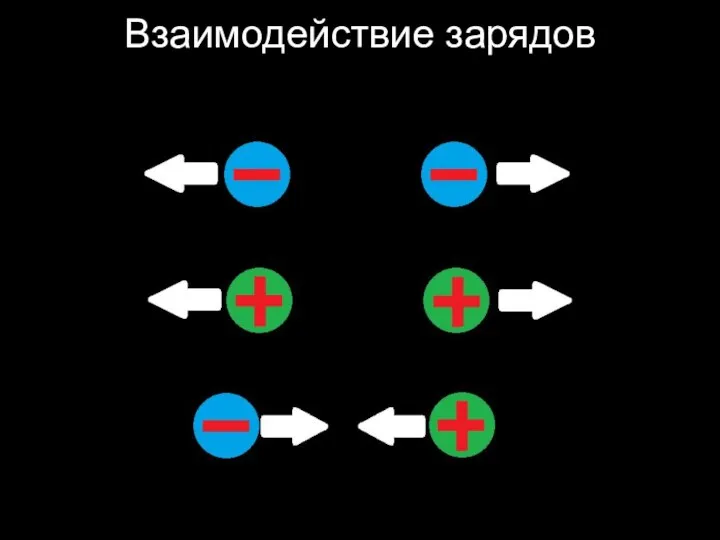
Слайд 27Сила электростатического отталкивания растёт с уменьшением расстояния между зарядами.
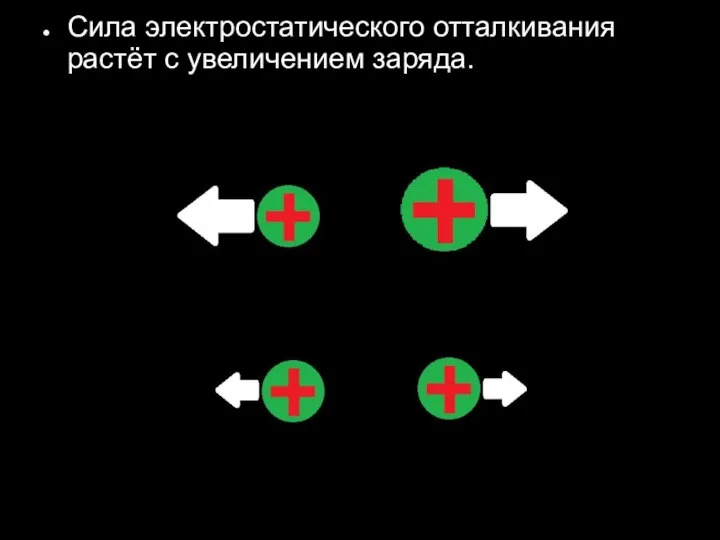
Слайд 28Сила электростатического отталкивания растёт с увеличением заряда.
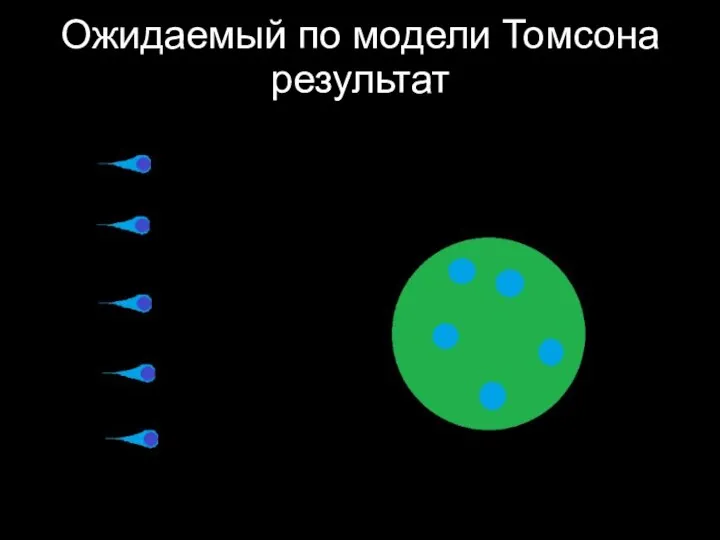
Слайд 29Ожидаемый по модели Томсона результат
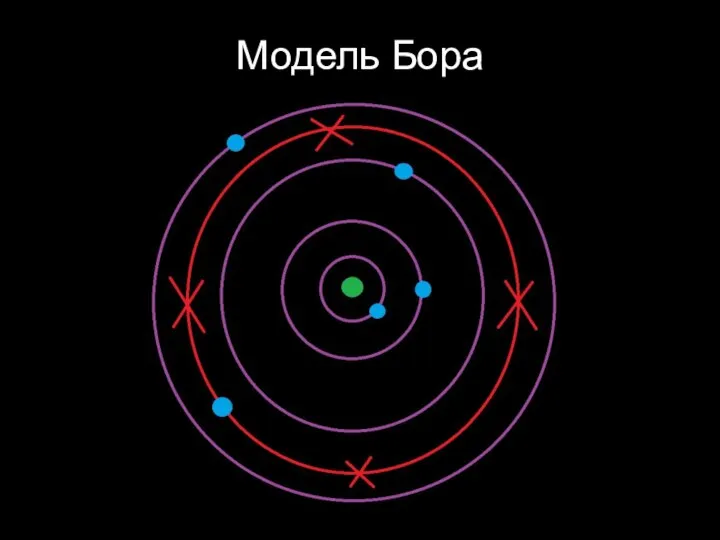
Слайд 33Планетарная модель атома
(Резерфорд)

Слайд 41Ссылки
https://www.chemteam.info/Chem-History/GM-1909.html
Статья Х.Гейгера и Э.Марсдена (английский)
https://www.chemteam.info/Chem-History/Rutherford-1911/Rutherford-1911.html
Статья Э.Резерфорда с объяснением результата опыта (английский)



































 Викторина по физике – физика и ЗОЖ
Викторина по физике – физика и ЗОЖ Техническая учеба по теме: Продольная дифференциальная защита линий
Техническая учеба по теме: Продольная дифференциальная защита линий Презентация
Презентация Демонтаж приборов подачи топлива очистки воздуха и выпуска отработавших газов
Демонтаж приборов подачи топлива очистки воздуха и выпуска отработавших газов Введение в теплотехнику
Введение в теплотехнику Проектирование и использование индивидуальных образовательных маршрутов на уроках физики
Проектирование и использование индивидуальных образовательных маршрутов на уроках физики Радиальное биение
Радиальное биение Линзы. Оптическая сила линзы
Линзы. Оптическая сила линзы Делимость электрического заряда. Электрон. Строение атома
Делимость электрического заряда. Электрон. Строение атома Процесстер мен аппараттар
Процесстер мен аппараттар Методы спектрального анализа. Рефрактометрия
Методы спектрального анализа. Рефрактометрия Летающие модели
Летающие модели Способы рассуждений физиков
Способы рассуждений физиков Явление электромагнитной индукции
Явление электромагнитной индукции Движение тела, брошенного вертикально вверх. 9 класс
Движение тела, брошенного вертикально вверх. 9 класс Особенности распространения и восприятия света
Особенности распространения и восприятия света Режимы течения пленки
Режимы течения пленки Звуковые колебания. Источники звука (9 класс)
Звуковые колебания. Источники звука (9 класс) Презентация на тему Равномерное движение
Презентация на тему Равномерное движение  Изменения агрегатных состояний вещества. Физический диктант
Изменения агрегатных состояний вещества. Физический диктант Презентация на тему Электрическое поле (10 класс)
Презентация на тему Электрическое поле (10 класс)  Элементарные частицы. Античастицы
Элементарные частицы. Античастицы Закон всемирного тяготения. Сила тяжести. Сила упругости. Сила трения. Подготовка к ОГЭ 9 класс
Закон всемирного тяготения. Сила тяжести. Сила упругости. Сила трения. Подготовка к ОГЭ 9 класс Инерция. Урок физики в 7 классе
Инерция. Урок физики в 7 классе Из истории радио
Из истории радио Презентация на тему Лампа накаливания
Презентация на тему Лампа накаливания  Школа Юных Физиков. 8 класс
Школа Юных Физиков. 8 класс Биомеханика. Кинематика. Относительность движения
Биомеханика. Кинематика. Относительность движения