Содержание
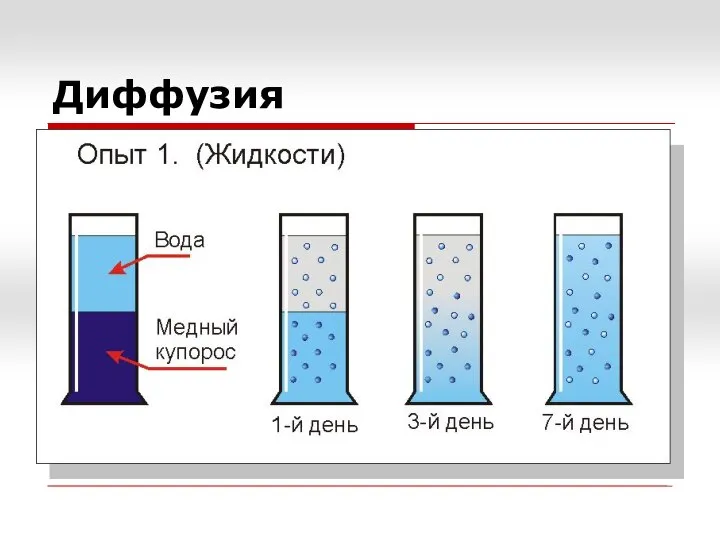
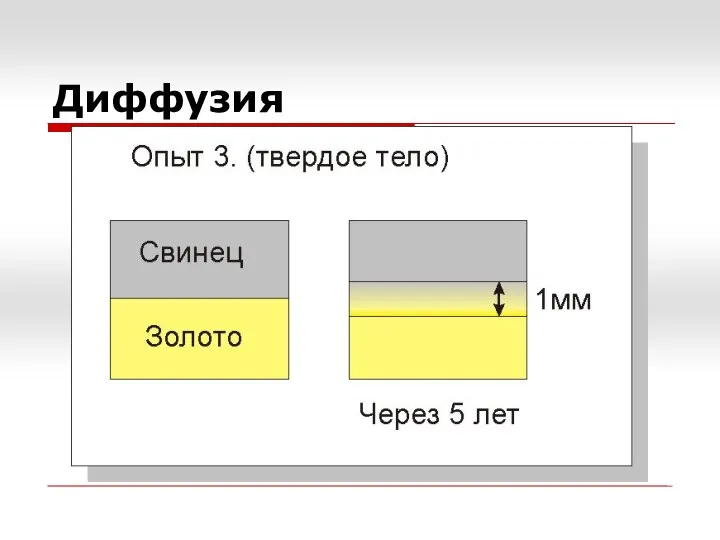
- 2. Диффузия
- 3. Диффузия
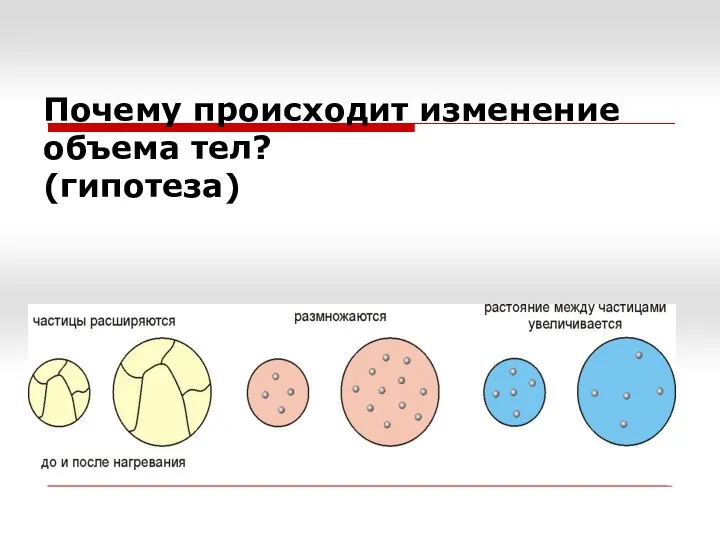
- 4. Почему происходит изменение объема тел? (гипотеза)
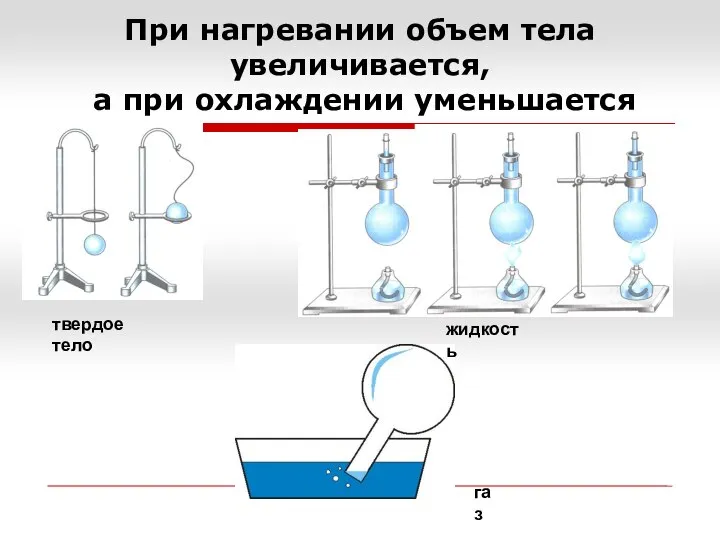
- 5. При нагревании объем тела увеличивается, а при охлаждении уменьшается твердое тело жидкость газ
- 6. Агрегатные состояния вещества твёрдое жидкое газообразное
- 7. Физические величины, характеризующие молекулы: Относительная молекулярная масса Количество вещества Молярная масса
- 8. Масса молекулы. Количество вещества
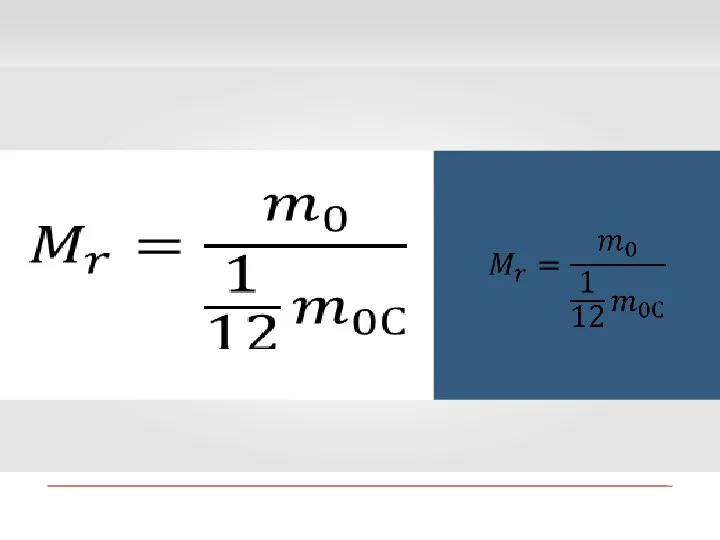
- 9. 1. Относительная молекулярная масса Относительной молекулярной (или атомной) массой вещества Мr называют отношение массы молекулы (или
- 10. Основные понятия молекулярно-кинетической теории – Относительная молекулярная масса; – количество вещества; – постоянная Авогадро; – молярная
- 11. Основные понятия молекулярно-кинетической теории Массу частицы, измеренную в а.е.м. (атомная единица массы), принято называть относительной атомной
- 12. Основные понятия молекулярно-кинетической теории Относительная молекулярная масса молекулы вещества равна сумме относительных атомных масс атомов, составляющих
- 14. 2. Количество вещества Количество вещества – это физическая величина равная отношению числа молекул N в данном
- 16. 3. Молярная масса Молярная масса М – это масса вещества, взятого в количестве 1 моль. Молярная
- 17. Амедео Авогадро 1776–1856 гг. Число Авогадро — число молекул в одном моле любого вещества или число
- 18. Молярная масса (M) равна массе вещества, взятого в количестве 1 моль.
- 19. Другие формулы Масса вещества: Количество вещества: Число молекул: Плотность: Концентрация: Масса молекулы:
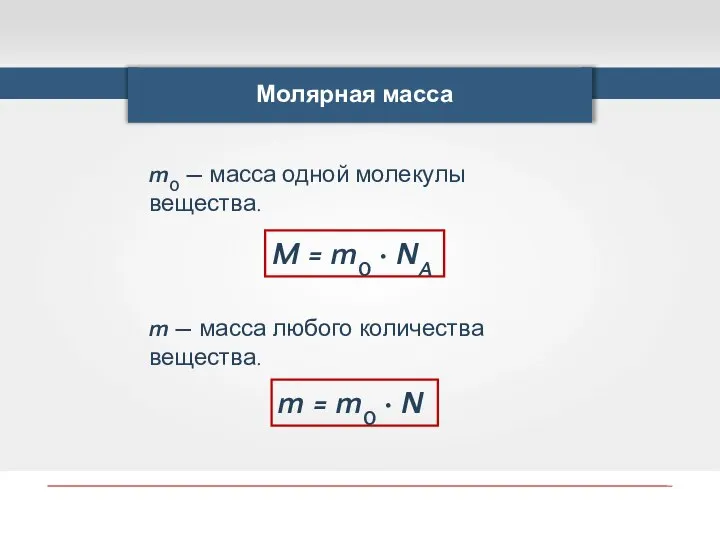
- 20. Молярная масса m0 — масса одной молекулы вещества. M = m0 · NA m — масса
- 22. Скачать презентацию











 Гравитационное взаимодействие
Гравитационное взаимодействие Работа. Энергия. 8 класс
Работа. Энергия. 8 класс Законы сохранения в механике. Решение задач
Законы сохранения в механике. Решение задач Плоская система пар сил и условие её равновесия
Плоская система пар сил и условие её равновесия Вычислительная теплофизика. Лекция 1 [2]
Вычислительная теплофизика. Лекция 1 [2] Презентация на тему Ультрафиолетовые лучи
Презентация на тему Ультрафиолетовые лучи  Система обнаружения и блокировки излучения радиосигнала
Система обнаружения и блокировки излучения радиосигнала Презентация на тему Решение задач по теме «Фотоэффект»
Презентация на тему Решение задач по теме «Фотоэффект»  Электризация в быту
Электризация в быту Механічні властивості матеріалів при розтяганні і стисканні. Лекція № 4
Механічні властивості матеріалів при розтяганні і стисканні. Лекція № 4 Тема 5. Нормирование шер-ти поверх-ти, точности формы и расположение поверх-й
Тема 5. Нормирование шер-ти поверх-ти, точности формы и расположение поверх-й Микроволновая химия. Часть 1
Микроволновая химия. Часть 1 Световые кольца. Лазер
Световые кольца. Лазер Атомно-абсорбционные методы. АSS
Атомно-абсорбционные методы. АSS Электромагнитные явления
Электромагнитные явления Физическая величина
Физическая величина Движение по окружности. Решение задач
Движение по окружности. Решение задач Законы сохранения энергии и импульса
Законы сохранения энергии и импульса Механические волны
Механические волны Понятие о машине и механизме
Понятие о машине и механизме Равноуск. движение
Равноуск. движение Законы Ньютона. Закон всемирного тяготения
Законы Ньютона. Закон всемирного тяготения Электронный нос или что может заменить нос собаки
Электронный нос или что может заменить нос собаки Помпаж. Способы повышения запасов ГДЛУ (борьба с помпажом)
Помпаж. Способы повышения запасов ГДЛУ (борьба с помпажом) Накопление механической энергии
Накопление механической энергии Количество теплоты, обобщающий урок-практикум, 8, 10 класс
Количество теплоты, обобщающий урок-практикум, 8, 10 класс Геометрическая оптика. Свет. Источники света
Геометрическая оптика. Свет. Источники света Электроемкость, конденсаторы
Электроемкость, конденсаторы