Содержание
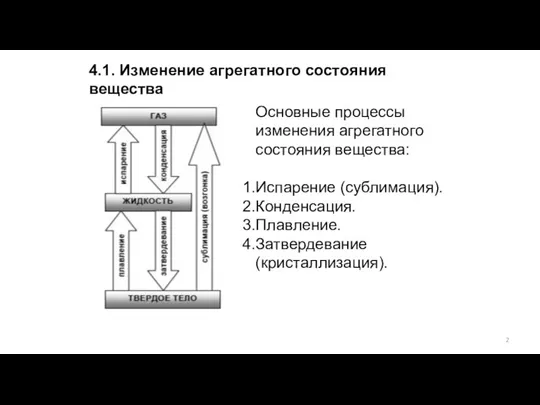
- 2. 4.1. Изменение агрегатного состояния вещества Основные процессы изменения агрегатного состояния вещества: Испарение (сублимация). Конденсация. Плавление. Затвердевание
- 3. Испарение (парообразование) – отрыв молекул от поверхности жидкости и переход в окружающее пространство (при любой температуре).
- 4. Q — количество теплоты, получаемое телом при плавлении. Температура Tпл остается постоянной до тех пор, пока
- 5. Q' — количество теплоты, отдаваемое телом при кристаллизации. При постоянной температуре, равной Tпл, начинается кристаллизация. Центры
- 6. 4.2. Фазовые переходы I и II рода Фазой называется равновесное состояние вещества, отличающееся по физическим свойствам
- 7. Фазовые переходы I рода – это переход, сопровождающийся поглощением или выделением теплоты. Фазовые переходы I рода
- 8. Фазовые переходы II рода Эти переходы характеризуются постоянством объема и энтропии, но скачкообразным изменением теплоемкости. Примеры:
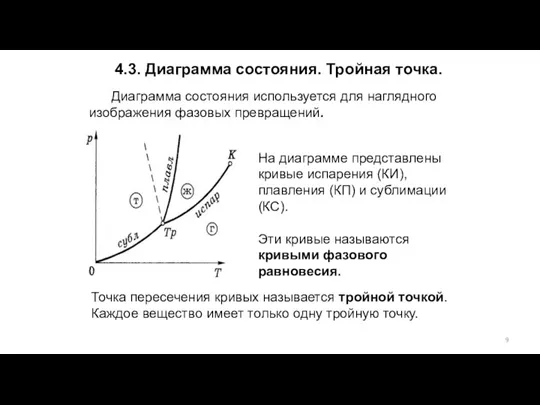
- 9. Диаграмма состояния используется для наглядного изображения фазовых превращений. 4.3. Диаграмма состояния. Тройная точка. На диаграмме представлены
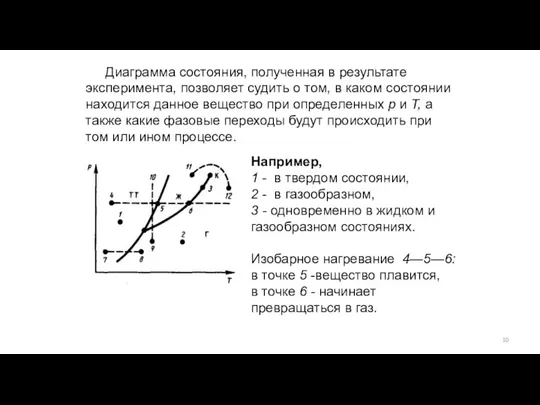
- 10. Диаграмма состояния, полученная в результате эксперимента, позволяет судить о том, в каком состоянии находится данное вещество
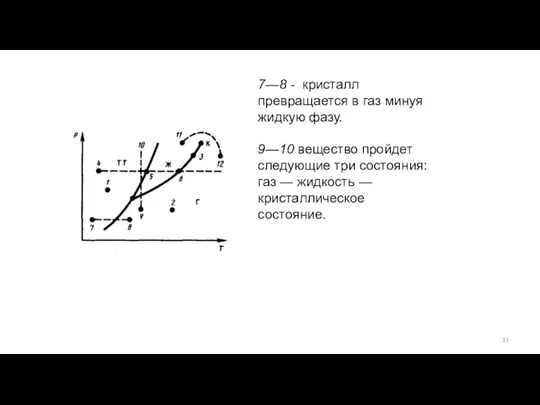
- 11. 7—8 - кристалл превращается в газ минуя жидкую фазу. 9—10 вещество пройдет следующие три состояния: газ
- 13. Скачать презентацию






 Разработка технологии установки, эксплуатации и ремонта судовых аккумуляторов
Разработка технологии установки, эксплуатации и ремонта судовых аккумуляторов Античастица, антивещество и антимир
Античастица, антивещество и антимир Вещества. Науки о природе
Вещества. Науки о природе Энергия. Потенциальная и кинетическая энергия тел
Энергия. Потенциальная и кинетическая энергия тел Прикладная механика. Установочная лекция (Тема 1-5 )
Прикладная механика. Установочная лекция (Тема 1-5 ) Магнитное взаимодействие Изучение свойств магнита Учитель И.А. Попова
Магнитное взаимодействие Изучение свойств магнита Учитель И.А. Попова Ядерная геофизика
Ядерная геофизика Механическое движение. Векторы
Механическое движение. Векторы Электромагнитные колебания
Электромагнитные колебания 45. Применение правила равновесия рычага к блоку
45. Применение правила равновесия рычага к блоку Формулы Человечек и Цветочек
Формулы Человечек и Цветочек Закон Джоуля-Ленца. Плотность тока. Скорость движения электронов в проводнике
Закон Джоуля-Ленца. Плотность тока. Скорость движения электронов в проводнике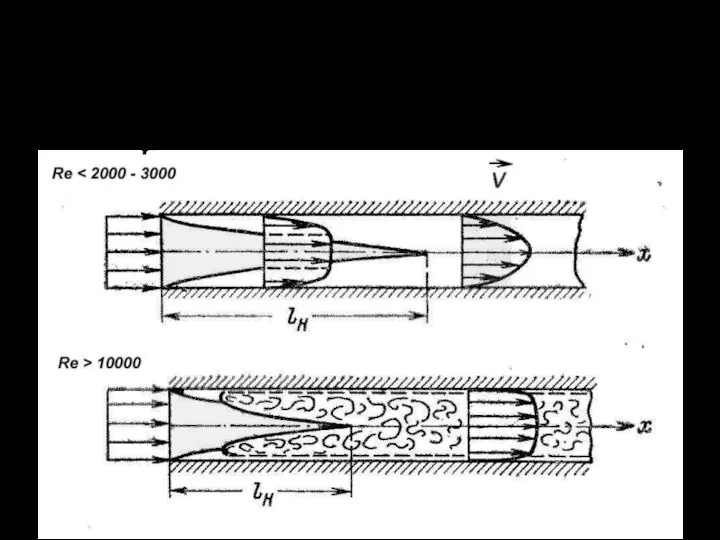 Установившееся течение газа через длинный трубопровод
Установившееся течение газа через длинный трубопровод Электрический ток. Источники электрического тока
Электрический ток. Источники электрического тока Инструкция по наладке узла управления отопления по независимой схеме
Инструкция по наладке узла управления отопления по независимой схеме Работа и мощность электрического тока. Закон Джоуля-Ленца. КПД источника тока
Работа и мощность электрического тока. Закон Джоуля-Ленца. КПД источника тока Излучение. Примеры излучения
Излучение. Примеры излучения Определение реакций подшипников пространственного нагруженного вала
Определение реакций подшипников пространственного нагруженного вала Варикапы. Основные параметры варикапов
Варикапы. Основные параметры варикапов Аккумулирование энергии
Аккумулирование энергии Летняя практика
Летняя практика Механические волны
Механические волны Проектирование участка механической обработки детали Вал тихоходный на базе предприятия ПАО Кузнецов
Проектирование участка механической обработки детали Вал тихоходный на базе предприятия ПАО Кузнецов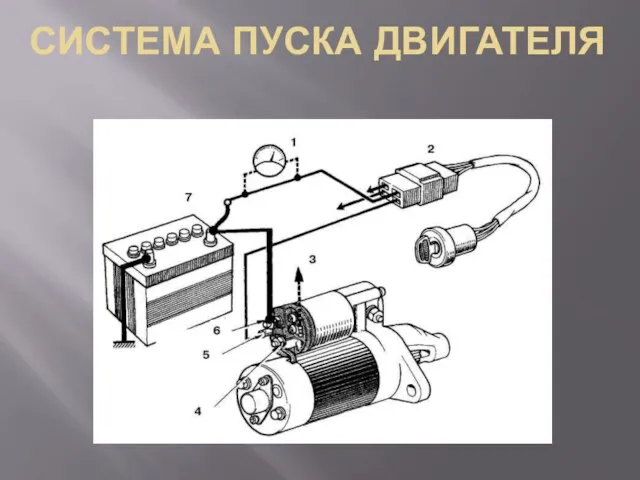 Система пуска двигателя
Система пуска двигателя Нарезание и отделка зубчатых колес
Нарезание и отделка зубчатых колес Закон Ома. Сопротивление цепи
Закон Ома. Сопротивление цепи Отправляемся в поход с физикой
Отправляемся в поход с физикой Вес воздуха. Атмосферное давление
Вес воздуха. Атмосферное давление