Содержание
- 2. Газовые законы — количественные зависимости между двумя параметрами газа прификсированном значении третьего.
- 3. Изопроцесс — это идеализированная модель реального процесса, которая только приближённо отражает действительность.
- 4. Лишь в лабораторных условиях удаётся поддерживать постоянство того или иного параметра с высокой точностью.
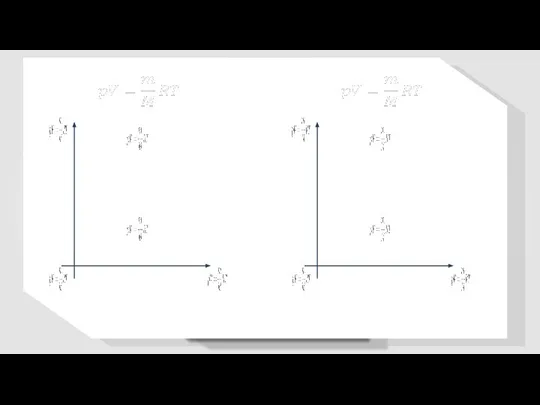
- 5. Уравнение состояния идеального газа.
- 6. Уравнение состояния идеального газа.
- 7. Уравнение Клапейрона
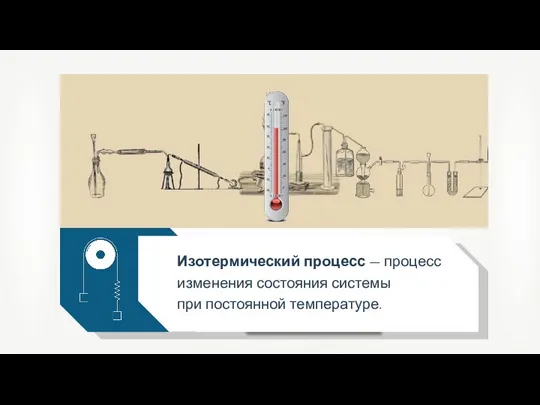
- 8. Изотермический процесс — процесс изменения состояния системы при постоянной температуре.
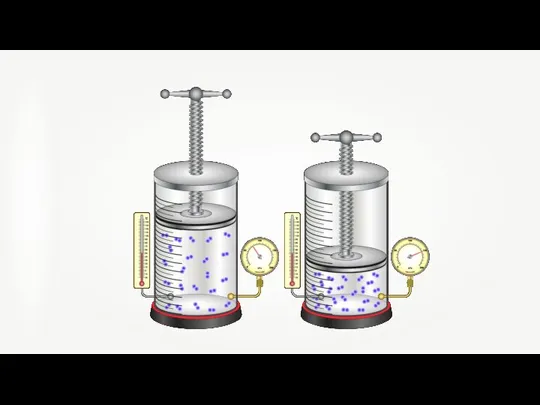
- 9. Для изотермического процесса произведение давления газа на его объём постоянно.
- 10. Роберт Бойль 1627–1691 гг. Закон Бойля-Мариотта справедлив обычно для любых газов, а также и для их
- 11. Давление газа обратно пропорционально его объёму.
- 12. Зависимость давления от объёма Изотерма График зависимости давления газа от объёма
- 13. Чем выше температура, тем выше давление. График зависимости объёма газа от температуры
- 14. График зависимости давления газа от температуры
- 16. При сжатии газ нагревается, так как при движении поршня в сосуде скорость молекул после ударов о
- 17. Поэтому для реализации изотермического процесса надо после небольшого смещения поршня подождать, когда температура газа в сосуде
- 18. При быстром сжатии давление под поршнем сразу становится больше, чем во всём сосуде. Если систему предоставить
- 20. Процесс, при котором все промежуточные состояния газа являются равновесными, называют равновесным процессом.
- 21. Процесс, при котором все промежуточные состояния газа являются равновесными, называют равновесным процессом.
- 22. Изохорный процесс — процесс изменения состояния системы при постоянном объёме.
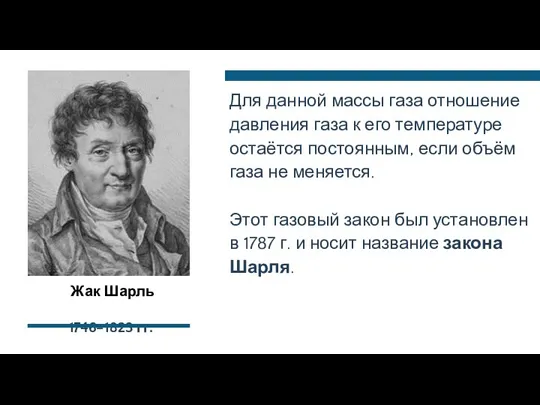
- 23. Жак Шарль 1746–1823 гг. Для данной массы газа отношение давления газа к его температуре остаётся постоянным,
- 24. Закон Шарля не соблюдается в области низких температур, близких к температуре сжижения (конденсации) газов.
- 25. Чем больше объём сосуда, тем меньшее давление газ будет оказывать на стенки сосуда. Изохора Графики изохорного
- 26. С ростом объёма газа при постоянной температуре давление его согласно закону Бойля-Мариотта падает. Графики изохорного процесса.
- 27. Графики зависимости давления от объёма и температуры.
- 29. Изобарный процесс — процесс изменения состояния системы при постоянном давлении.
- 30. Ж.Л. Гей-Люссак 1778–1850 гг. Для газа данной массы отношение объёма газа к его температуре остаётся постоянным,
- 31. Графики изобарного процесса. Изобара
- 33. Все газы при сильном охлаждении превращаются в жидкости, а к жидкостям уравнение состояния неприменимо.
- 34. Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем, если внешнее давление
- 35. Роберт Бойль 1627–1691 гг. Жак Шарль 1746–1823 гг. Ж.Л. Гей-Люссак 1778–1850 гг.
- 36. Отношение произведения давления газа и объёма к температуре для данной массы газа — величина постоянная.
- 38. Скачать презентацию































 Презентация на тему Измерительные приборы
Презентация на тему Измерительные приборы  Основные понятия о точности и взаимозаменяемости
Основные понятия о точности и взаимозаменяемости Санитарно-гигиенический контроль за микроклиматом помещений аптек
Санитарно-гигиенический контроль за микроклиматом помещений аптек Электромагнитный генератор
Электромагнитный генератор Изменение физических величин в процессах, часть 2
Изменение физических величин в процессах, часть 2 Электромагнитная индукция
Электромагнитная индукция Презентация на тему Давление света
Презентация на тему Давление света  Магнитный поток
Магнитный поток Ракетный двигатель
Ракетный двигатель Естествознание
Естествознание Часы. Общие сведения
Часы. Общие сведения Определение радиуса r и высоты h открытого цилиндрического резервуара для хранения масла емкостью V
Определение радиуса r и высоты h открытого цилиндрического резервуара для хранения масла емкостью V Триггеры и сумматоры Устройства АЛУ
Триггеры и сумматоры Устройства АЛУ Кривошипно-шатунный механизм
Кривошипно-шатунный механизм Задачи 14, 15. Теплопроводность плоской стенки
Задачи 14, 15. Теплопроводность плоской стенки Электромонтажные и сборочные технологии
Электромонтажные и сборочные технологии Расчет тепловых потерь трубопроводов и тепловой изоляции тепловых сетей
Расчет тепловых потерь трубопроводов и тепловой изоляции тепловых сетей Радиоактивность. Модели атомов. 9 класс
Радиоактивность. Модели атомов. 9 класс Кручение. Основные понятия деформации кручения
Кручение. Основные понятия деформации кручения Свойства дискретно-временного преобразования Фурье
Свойства дискретно-временного преобразования Фурье Тепловое движение. Температура. Внутренняя энергия
Тепловое движение. Температура. Внутренняя энергия Характеристика волн
Характеристика волн Постоянный электрический ток
Постоянный электрический ток Отчёт по педагогической практике. Страны и континенты. Разные страны. Промыслы, культура
Отчёт по педагогической практике. Страны и континенты. Разные страны. Промыслы, культура Решение задач репетиционного тестирования по физике, этап 1
Решение задач репетиционного тестирования по физике, этап 1 Презентация на тему Определение плотности твердого тела
Презентация на тему Определение плотности твердого тела  Термометры биметаллические показывающие в диапазоне измерения температур от минус 50 до плюс 200° С
Термометры биметаллические показывающие в диапазоне измерения температур от минус 50 до плюс 200° С Сила трения. Трение в природе и технике. Явление трения
Сила трения. Трение в природе и технике. Явление трения