Слайд 2Закон сохранения энергии
Энергия в природе не возникает из ничего и не исчезает:

количество энергии неизменно, она только переходит из одной формы в другую.
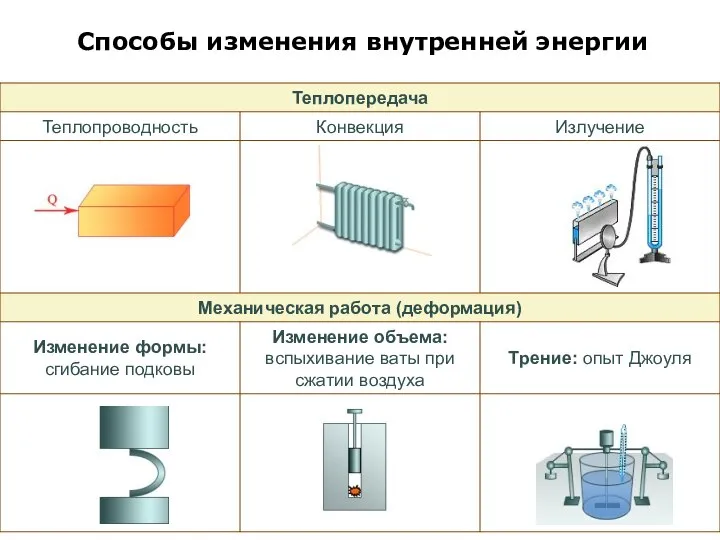
Слайд 3Способы изменения внутренней энергии
Слайд 4I закон термодинамики
внутренняя энергия определяется только состоянием системы, причем изменение внутренней энергии
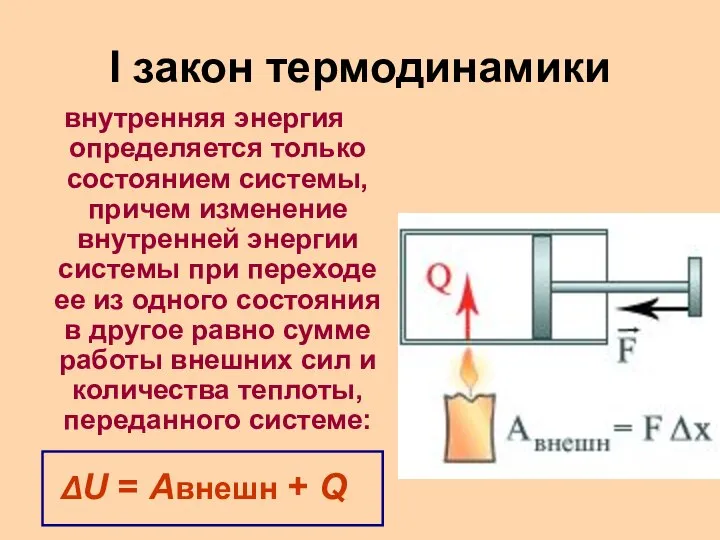
системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
ΔU = Aвнешн + Q
Слайд 5Если при нагревании газ расширяется и при этом совершает работу A, то

первый закон термодинамики можно сформулировать по-другому:
Q = ΔU + AI
Количество теплоты, переданное газу, равно сумме изменения его внутренней энергии и работы, совершенной газом.
Так как работа газа и работа внешних сил вследствие 3-го закона Ньютона равны по модулю и имеют противоположный знак:
Aвнешн = –AI
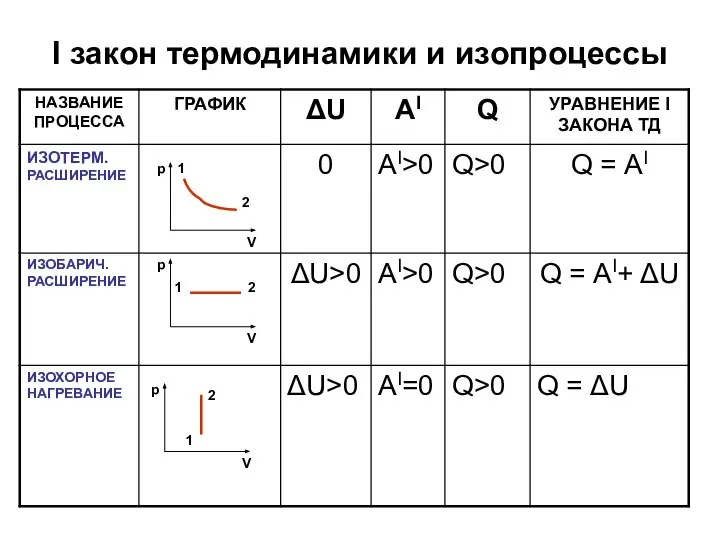
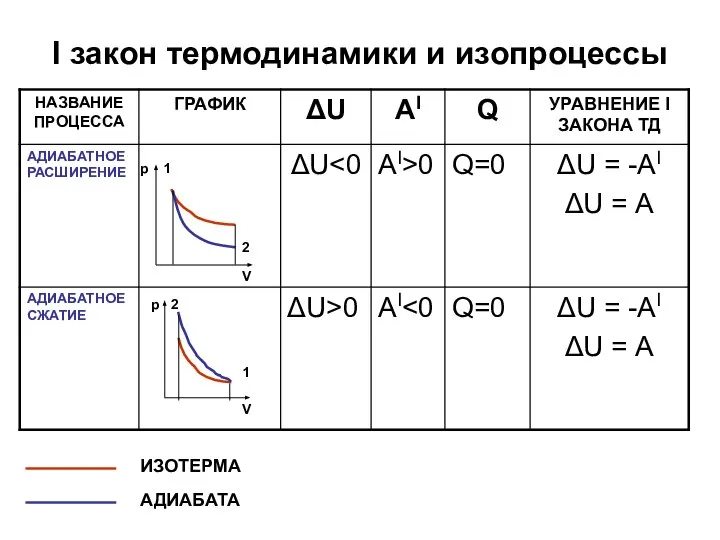
Слайд 6I закон термодинамики и изопроцессы
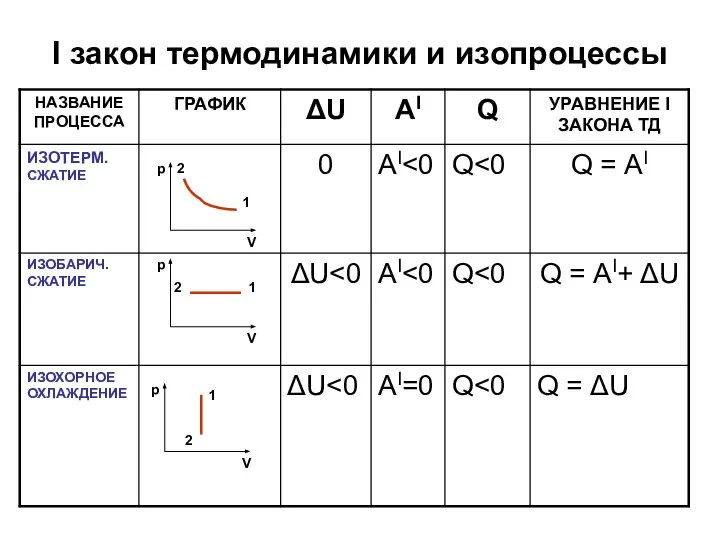
Слайд 7I закон термодинамики и изопроцессы
Слайд 8Адиабатный процесс
– это модель термодинамического процесса, происходящего в системе без теплообмена с
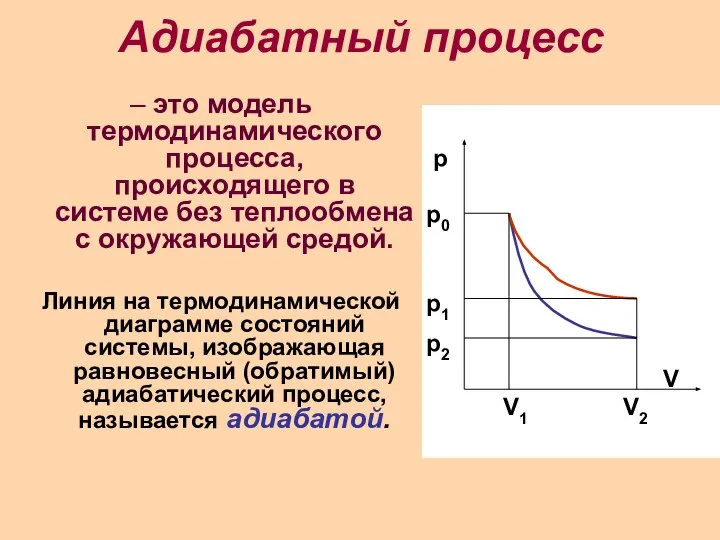
окружающей средой.
Линия на термодинамической диаграмме состояний системы, изображающая равновесный (обратимый) адиабатический процесс, называется адиабатой.
Слайд 9I закон термодинамики и изопроцессы
V
р
1
2
ИЗОТЕРМА
АДИАБАТА
V
р
2
1
Слайд 12Обратимый процесс
Это процесс, который может происходить как в прямом, так и в

обратном направлении
Обратимый процесс – это идеализация реального процесса.
Все макроскопические процессы проходят в определенном направлении
Слайд 13Необратимый процесс
Процесс, обратный которому самопроизвольно не происходит
Все макроскопические процессы являются необратимыми

Слайд 14Примеры
Кусок льда, внесенный в комнату, не отдает энергию окружающей среде и не

охлаждается
Маятник самостоятельно не наращивает амплитуду колебаний
Слайд 15Ни охлаждение льда в первом случае, ни увеличение амплитуды во втором не

противоречит ни закону сохранения энергии, ни законам механики. Оно противоречит лишь второму закону термодинамики
Слайд 16Второй закон термодинамики
В циклически действующем тепловом двигателе невозможно преобразовать все количество теплоты,

полученное от нагревателя, в механическую работу
Слайд 17Формулировка Р. Клаузиуса
Невозможно перевести тепло от более холодной системы к более горячей

при отсутствии одновременных изменений в обоих системах или окружающих телах
Слайд 18Формулировка У. Кельвина
Невозможно осуществить такой периодический процесс, единственным результатом которого было бы

совершение работы за счет теплоты взятой от одного источника
Слайд 19Статистическое истолкование второго закона термодинамики
Изолированная система самопроизвольно переходит из менее вероятного состояния

в более вероятное, или
Замкнутая система многих частиц самопроизвольно переходит из более упорядоченного состояния в менее упорядоченное

















 Тепловое действие электрического тока
Тепловое действие электрического тока Практическое занятие Разработка и оформление технологической документации
Практическое занятие Разработка и оформление технологической документации Магнетизм
Магнетизм Технические измерения
Технические измерения Система смазки карбюраторного двигателя
Система смазки карбюраторного двигателя Выпрямительные модули ЭПУ
Выпрямительные модули ЭПУ Использование томографии в сейсморазведке. Математическая основа томографического подхода
Использование томографии в сейсморазведке. Математическая основа томографического подхода Электромагнитная индукция
Электромагнитная индукция OVZ_Zanyatie_3
OVZ_Zanyatie_3 Презентация на тему Двигатель внутреннего сгорания: принципы
Презентация на тему Двигатель внутреннего сгорания: принципы  Контроль формы оптических поверхностей пробным стеклом, на интерферометре Физо и на неравноплечем лазерном интерферометре
Контроль формы оптических поверхностей пробным стеклом, на интерферометре Физо и на неравноплечем лазерном интерферометре Мембранные процессы
Мембранные процессы Радиоэлектроника
Радиоэлектроника Квалификационная работа. Тема: Спроектировать сборочную оснастку для сборки воздушный тормоз орбитального корабля-ракетоплана
Квалификационная работа. Тема: Спроектировать сборочную оснастку для сборки воздушный тормоз орбитального корабля-ракетоплана Проектирование компрессорных установок горных предприятий. Занятие 7
Проектирование компрессорных установок горных предприятий. Занятие 7 Энергия. Потенциальная и кинетическая энергия. Закон сохранения энергии
Энергия. Потенциальная и кинетическая энергия. Закон сохранения энергии Оптика. Раздел 5
Оптика. Раздел 5 Техника и техническое устройство. Понятие о машине
Техника и техническое устройство. Понятие о машине 10_ ОТС_ Методы анализа ЛИС-цепей 14
10_ ОТС_ Методы анализа ЛИС-цепей 14 Электрическое сопротивление
Электрическое сопротивление Кинематические характеристики механического движения
Кинематические характеристики механического движения Солнечное излучение как совокупность ресурсов
Солнечное излучение как совокупность ресурсов Дисперсия и интерференция света Шабанова Галина Сергеевна Учитель физики КГКОУ «Вечерняя (см
Дисперсия и интерференция света Шабанова Галина Сергеевна Учитель физики КГКОУ «Вечерняя (см Колебания. Гармонические колебания. Затухающие и вынужденные колебания
Колебания. Гармонические колебания. Затухающие и вынужденные колебания Электромагнитное поле
Электромагнитное поле Физика дайвинга
Физика дайвинга Гуманитарная направленность преподавания физики при организации самостоятельной работы студентов
Гуманитарная направленность преподавания физики при организации самостоятельной работы студентов Поперечный изгиб
Поперечный изгиб