за материальные точки).
2. Молекулы находятся на больших расстояниях друг от друга и движутся хаотически ( все направления движения молекул равноправны ) .
3. Молекулы взаимодействуют по законам упругих столкновений , силами притяжения между молекулами пренебрегают.
4. Скорости молекул разнообразны, но при определенной температуре средняя скорость молекул остается постоянной.
5. Все соударения молекул являются абсолютно упругими
Реальный газ
1. Молекулы реального газа не являются точечными образованиями, диаметры молекул лишь в десятки раз меньше расстояний между молекулами.
2. Молекулы не взаимодействуют по законам упругих столкновений.






 Использование видеоматериалов на уроках физики как способ повышения самоэффективности личности школьника
Использование видеоматериалов на уроках физики как способ повышения самоэффективности личности школьника Умная колонка на уроках физики
Умная колонка на уроках физики Гук Роберт (1635 - 1703). Закон Гука
Гук Роберт (1635 - 1703). Закон Гука Самостоятельная работа 66 урок
Самостоятельная работа 66 урок Теория гироскопов
Теория гироскопов Пластическая и упругая деформация
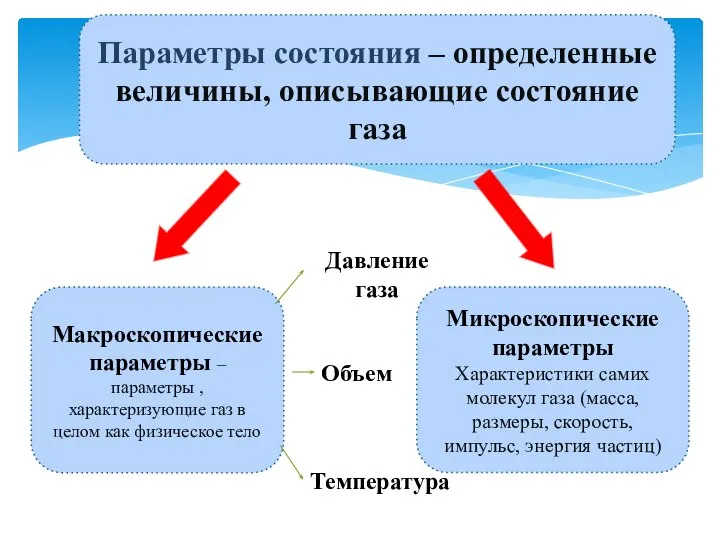
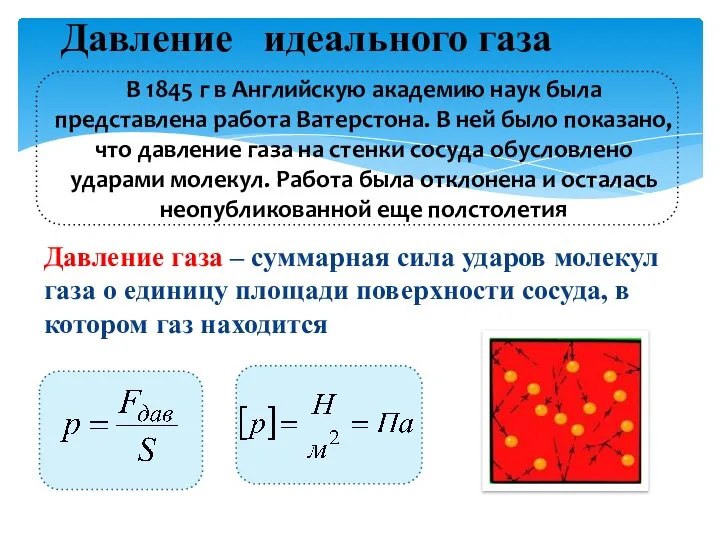
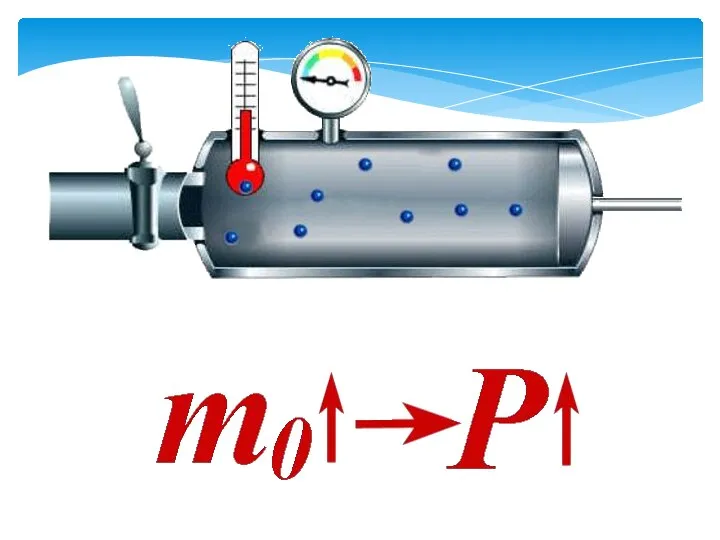
Пластическая и упругая деформация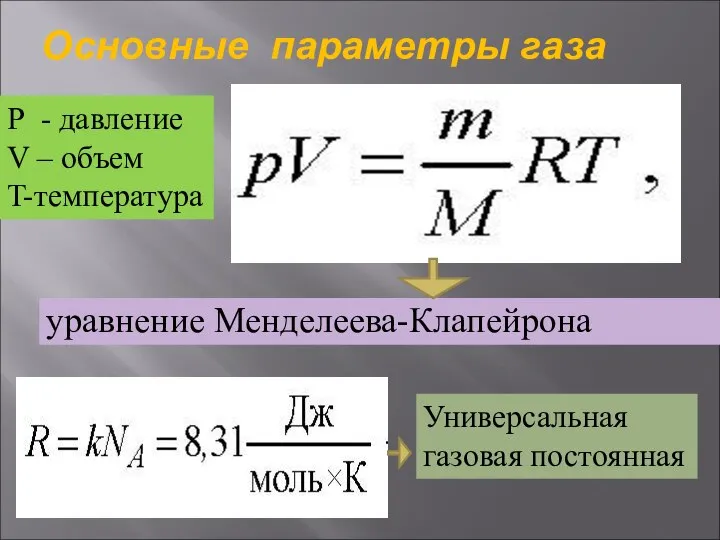 Основные параметры газа
Основные параметры газа Гармонические колебания. Затухающие и вынужденные колебания. Резонанс
Гармонические колебания. Затухающие и вынужденные колебания. Резонанс Пространственная система сил
Пространственная система сил Критерии оценки подвески
Критерии оценки подвески Термоэлектрические преобразователи (термопара). Область применения
Термоэлектрические преобразователи (термопара). Область применения Наблюдения и опыты на уроках физики
Наблюдения и опыты на уроках физики Научная лаборатория. Рассказ о профессии физик-химик
Научная лаборатория. Рассказ о профессии физик-химик Механизм натяжения сетки. Часть 1
Механизм натяжения сетки. Часть 1 Механика. Закон Архимеда
Механика. Закон Архимеда Исследование изменения со временем температуры остывающей воды
Исследование изменения со временем температуры остывающей воды Строение атома
Строение атома Механика
Механика Общие положения по ремонту автомобилей (лекция 1)
Общие положения по ремонту автомобилей (лекция 1) Электромагнитные волны. Явления интерференции и дифракции
Электромагнитные волны. Явления интерференции и дифракции Нанотехнологии. Наноматериалы. Углеродные наноструктуры
Нанотехнологии. Наноматериалы. Углеродные наноструктуры Из истории радио
Из истории радио Вал изгиб с кручением
Вал изгиб с кручением Роль трансформаторов в электропередаче
Роль трансформаторов в электропередаче Бином Ньютона
Бином Ньютона Презентация на тему Магнитный поток
Презентация на тему Магнитный поток  Влияние радиационного фона на здоровье человека
Влияние радиационного фона на здоровье человека Интерференция света
Интерференция света